Science子刊:吴青峰/吝易团队揭示青春期启动的发育编程机制
时间:2022-11-18 20:54:04 热度:37.1℃ 作者:网络
下丘脑是中枢神经系统最为复杂的脑区之一,神经元高度多样化,通过调控自主神经、内分泌和本能行为等控制哺乳动物机体内稳态。下丘脑不仅通过调控个体摄食、饮水、体温、睡眠、渗透压、昼夜节律等功能来保证个体生存,也控制着青春期启动和两性生殖能力以确保种群繁衍。虽然我们对下丘脑如何调控摄食、睡眠和体温等有了深入的认识,但对其参与调控青春期启动的机制仍不可知,这个问题也被 Science 列为125个最具前沿性的科学难题之一。
2022年11月17日,中国科学院遗传与发育生物学研究所吴青峰团队和清华大学生命科学学院吝易团队在 Science Advances 期刊在线发表了题为:Hierarchical deployment of Tbx3 dictates the identity of hypothalamic KNDy neurons to control puberty onset 的研究论文。
该研究在从发育编程的角度揭示哺乳动物青春期启动机制的同时,也提出了转录因子调控神经元谱系发生的新范式,对后续理论研究具有重要参考意义。

过去的遗传学研究显示转录因子TBX3突变可以导致人类罹患尺骨-乳腺综合征(Ulnar-mammary syndrome,简称UMS),其特点是乳腺发育缺陷和手及前臂骨骼发育异常,但最值得关注的是UMS患者出现严重的青春期启动延迟症状。
在吴青峰团队的工作中,研究人员发现Tbx3定义了下丘脑的一个亚谱系,并作为命运决定子序列性地调控神经元命运的建立和维持过程。
在动物水平上,Tbx3的基因缺陷会导致小鼠的青春期启动显著延迟,雌性小鼠的发情周期彻底紊乱、卵巢无法正常排卵,最终引发不育症;在细胞水平上,Tbx3对于建立和维持下丘脑KNDy神经元(调控青春期启动的关键神经元)的命运发挥重要作用;在分子水平上,两个研究团队合作发现Tbx3通过相分离调控基因转录,从而诱导神经肽的表达。值得注意的是,导致人类罹患UMS的多个TBX3突变体都不能发生有效的相分离,同时也显著丧失了对神经肽表达的调控能力,使得患者出现青春期启动延迟的症状。
在下丘脑谱系建立和神经发生的理论研究方面,研究人员通过比对“基于谱系追踪”和“基于基因操作”的两个单细胞转录组数据库,发现命运决定子不仅可以通过经典的谱系依赖性方式,还可以通过两种谱系非依赖性方式调控神经元的命运,研究人员分别将其命名为谱系内保留(intra-lineage retention,ILR)和谱系间互作(inter-lineage interaction,ILI),这两种方式还可能伴随着谱系非依赖性代偿(lineage-independent compensation,LIC),共同决定了疾病发生过程中大脑内神经元的命运。
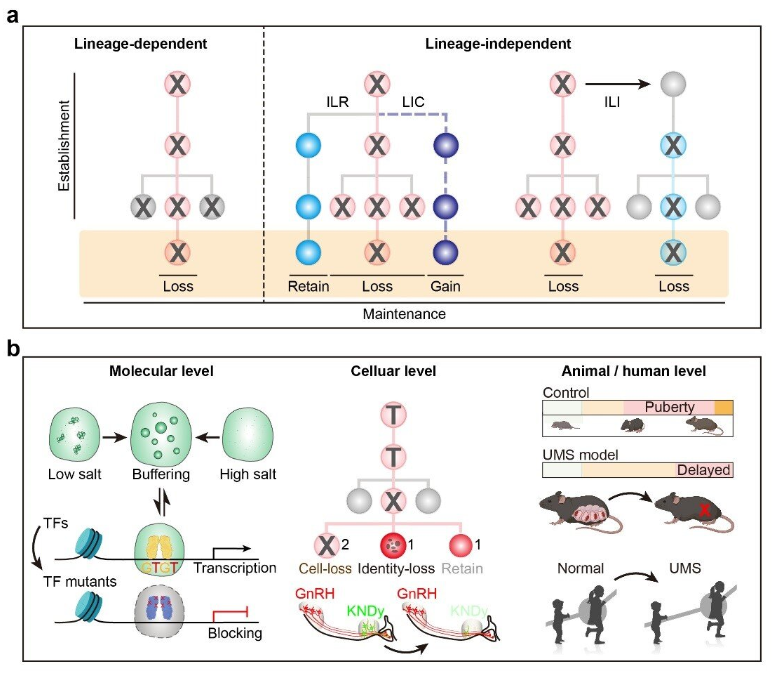
图:研究概况。a. 谱系依赖与谱系非依赖性命运决定机制(ILR,谱系内保留;LIC,谱系非依赖性补偿;ILI,谱系间交互),b. 本研究在分子水平、细胞水平、动物水平获得的关键进展(TF,转录因子;UMS,尺骨乳腺综合征)
审稿人在评审过程中都一致认为,这项研究“非常有趣、深入,包含了新的数据资源和科学概念,是以非常高的质量和标准完成的,对下丘脑发育这一领域很可能有重要的意义”。
综上所述,该研究以人类遗传学研究为切入点,揭示了Tbx3序列性调控下丘脑KNDy神经元的命运进而诱发青春期启动的过程,为青春期启动的发育编程机制提供了新的视角。下丘脑命运调节子是决定神经元命运发生发展的重要调控元件,而其背后复杂的多元调控网络仍值得我们去探索。
中国科学院遗传与发育生物学研究所吴青峰研究员和清华大学吝易助理教授为论文共同通讯作者,博士研究生石翔(吴青峰组)、庄妍榕(吝易组)和陈振华(吴青峰组)为论文共同第一作者。本研究得到国家重点研发计划、国家自然科学基金、中科院先导、百人计划等重大项目资助,也得到了西湖大学裴端卿教授、中科院遗传发育所姜丹华研究员、杭州华大生命科学研究院刘龙奇院长的支持。
论文链接:
https://www.science.org/doi/10.1126/sciadv.abq2987


