【专题论著】| 乳腺癌内乳前哨淋巴结活检评估预后及指导个体化内乳照射:一项长期随访研究
时间:2023-07-19 11:14:59 热度:37.1℃ 作者:网络
[摘要] 背景与目的:内乳照射(internal mammary lymph node irradiation,IMNI)可以改善内乳淋巴结(internal mammary lymph node,IMLN)高危转移患者的生存。本研究旨在探讨内乳前哨淋巴结活检(internal mammary sentinel lymph node biopsy,IM-SLNB)对评估预后及指导个体化IMNI的优势。方法:回顾性分析2011年11月—2021年12月在3项前瞻性临床试验(NCT01642511、NCT03541278、NCT03024463)中成功行IM-SLNB的浸润性乳腺癌患者,筛选预后的独立危险因素,分析内乳前哨淋巴结(internal mammary sentinel lymph node,IMSLN)转移对预后的影响;在接受区域淋巴结照射者中分析IMNI实施状况、生存获益及对放射性肺损伤(radiation induced lung injury,RILI)的影响。主要研究终点为无病生存期(disease-free survival,DFS),次要研究终点为总生存期(overall survival,OS)和RILI。结果:研究入组537例患者,中位随访60个月。IMSLN转移状况是DFS及OS的独立危险因素(P均<0.05),与IMSLN阴性组患者相比,IMSLN阳性组患者DFS及OS显著降低(P均<0.05)。IMSLN阴性患者增加IMNI并没有显著改善DFS(P=0.099)和OS(P=0.486),但RILI的风险显著增高(OR=3.678,P<0.05)。对于IMSLN阳性患者,增加IMNI可显著改善5年DFS(87.3% vs 52.5%,P=0.040),但并未转化为OS的获益(P=0.603)。结论:IMSLN的转移状况是独立的预后因素,IMSLN转移的患者接受IMNI可显著改善预后,IMSLN未转移的患者通过豁免IMNI可在不影响预后的情况下显著降低RILI的风险。
[关键词] 乳腺癌;前哨淋巴结活检;内乳淋巴结;照射;预后
[Abstract] Background and purpose: Internal mammary lymph node irradiation (IMNI) improves survival in patients with internal mammary lymph node (IMLN) high-risk metastatic breast cancer. The purpose of this study was to study the advantages of internal mammary sentinel lymph node (IMLN) biopsy (IM-SLNB) for assessing prognosis and directing individualized IMNI. Methods: This study evaluated patients recruited in three prospective clinical trials (NCT01642511, NCT03541278, and NCT03024463) from November 2011 to December 2021, assessed for prognostic risk variables based on IMSLN metastatic status and prognosis between subgroups. In patients who received regional lymph node irradiation, the implementation status, survival benefit, and influence of IMNI on radiation-induced lung injury (RILI) were studied. The primary endpoint was disease-free survival (DFS), with overall survival (OS) and RILI as secondary endpoints. Results: The study enrolled 537 patients and had a 60-month median follow-up. Patients with IMSLN metastasis had a significantly worse 5-year DFS and OS (DFS: 95.1% vs 71.4%, OS: 99.1% vs 90.1%, both P<0.05), and IMSLN metastatic status was an independent risk factor for DFS and OS (both P<0.05). Adding IMNI did not improve DFS (P=0.099) or OS (P=0.486) in patients with negative IMSLN, while it did increase the risk of RILI (OR=3.678, P<0.05). However, adding IMNI improved 5-year DFS (87.3% vs 52.5%, P=0.040) for patients with positive IMSLN but had no effect on OS (P=0.603). Conclusion: This study discovered that IMSLN metastatic status has significant prognostic importance. Patients with IMSLN metastasis who receive IMNI have significantly improved prognosis, and patients without IMSLN metastasis have a much lower risk of RILI by being exempt from IMNI without worse prognosis.
[Key words] Breast cancer; Sentinel lymph node biopsy; Internal mammary lymph nodes; Irradiation; Prognosis
内乳淋巴结(internal mammary lymph node,IMLN)是仅次于腋窝淋巴结(axillary lymph node,ALN)的重要转移途径。内乳照射(internal mammary lymph node irradiation,IMNI)在MA.20、EORTC 22922/10925、French及DBCG-IMN等多项大型临床试验中被证实可以显著改善患者的生存情况[1-6]。目前临床实践和指南中IMNI的指征主要依据IMLN转移的高危因素,但是高风险并不代表IMLN转移,而低风险也不能排除IMLN转移,既往乳腺癌扩大根治术的资料显示,ALN阴性者中有9.2%存在IMLN转移,ALN 1~3枚阳性者有19.6%存在IMLN转移,ALN 4枚及以上阳性者中IMLN转移者占比为38.3%[7-8],因此以IMLN转移高危因素作为IMNI指征可能会导致治疗过度/不足。
腋窝前哨淋巴结活检(axillary sentinel lymph node biopsy,A-SLNB)已经被各大指南和专家共识所推荐,而内乳前哨淋巴结活检(internal mammary sentinel lymph node biopsy,IM-SLNB)由于内乳前哨淋巴结(internal mammary sentinel lymph node,IMSLN)显像率低导致其操作受限尚未能常规应用于临床实践中[9]。本中心前期研发的“新型核素示踪技术”可显著提高IMSLN的显像率(NCT01642511,15.5%~71.1%),并在CBCSG026试验(NCT03541278)中被验证具有良好的可重复性,为IM-SLNB的常规开展奠定了基础[10-11]。依据IMSLN的病理学诊断可以个体化地选择需行IMNI的患者,能够在改善生存的同时降低放疗的不良反应,优于单纯地选择高危患者行IMNI。
本研究目的是通过回顾性分析接受IM-SLNB的乳腺癌患者的随访数据,探索IM-SLNB对评估预后及指导个体化IMNI的优势。
1 资料和方法
1.1 研究对象
研究对象来源于3 项前瞻性临床试验[10,19- 21],“新型核素示踪技术”研发试验入组临床ALN阴性患者,CBCSG026试验入组ALN阴性和阳性患者,CBCSG027(NCT03024463)试验入组接受乳房切除术的ALN阳性患者(活检证明cN+或cN0伴腋窝SLN阳性)。本研究入组本中心2011年11月—2021年12月在3项前瞻性研究中成功行IM-SLNB的浸润性乳腺癌患者。入组患者的IMLN均通过影像学检查诊断为临床阴性;排除患有其他癌症或肿瘤类型为导管内癌的患者。免疫组织化学、荧光原位杂交等病理学检查结果均来源于本中心病理科。
1.2 局部区域处理方式
乳腺原发肿瘤手术为乳房切除术±重建和保乳手术。ALN的转移状况由A-SLNB和(或)腋窝淋巴结清扫(axillary lymph node disp,ALND)获取。放疗靶区包括胸壁/全乳+区域淋巴结(±IMNI),处方剂量为50 Gy/25次,对接受保乳手术者进行10 Gy/5次的瘤床加量;是否给予IMNI由放疗医师决定。
1.3 随访
随访采用门诊或电话的方式。随访时间从术后第1天计算,至2022年9月。研究期间观察到终点事件的数据记作完全数据,死于其他原因、失访或未达到研究终点记作删失数据,主要研究终点定为无病生存期(disease-free survival,DFS),即术后第1天至首次出现局部区域复发或远处转移的时间;次要终点定为总生存期(overall survival,OS)和放射性肺损伤(radiation-induced lung injury,RILI),其中OS指术后第1天至出现乳腺癌相关死亡的时间。RILI的诊断通过胸部电子计算机断层扫描获得,主要表现为局限在照射区域内的斑片影、通气支气管征、条索影、肺实变影或蜂窝样改变,在放疗完成后3个月内发生为急性事件,在放疗完成后3个月之后发生为延迟事件。
1.4 数据处理
统计入组患者的相关临床病理学资料。筛选影响DFS及OS的危险因素及独立危险因素;亚组分析IMSLN阴性组和IMSLN阳性组的DFS与OS,并分析不同的ALN/IMSLN转移状况患者的DFS与OS。对于接受区域淋巴结放疗的患者,分析IMNI实施的影响因素、IMSLN阴性和阳性亚组的IMNI实施率,并进一步分析IMNI对各临床病理学高危亚组的预后意义。
1.5 统计学处理
同时应用SPSS 27.0及GraphPad Prism 9.0进行统计分析。使用t检验分析连续变量间均值的差异,使用卡方检验或Fisher精确概率法分析分类变量间的差异。使用Kaplan-Meier方法估计DFS和OS,用log-rank检验进行比较。采用COX回归模型进行单因素和多因素分析,单因素分析中将P<0.05的变量纳入多因素分析。取α=0.05,P <0.05为差异有统计学意义。
2 结 果
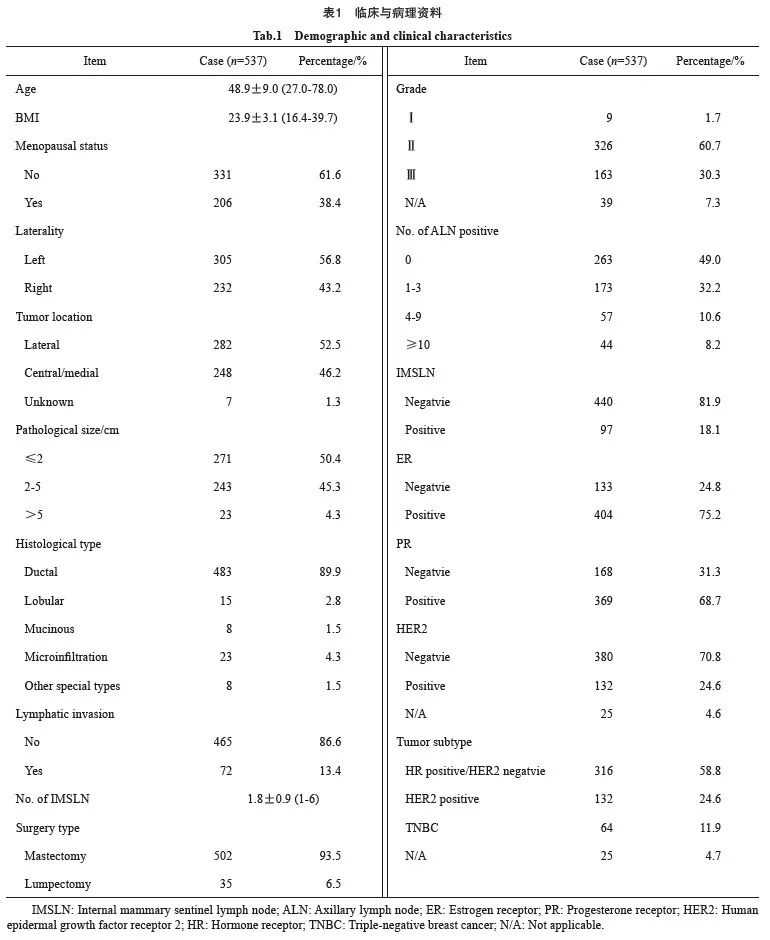
2.1 基本临床病理学资料
537例入组的患者IMSLN总体转移率为18.1%(97/537),其中ALN 0枚、1~3枚、4~9枚、10枚及以上阳性患者的IMSLN转移率分别为4.2%(11/263)、22.5%(39/173)、38.6%(22/57)和56.8%(25/44)(P<0.05)。92.6%(497/537)的患者接受了含紫杉烷类和(或)蒽环类药物方案的辅助化疗。45.3%(243/537)的患者接受了区域淋巴结放疗(表1)。
2.2 IMSLN转移对预后的影响
537例患者中位随访时间为60个月(7~131个月),失访率为4.7%(25/537),乳房/胸壁复发7例,区域淋巴结复发2例,远处转移32例,死亡17例。单因素Cox回归分析IM-SLNB后DFS与OS的危险因素,结果显示,IMSLN转移状况、ALN阳性数目、肿瘤大小和组织学分级与DFS相关(P均<0.05),对差异有统计学意义的因素进一步行多因素Cox回归分析显示,IMSLN转移状况、ALN阳性数目、肿瘤大小和组织学分级是DFS的独立危险因素。采用同样的方法分析OS的危险因素,结果显示,IMSLN转移状况、ALN阳性数目和肿瘤大小是影响OS的独立危险因素(P均<0.05,表2)。
分层分析IMSLN阴性组和IMSLN阳性组的DFS与OS,结果显示,与IMSLN阴性组相比,IMSLN阳性组5年DFS及OS显著降低(P均<0.000 1,图1A)。亚组分析ALN阳性/IMSLN阳性组、ALN阳性/IMSLN阴性组、ALN阴性/IMSLN阳性组与ALN阴性/IMSLN阴性组的DFS与OS,结果显示,ALN阳性/IMSLN阳性亚组5年DFS及OS显著低于ALN阳性/IMSLN阴性亚组(P均<0.05,图1B)。ALN阴性/IMSLN阳性亚组仅有11例患者,仅1例出现远处转移,未发生死亡;比较ALN阴性/IMSLN阳性亚组与ALN阳性/IMSLN阴性亚组的DFS及OS,两亚组之间差异无统计学意义(P均>0.05,图1C)。4个亚组总的生存曲线显示,ALN阴性/IMSLN阴性亚组的预后最好,ALN阴性/IMSLN阳性亚组与ALN阳性/IMSLN阴性亚组预后相似,ALN阳性/IMSLN阳性亚组的预后最差(P<0.000 1,图1D)。
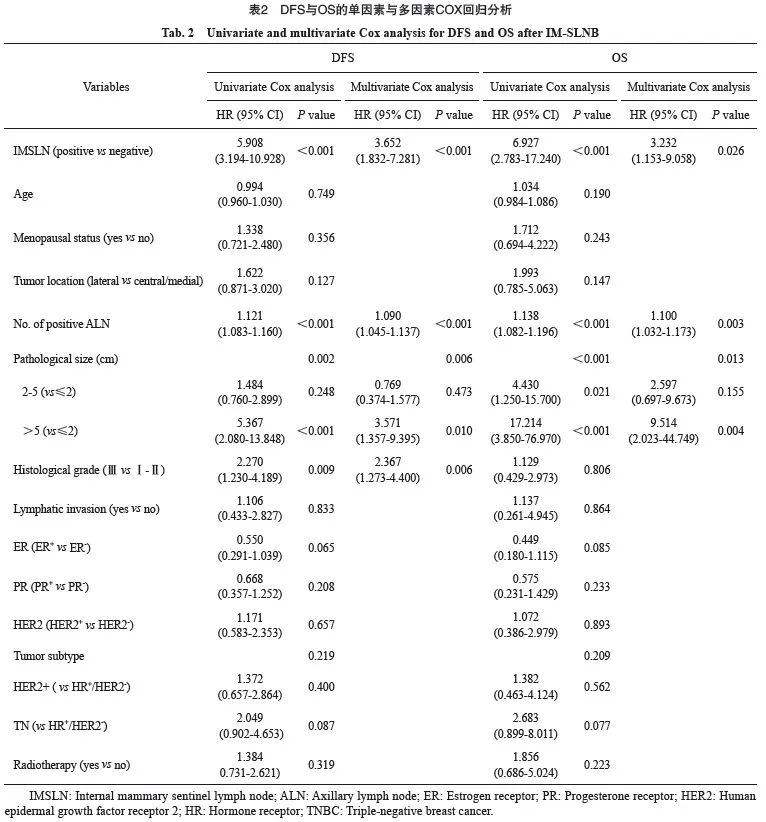
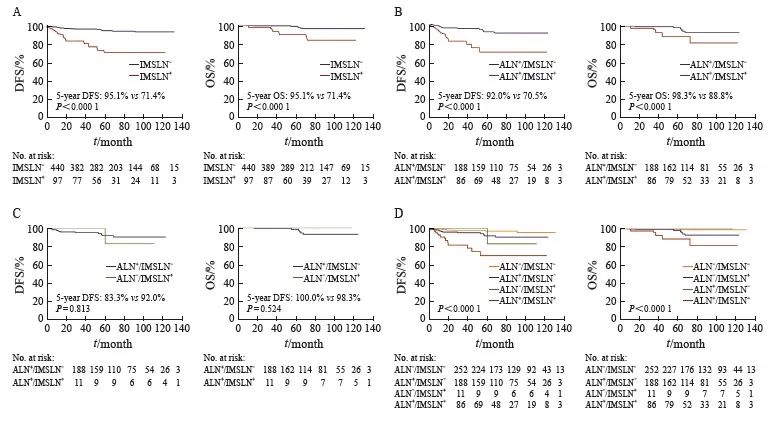
图1 不同ALN/IMSLN转移状况的预后比较
Fig. 1 Prognosis comparison of the different metastatic statuses of ALN/IMSLN
Kaplan-Meier curves showed DFS and OS in all patients. 5-year DFS and OS were described. HR data were also shown. A: Kaplan-Meier DFS and OS in all patients with negative internal mammary sentinel lymph node (IMSLN negative; blue) and positive internal mammary sentinel lymph node (IMSLN positive, red); B: Kaplan-Meier DFS and OS in patients with IMSLN negative (blue) and IMSLN positive (red) in patients with positive axillary lymph nodes (ALN positive) (ALN positive/IMSLN negative vs ALN positive/IMSLN positive). C: Kaplan-Meier DFS and OS in patients with ALN negative/IMSLN negative (orange) and ALN positive/IMSLN positive (green); D: The DFS and OS of the 4 subgroups were shown on this graph. -: Negative; + : Positive.
2.3 IM-SLNB对指导个体化IMNI的价值
537例患者中共有243例接受包含区域淋巴结的放疗,其中101例包含IMNI而142例未包含IMNI。中位随访时间49个月(9~123个月)。单因素分析显示,IMNI的实施与肿瘤患侧、大小及组织学分级无关,与IMSLN转移状况、肿瘤位置、ALN转移数目及脉管浸润状况显著相关(P均<0.05)。其中21.7%的IMSLN阴性患者与77.9%的IMSLN阳性患者接受了IMNI。
IMNI组与非IMNI组患者的DFS与OS差异均无统计学意义(P均>0.05,图2A),IMNI在不同N分期、T分期、临床病理学分期及肿瘤位置亚组中的获益差异均无统计学意义(P > 0.05,表3)。分层分析,IMNI对IMSLN阴性亚组5年DFS与OS无显著改善(P>0.05,图2B),但可显著改善IMSLN阳性亚组的5年DFS(P=0.040),尽管未转化为OS的获益(P=0.603,图2E)。在IMSLN阴性亚组中进一步分析ALN 1~3枚、4枚及以上阳性患者的DFS及OS,结果显示,IMNI对该两组患者均无显著的预后意义(P均>0.05,图2C~D)。总之, IMNI在各临床病理学高危亚组中均未呈现获益的显著性,只在IMSLN阳性患者中呈现出获益的显著性。
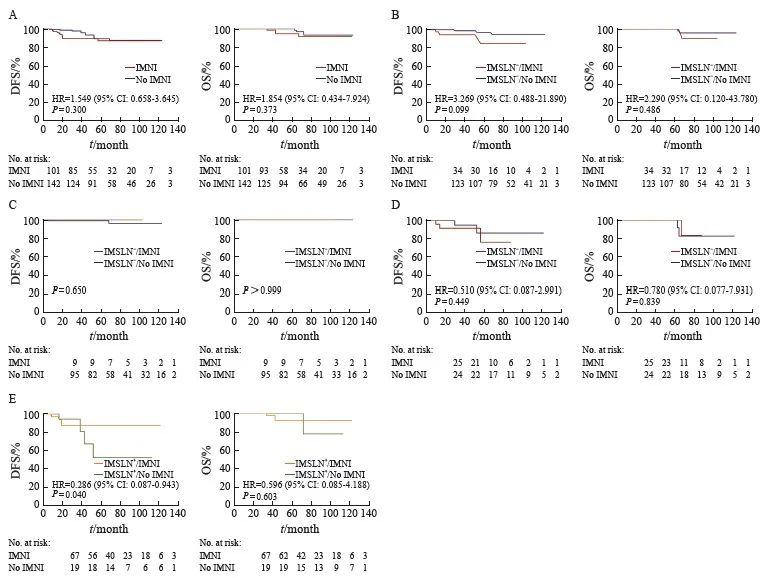
图2 IMNI对不同IMSLN转移状况亚组患者预后的影响
Fig. 2 Effects of IMNI on the prognosis of patients in different subgroups of IMSLN metastatic status
Kaplan-Meier curves showed DFS and OS in all patients who have received radiation therapy. 5-year DFS were described. HR data were also shown. A: Kaplan-Meier DFS and OS in all patients with IMNI (red) and without IMNI (no IMNI, blue). B: Kaplan-Meier DFS and OS in IMSLN negative patients with IMNI (red) and without IMNI (no IMNI, blue). C: Kaplan-Meier DFS and OS in patients with IMSLN negative and ALN 1-3 positive with IMNI (red) and without IMNI (no IMNI, blue). D: Kaplan-Meier DFS and OS in patients with IMSLN-and ALN≥4 positive with IMNI (red) and without IMNI (no IMNI, blue). E: Kaplan-Meier DFS and OS in all IMSLN positive patients with IMNI (orange) and without IMNI (no IMNI, green). -: Negative; + : Positive.

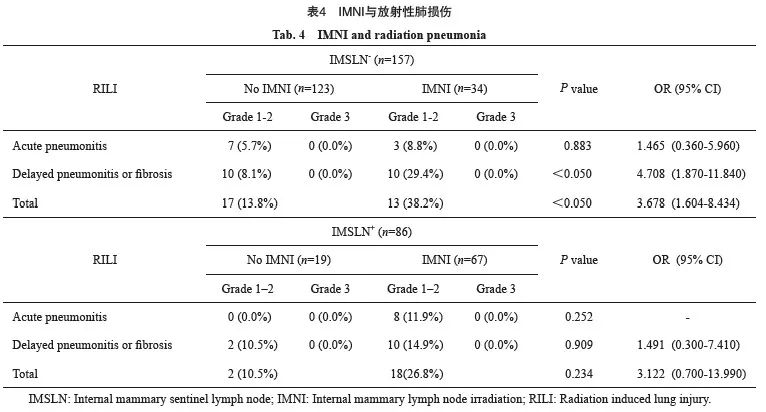
2.4 IMNI对放射性肺损伤的影响
本研究同时记录了RILI(包括急性放射性肺炎、迟发性放射性肺炎和放射性肺纤维化)的发生情况,所有患者均未观察到2级以上RILI,接受区域淋巴结放疗的243例患者1~2级RILI的发生率为20.6%(50/243),IMNI组1~2级RILI的风险显著高于非IMNI组(30.7% vs 13.4%,OR=2.867,95% CI:1.531~5.369,P<0.05)。亚组分析显示,IMSLN阴性亚组增加IMNI使1~2级RILI的风险显著增高(38.2% vs 13.8%,OR=3.678,95% CI:1.604~8.434,P<0.05,表4)。
3 讨 论
本中心开展的3项前瞻性临床试验结果促进了IM-SLNB的常规开展,通过对这些研究中成功行IM-SLNB的患者进行随访,发现IMSLN的转移状况作为影响乳腺癌患者预后的独立危险因素,依据其淋巴结转移状况进行个体化IMNI可显著改善患者预后,同时降低RILI的风险,这为明确IMNI的指征提供了更可靠的依据。
既往研究[12]表明,IMLN和ALN均转移者较单一转移者预后更差,仅IMLN或ALN转移者预后相似,IMLN和ALN均无转移时预后最好,我们的研究结果与这些结果基本吻合,IMLN转移具有独立的预后预测意义。因此,联合诊断ALN与IMLN的转移状况可更准确地评估乳腺癌预后及制订辅助全身/局部区域治疗方案。
本研究结果显示,总体人群中IMNI组与非IMNI组患者的DFS与OS差异均无统计学意义。韩国的KROG 08-06研究[13]结果也不支持IMNI的获益,这可能是因为IMLN实际转移率较低和优效的系统治疗,根据我们的研究数据和既往扩大根治术资料中的IMLN转移比例进行估算[7-8],其IMLN实际转移率仅为15%~25%,因此IMNI产生的生存获益会被总体意向人群稀释;同时在全身治疗有效的情况下增加局部区域控制,IMNI的获益也可能在一定程度上被稀释。从MA.20、EORTC22922/10925、French及DBCG-IMN等多项大型临床试验入组的患者可以看出,随着有效系统治疗的实施和IMLN转移风险的增高,患者更可能从IMNI中获益[9]。Budach等[6]基于IMLN转移风险的meta分析显示包含IMLN的区域放疗与DFS的改善显著相关(HR=0.85,P=0.002),本研究基于IMLN病理学状况发现IMNI对IMLN转移的患者DFS获益率更高(HR=0.286,P=0.040),尽管这是一种跨临床试验的对比,但在一定程度上提示我们有必要细化需要IMNI的人群,因为只有IMLN真正转移的患者才能从IMNI中获益。我们在IMLN阳性患者中发现IMNI具有显著生存获益,增加IMNI对IMLN阳性患者的局部复发和远处转移起到了良好的控制作用;而在IMLN阴性亚组中,无论ALN 1~3枚转移还是4枚及以上转移,豁免IMNI对DFS与OS均无显著影响。至于IMNI对IMLN阳性患者的OS无获益,我们认为有两个原因:首先,非IMNI的患者偏少,而IMNI的2例患者在发生远处转移之后失访,两组的死亡数据不平衡降低了组间OS改善的检测能力;其次,随访时间较短也可能使OS差异无统计学意义。但依据IMSLN的阳性诊断进行个体化IMNI的确可改善局部复发和远处转移,突破了单纯依据IMLN的转移风险来选择IMNI的局限性。
IMNI可显著增加RILI的风险,但我们发现IMSLN阴性组豁免IMNI可使RILI风险显著降低,同时并未对生存获益造成影响。MA.20试验中,包括IMNI在内的区域淋巴结放疗可以增加2级以上急性放射性肺炎(1.2% vs 0.2%,P=0.01)[1]。EORTC 22922/10925随访3年时放射性肺炎的发生率显著增加(4.3% vs 1.3%,P<0.000 1)[14];随访15年时肺纤维化的发生率显著增加(5.7% vs 2.9%,P<0.001),心脏疾病发生率显著增加(11.1% vs 9.4%,P=0.040)[15]。DBCG试验将右侧乳腺癌患者纳入IMNI组,结果表明,若不考虑高危器官照射剂量,IMNI可使心脏的平均照射剂量增加4.8 Gy(0.9~8.7 Gy,P<0.05)[16]。尽管随访时间较短以及样本量有限,本研究仍然得到了肺毒性的差异性结果。按照最新的指南,对于ALN阳性和高危ALN阴性者应将胸壁(全乳)、锁骨上下区和内乳区一起照射。然而,照射范围越广,不良反应的风险也越大。
本研究中,77.9%(67/86)的IMSLN阳性患者接受了IMNI,81.2%(147/181)的IMSLN阴性患者豁免了IMNI。IMLN阳性患者可以从IMNI中获益,IMLN阴性患者豁免IMNI可显著降低RILI的风险且未对预后造成影响,因此依据IMLN转移状况勾画照射靶区优于依据内乳转移高危因素。但是,如何精准评估IMLN转移状况并进行IMNI筛选还存在问题。尽管此前本中心研发了 “新型核素示踪技术”来进行IM-SLNB,并从解剖学角度验证了乳腺癌内乳淋巴引流模式[17-18],但我们并未全面地证实IMSLN反映IMLN总体转移状况的准确性。正在进行的CBCSG027试验[8](未公开数据)初步表明IM-SLNB可以准确地评估IMLN转移状况,并进行IMSLN转移的nomogram研究[受试者工作特征的曲线下面积(area under curve,AUC)值为0.860)]。本研究的创新之处在于其探索了IM-SLNB对评估预后及指导个体化IMNI生存获益的意义,未来我们会收集更大量的样本来验证,本研究可为后续开展前瞻性多中心研究提供思路。
但本研究也存在一些局限性。第一,非随机对照研究存在样本选择偏倚问题,因此本回顾性研究结果循证医学级别较低,结论未必可靠,尚需前瞻性随机对照研究证实。特别是IMSLN阳性者只有86例,样本选择偏倚的可能性大,且只有IMSLN转移的患者较少,导致统计学效能不足以在组间准确地判断差异在统计学上的显著性意义。第二,随访资料也缺乏关于晚期心脏、肌肉、骨骼等其他组织不良反应的全面数据,特别是对心脏毒性的评估需要更多的入组患者以及更长的随访时间。
IMSLN转移状况是影响DFS和OS的独立预后因素,IMSLN发生转移的患者DFS及OS均显著降低。IM-SLNB可指导个体化IMNI,IMSLN发生转移的患者接受IMNI可显著改善预后;IMSLN未发生转移的患者通过豁免IMNI可在不影响预后的情况下显著降低RILI的风险。
利益冲突声明:所有作者均声明不存在利益冲突。
[参考文献]
[1] WHELAN T J, OLIVOTTO I A, PARULEKAR W R, et al. Regional nodal irradiation in early-stage breast cancer[J]. N Engl J Med, 2015, 373(4): 307-316.
[2] POORTMANS P M, WELTENS C, FORTPIED C, et al. Internal mammary and medial supraclavicular lymph node chain irradiation in stage Ⅰ-Ⅲ breast cancer (EORTC 22922/10925): 15-year results of a randomised, phase 3 trial[J]. Lancet Oncol, 2020, 21(12): 1602-1610.
[3] POORTMANS P M, COLLETTE S, KIRKOVE C, et al. Internal mammary and medial supraclavicular irradiation in breast cancer[J]. N Engl J Med, 2015, 373(4): 317-327.
[4] THORSEN L B J, OVERGAARD J, MATTHIESSEN L W, et al. Internal mammary node irradiation in patients with nodepositive early breast cancer: fifteen-year results from the Danish breast cancer group internal mammary node study[J]. J Clin Oncol, 2022, 40(36): 4198-4206.
[5] HENNEQUIN C, BOSSARD N, SERVAGI-VERNAT S, et al. Ten-year survival results of a randomized trial of irradiation of internal mammary nodes after mastectomy[J]. Int J Radiat Oncol Biol Phys, 2013, 86(5): 860-866.
[6] BUDACH W, KAMMERS K, BOELKE E, et al. Adjuvant radiotherapy of regional lymph nodes in breast cancer - a metaanalysis of randomized trials[J]. Radiat Oncol, 2013, 8: 267.
[7] CONG B B, CAO X S, CAO L, et al. Internal mammary lymph nodes radiotherapy of breast cancer in the era of individualized medicine[J]. Oncotarget, 2017, 8(46): 81583-81590.
[8] QIU P F, WANG X E, WANG Y S. Indications for individual internal mammary node irradiation[J]. Lancet Oncol, 2021, 22(2): e40.
[9] 邱鹏飞, 王永胜. 前哨淋巴结时代乳腺癌的精准区域处理:演进与展望[J]. 中国癌症杂志, 2022, 32(8): 680-687.
QIU P F, WANG Y S. Precise regional management of breast cancer in the sentinel lymph node era: evolution and prospect[J]. China Oncol, 2022, 32(8): 680-687.
[10] QIU P F, LIU J J, LIU Y B, et al. A modified technology could significantly improve the visualization rate of the internal mammary sentinel lymph nodes in breast cancer patients[J]. Breast Cancer Res Treat, 2012, 136(1): 319-321.
[11] QIU P F, WANG Y S. ASO author reflections: internal mammary sentinel lymph node biopsy-time for the back of internal mammary staging? [J]. Ann Surg Oncol, 2020, 27(2): 384-385.
[12] VERONESI U, CASCINELLI N, BUFALINO R, et al. Risk of internal mammary lymph node metastases and its relevance on prognosis of breast cancer patients[J]. Ann Surg, 1983, 198(6): 681-684.
[13] KIM Y B, BYUN H K, KIM D Y, et al. Effect of elective internal mammary node irradiation on disease-free survival in women with node-positive breast cancer: a randomized phase 3 clinical trial[J]. JAMA Oncol, 2022, 8(1): 96-105.
[14] MATZINGER O, HEIMSOTH I, POORTMANS P, et al. Toxicity at three years with and without irradiation of the internal mammary and medial supraclavicular lymph node chain in stage Ⅰ to Ⅲ breast cancer (EORTC trial 22922/10925)[J]. Acta Oncol, 2010, 49(1): 24-34.
[15] POORTMANS P M, STRUIKMANS H, DE BROUWER P, et al. Side effects 15 years after lymph node irradiation in breast cancer: randomized EORTC trial 22922/10925[J]. J Natl Cancer Inst, 2021, 113(10): 1360-1368.
[16] THORSEN L B, THOMSEN M S, BERG M, et al. CT-planned internal mammary node radiotherapy in the DBCG-IMN study: benefit versus potentially harmful effects[J]. Acta Oncol, 2014, 53(8): 1027-1034.
[17] CAO X S, YANG G R, CONG B B, et al. The lymphatic drainage pattern of internal mammary sentinel lymph node identified by small particle radiotracer (99mTc-dextran 40) in breast[J]. Cancer Res Treat, 2019, 51(2): 483-492.
[18] CONG B B, QIU P F, LIU Y B, et al. Validation study for the hypothesis of internal mammary sentinel lymph node lymphatic drainage in breast cancer[J]. Oncotarget, 2016, 7(27): 41996-42006.
[19] 邱鹏飞. 新型示踪技术引导乳腺癌内乳前哨淋巴结活检术的显像率与适应证研究[D]. 济南: 山东大学, 2020.
[20] 孙 晓. 乳腺癌内乳区前哨淋巴结活检术的前瞻性临床验证研究[D]. 济南: 山东大学, 2020.
[21] WANG Y S, LV Q, ZHU S G, et al. Prospective, multicenter, clinical validation study of the repeatability and accuracy of internal mammary sentinel lymph node biopsy with modified injection technique (CBCSG026/CBCSG027)[C]. 2022 San Antonio Breast Cancer Symposium; San Antonio, TX, Dec 6-10, 2022 (abstr P2-14-06).


