中线弥漫性胶质瘤1例
时间:2022-12-15 11:59:49 热度:37.1℃ 作者:网络
前 言
H3K27M突变型弥漫性中线胶质瘤分类依据主要来源于组织形态学、分子生物学及肿瘤发生部位等特征,H3K27M突变型弥漫性中线胶质瘤好发于丘脑、脑干及脊髓等中线结构区域,较少见于第三脑室、下丘脑、松果体和小脑等区域。该肿瘤主要见于儿童及青少年,成人发病较少,且无性别差异。该肿瘤有较高的侵袭性且预后差。
华山医院脑脊液检验中心依托国家神经疾病医学中心,开展基于脑脊液的细胞学、生化学、免疫学、病原学、分子诊断学等多种特色检验项目,联合神经外科、神经内科、感染科、肿瘤科等多学科,汇集华山医院优势医疗资源,,一直以来脑脊液标本检测量体量大,各种检测需求强烈,检验科各项检测设备齐全,对脑脊液液体活检、脱落细胞学已经有多年研究,对脑病的早诊早治提供了极佳手段,对于提高神经系统疾病诊疗水平有重要意义。
案例经过
患者18岁,女,因“右下肢麻木乏力7月,左眼视物模糊伴眼痛2周余”入院。7月前,患者自觉剧烈运动后出现双下肢“发烫感”,偶伴右下肢麻木不适感,休息后可缓解。后逐渐出现右下肢麻木乏力,进行性加重,无二便障碍、束带感、进食饮水障碍等不适。
2周前,患者自觉左眼视物模糊,逐渐加重至仅指动感,伴眼球胀痛。追问病史,患者3月前曾有一过性眼球胀痛,但当时无明显视力下降。外院查胸椎MRI示髓内、椎管内多处异常强化(T7-12椎体水平脊髓及圆锥明显增粗)。眼科会诊示左眼光感,右眼视力0.4,双眼眼压正常,视盘水肿。
入院后完善相关检查:
影像学检查:
头颅CT:两侧额顶叶、侧脑室旁、小脑及脑干多发小低密度灶,结合MRI检查,随诊。
胸椎MRI:胸椎排列正常,胸4-5椎旁右侧缘见不规则混杂信号影,大小约3.6cm*3.3cm*1.8cm,增强后可见明显强化。胸7-12水平脊髓肿胀,信号不均,可见斑片状长T2长T1信号影,边界不清,增强后可见多发环形强化,邻近脊膜可见明显线样强化影。
(胸椎影像诊断)胸4-5椎旁右侧缘异常强化伴胸髓多发环形强化灶,考虑结核感染可能。

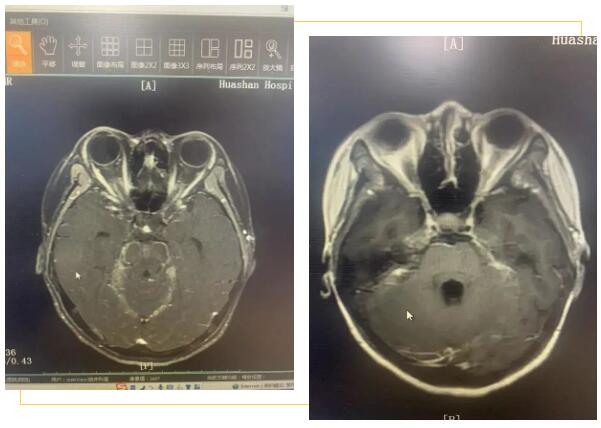
头颅MRI增强:两侧额顶叶、侧脑室旁、小脑及脑干可见多发长T1信号灶,flair呈高信号,增强后颅底脑池周围见明显强化。脑室系统尚可,脑沟裂无增宽,中线结构居中。
(头颅MRI影像诊断)两侧额顶叶、侧脑室旁、小脑及脑干多发异常信号,颅底异常强化,可符合感染表现。
PET/CT:脊髓及圆锥外形弥漫性肿胀、胸4-6锥体右侧软组织密度影、双侧前颅底脑膜、双侧颈部及左侧锁骨区淋巴结、胸骨局灶性低密度影、右侧臀部肌肉内病灶,伴FDG代谢增高,考虑炎性增殖性病变可能,建议结合临床鉴别不典型肿瘤性病变,余脑内FDG代谢欠均匀、未见局灶性FDG代谢异常增高灶。
实验室检查
C反应蛋白:37.18mg/L↑,白细胞计数:3.29x10^9/L↓,中性粒细胞绝对值:2.89x10^9/L,中性粒细胞%:87.9%↑,淋巴细胞%:7.9%↓,单核细胞%:4.1%,嗜酸性粒细胞%:0.0%↓,嗜碱性粒细胞%:0.1%,红细胞计数:4.35x10^12/L,血红蛋白:96g/L↓,红细胞压积:30.6%↓,平均红细胞体积:70.3fl↓,平均红细胞血红蛋白量:22.0pg↓,平均红细胞血红蛋白浓度:313g/L↓,血小板计数:96x10^9/L↓,血清淀粉样蛋白A:>200mg/L↑。
血清肿瘤标志物CA125:24.00 U/ml;CA199:0.69 U/ml;AFP:3.59 ng/mL;CEA:2.21 ng/mL;CA153:7.61 U/ml;CA724:<1.50 U/ml;CY211:1.97 ng/mL;NSE:11.50 ng/mL,SCC:0.6 ng/mL;CA50:0.5 U/ml;ProGRP:36.3 pg/mL;HE4:38.50 pmol/L ;S-100:0.328 ng/mL↑。
脑脊液常规:
颜色:淡黄色;透明度:微浑;潘氏试验:3+↑;红细胞:2000×10^6/L;白细胞44×10^6/L;多个核细胞:23/44;单个核细胞:21/44。
脑脊液生化:GLU 2.6 mmol/L ;CL 106 mmol/L↓;TP>15000mg/L↑;LAC 5.59mmol/L↑;LDH 322.00U/L。
脑脊液细胞学
2022年5月27日(脑脊液细胞学)外观:送检约3ml黄色浑浊液体;成熟红细胞:满视野;有核细胞计数44个/μL;
细胞形态描述:血性背景下,有核细胞明显增生,以单核组织巨噬细胞增生为主,寻找可见较多巢状分布的异型细胞,该类细胞胞体较大,类圆,胞浆量少或中等,部分分界不清,核类圆、不规则、刀切征样核、核染色质粗糙且分布不均,少数可见核仁及有丝分裂型,部分呈铺路石样排列或龟背样排列。
细胞免疫化学染色:S-100(+);Vim(-);CAM5.2(-);CD56(-);CKpan(-);GFAP(少数±);CD20(-);CD34(-);CK7(-);HMB45(-);CD3(-);Olig-2(-);PLAP(-);TTF-1(-);Syn(+);Nestin(+);H3K27M(+)。
细胞学诊断及意见:(脑脊液)血性背景下,单核组织巨噬细胞增生为主,寻找可见较多巢状分布的异型细胞,结合细胞形态及免疫化学染色符合神经上皮肿瘤来源,需结合临床综合判断。

400倍,Wright染色
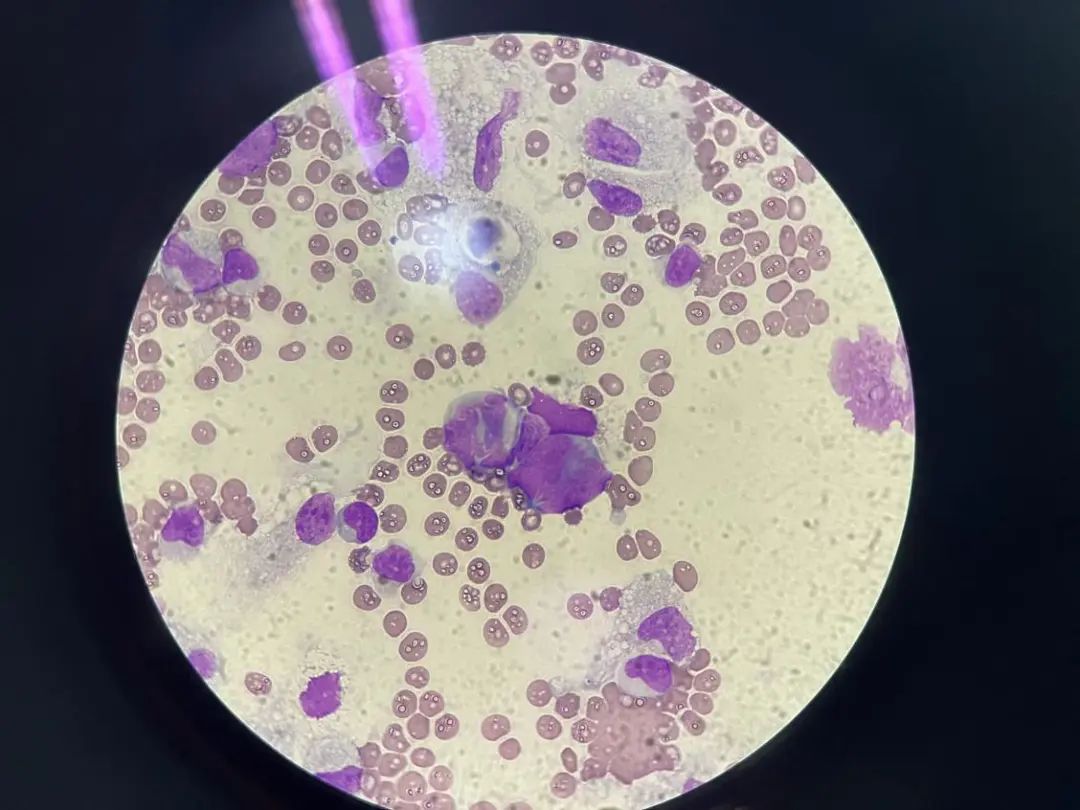
1000倍,Wright染色
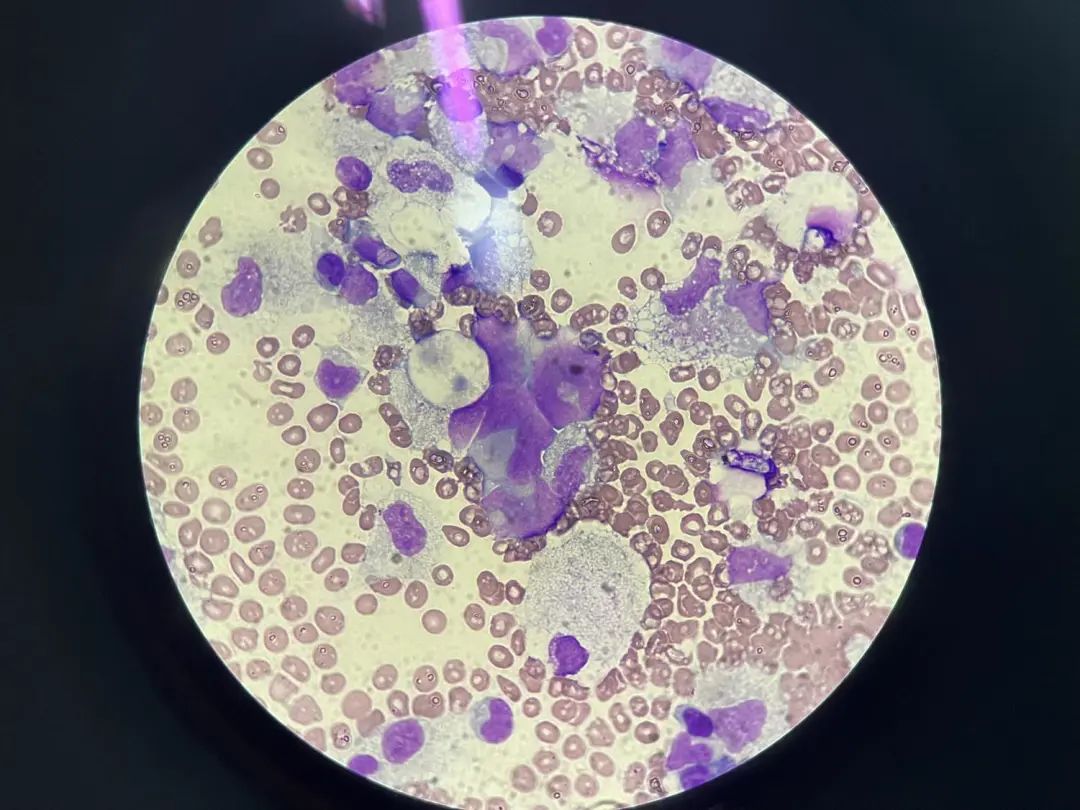
1000倍,Wright染色
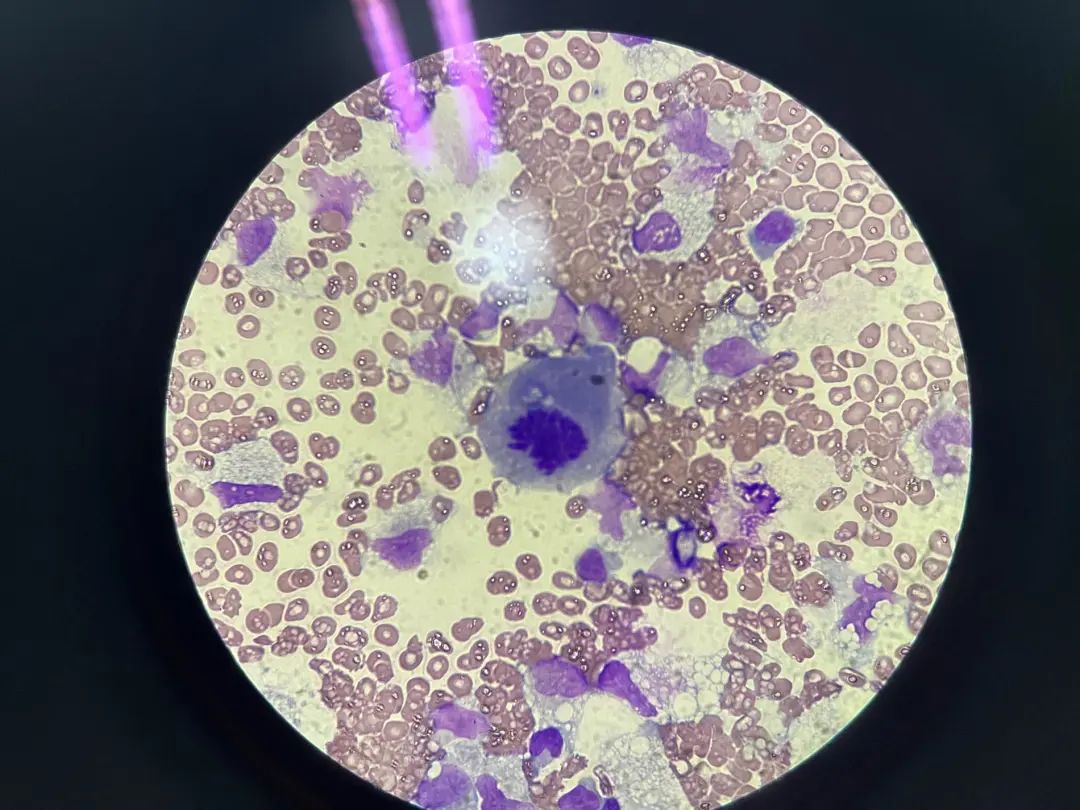
1000倍,Wright染色

400倍,Nestin(+)

400倍,Syn(+)
病理报告:
(右胸4-5椎旁肿块穿刺)弥漫性中线胶质瘤,H3K27M阳性(WHO 4级)。免疫组化结果:Syn(-),NeuN(-),NF(少弱+),CgA(-),Ki67(80%+),GFAP(+),Olig2(+),CK(-),INI-1(+),β-cantenin(浆+),Desmin(-),MyoD1(-),S100(+),VIM(+),CD99(部分+),LCA(-),CD34(血管+),SMA(血管+),P53(个别阳性),H3K27ME3(-),ATRX(+),H3K27M(+)。病理所见:灰白条索样组织2条长均1.2cm。
案例分析
01
临床案例分析
就诊诊断:视神经脊髓炎谱系疾病,右下肢肌力减退,反射减弱,双上肢正常,无明显感觉平面,可定位至胸段脊髓或周围神经;左眼视力下降,视野缺损伴眼球疼痛,可定位至左侧视神经。年轻女性,眼部症状为急性,免疫炎性首先考虑。综合考虑NMOSD,需除外肿瘤性病变多灶播散、感染性病变等。
02
检验案例分析
本病例中,患者“右下肢麻木乏力7月,左眼视物模糊伴眼痛2周余”表现为慢性病程,影像学首先考虑感染性病变,且该患者血常规中性粒细胞比例、CRP、SAA均明显升高,脑脊液常规中白细胞计数为44×10^6/L、多个核细胞比例升高,脑脊液生化总蛋白>15000mg/L,这些检验结果均指向了感染性病变导致的免疫炎性反应。但是,我们对于患者脑脊液细胞离心涂片后,发现患者脑脊液细胞学瑞氏染色后,细胞形态明显异常,且异常细胞呈巢状分布,该类细胞胞体较大类圆,部分分界不清,核类圆、不规则、刀切征样核、核染色质粗糙且分布不均,少数可见核仁及有丝分裂型,部分呈铺路石样排列或龟背样排列。
对于此类形态明显异常的细胞,我们对脑脊液细胞离心制片,进行脑脊液细胞免疫化学染色,其中S-100(+);GFAP(少数±);Syn(+);Nestin(+);H3K27M(+)。结合细胞形态及免疫化学染色符合神经上皮肿瘤来源,提示临床考虑该患者为神经肿瘤性病变。临床随后对患者右胸4-5椎旁肿块进行穿刺,病理报告表明:弥漫性中线胶质瘤,H3K27M阳性(WHO 4级)。
知识拓展
WHO中枢神经系统肿瘤分类2016年版首次提出了H3K27M突变型弥漫性中线胶质瘤这一新的胶质瘤类型,其分类依据主要来源于组织形态学、分子生物学及肿瘤发生部位等特征,H3K27M突变型弥漫性中线胶质瘤好发于丘脑、脑干及脊髓等中线结构区域,较少见于第三脑室、下丘脑、松果体和小脑等区域。该肿瘤主要见于儿童及青少年,成人发病较少,且无性别差异。
该肿瘤有较高的侵袭性且预后差。有研究显示该肿瘤患者的总生存期仅为9.3个月,年生存率低于10%。该类型胶质瘤的临床表现多没有特异性,可表现为颅内压增高、颅神经病变、长束征、共济失调、运动障碍、步态不稳等症状,但也可以无明显症状,此与肿瘤的生长部位有关。
组蛋白由于其自身亚基的不同故而存在多种不同的变体,其中包括H1、H2A、H2B、H3和H4。组蛋白可以通过多种方式起到参与基因表达的精细化调控作用,而且其不同变体的功能各不相同,调节方式亦多种多样;较为常见的方式是组蛋白的甲基化及乙酰化等翻译后修饰作用。
而其中H3这一变体又可主要分为H3.1、H3.2、H3.3、着丝粒蛋白-A(centromere protein A,CENP-A)及睾丸特异性组蛋白(H3t)这5种不同的变体,各变体的功能不尽相同。其中H3.3这一变体主要通过调节表观的方式进而作用于基因的表达,从而影响细胞的增殖、分化、减数分裂等;H3.3有H3F3A和H3F3B两个编码基因,H3K27M突变发生在H3F3A编码基因上,由H3F3A上第27位的赖氨酸(K27)被甲硫氨酸(methionine,M)所替换导致。
而H3K27M的突变使得该位点的氨基酸三甲基化(H3K27me3)含量显着降低,影响了基因的转录可靠性,导致或促进肿瘤的发生与进展。与此同时,甲基转移酶EZH2可与H3K27M相互影响起到降低多梳抑制复合物2(polycomb repressive complex 2,PRC2)活动的目的,从而引起H3K27me3含量的减少;有专家推测PRC2的表达异常是导致胶质瘤的一个重要因素。
故H3K27M的突变降低了甲基化的程度引起的强化基因激活效应,同时PRC2的功能受到抑制;这些效应重新激活了相关受抑制的靶基因,最后导致了肿瘤的发生与发展。相关研究表明H3K27M突变与中线结构胶质瘤的发生发展密切相关,并且此类胶质瘤呈弥漫性生长,恶性程度相对较高。
目前,胶质瘤的诊断主要依靠手术切除或者活检标本的病理学检查,观察病变组织的细胞形态学进行鉴别;部分病例的诊断基于既往经验。但H3K27M突变型弥漫性中线胶质瘤细胞形态上变化多样,从最多见的低级别星形细胞瘤到高级别胶质母细胞瘤的细胞形态均可出现,甚至是两种形态的过渡状态;还可呈现上皮样细胞、室管膜样、神经节细胞分化、原始神经外胚层肿瘤、横纹肌细胞、毛细胞黏液样、神经毡岛样、肉瘤样以及多形性黄色星形细胞瘤样等;也可以在同一肿瘤内的不同区域表现为不同的形态。
但该类型胶质瘤的组织形态学分类对于判断患者预后方面的意义有限。随着目前分子病理诊断的不断应用,有研究发现IDH1、1p19q共缺失、ATRX、TERT启动子及端粒酶启动子等相关分子在胶质瘤的发生发展中起着重要作用,而H3K27M突变型弥漫性中线胶质瘤有H3K27M基因的突变,其特征性的表达H3K27M阳性。但是在一些生长于非中线部位的胶质瘤中亦可表达H3K27M阳性。
因此,诊断需要结合肿瘤生长部位、免疫组化等结果综合考虑。H3K27me3含量的减少是H3K27M突变的主要驱动因素,因H3K27me3本身没有特异性,无法单独应用于这类肿瘤的诊断,但可以将其作为H3K27M之外的辅助诊断手段。采用病理组织免疫组化可直接检测H3K27M表达;同时随着基因技术的发展,对活体组织标本进行基因的提取和扩增后进行实时PCR也是一种检测方法。
但有研究发现,H3K27M突变也可发生于室管膜瘤、毛细胞型星形细胞瘤、儿童弥漫性胶质瘤、节细胞胶质瘤等低级别胶质瘤及非中线部位的高级别胶质瘤。因此,H3K27M突变型弥漫性中线胶质瘤的诊断需结合肿瘤生长部位与组织形态学、分子病理学诊断等结果进行综合判断。
案例总结
脑脊液细胞学是诊断中枢神经系统肿瘤的重要窗口,中枢神经系统肿瘤在脑脊液中通常细胞形态有明显异质性,没有特异的形态学特征,往往是簇状或巢状的异型细胞,可以表现为菊花团样、龟背样、铺路石样,细胞间分界不清,胞浆融合,胞浆量少或中等,胞核大类圆或不规则、核形变异明显,核染色质较疏松,少数可见核仁,核分裂型和有丝分裂型较易见。
有条件时可通过增加免疫标记如Syn、GFAP、Olig-2、CD34、CKpan、CD56、Vim等进行鉴别诊断。本病例中影像学首先考虑感染性疾病,但在临床治疗随访过程中效果不佳,结合临床病史重新读片考虑肿瘤可能,送至我科脑脊液检验中心的脑脊液脱落细胞学发现了较大巢状分布的异型细胞,部分具有菊花团样结构,一些散在或小簇状的异型细胞具有龟背样结构,细胞形态学倾向神经系统肿瘤来源,但需要与神经内分泌肿瘤、淋巴造血系统肿瘤相鉴别。因此选择免疫标记时应该考虑覆盖到需要鉴别诊断的肿瘤。该类肿瘤最终的诊断仍是需要组织病理学和分子遗传学来明确。
专家点评
弥漫中线胶质瘤H3K27M阳性(组化)脑外播散治疗意见:1告知家属预后极差;2建议脑室分流,减少脑疝风险,延长生命;3目前没有公认的有效治疗方案;弥漫中线胶质瘤穿刺术后2周,脑脊液播散、颅外转移预后极差,目前进行多部位放射性治疗。检验科在日常工作中能凭借专业的形态识别技能、认真严谨的工作态度,主动给临床医生提出进一步检查的建议,为临床进一步明确诊断提供帮助,彰显出扎实的理论基础和丰富的临床工作经验。检验人员在工作中应主动学习临床医学和检验医学的专业知识,不断提升自己的知识储备和工作能力,积极与临床沟通交流,协助临床做出正确、全面的诊断。
点评专家:
黄若凡 | 复旦大学附属华山医院神经肿瘤科副主任医师
盛晓芳 | 复旦大学附属华山医院放疗科主任医师
参考文献
[1]汪洋.2021年世界卫生组织中枢神经系统肿瘤分类(第五版)胚胎性肿瘤分类解读[J].中国现代神经疾病杂志,2021,21(09):817-822.
[2] Ostrom QT,Patil N,Cioffi G,Waite K,Kruchko C,Barnholtz-Sloan JS.CBTRUS Statistical Report:primary brain and other central nervous system tumors diagnosed in the United States in2013-2017[J].Neuro Oncol,2020,22(12 Suppl 2):iv1-96.
[3] National Health Commission of the People's Republic of China.Guidelines for the diagnosis and treatment of medulloblastoma in children (2021 edition[)J].Quan Ke Yi Xue Lin Chuang Yu Jiao Yu,2021,19:581-584[.中华人民共和国国家卫生健康委员会.儿童髓母细胞瘤诊疗规范(2021年版)[J].全科医学临床与教育,2021,19:581-584.]
[4] Northcott PA,Robinson GW,Kratz CP,Mabbott DJ,Pomeroy SL,Clifford SC,Rutkowski S,Ellison DW,Malkin D,Taylor MD,Gajjar A,Pfister SM.Medulloblastoma[J].Nat Rev Dis Primers,2019,5:11.
[5] Taylor MD,Northcott PA,Korshunov A,Remke M,Cho YJ,Clifford SC,Eberhart CG,Parsons DW,Rutkowski S,Gajjar A,Ellison DW,Lichter P,Gilbertson RJ,Pomeroy SL,Kool M,Pfister SM.Molecular subgroups of medulloblastoma:the current consensus[J].Acta Neuropathol,2012,123:465-472.
[6] Louis DN,Perry A,Reifenberger G,von Deimling A,FigarellaBranger D,Cavenee WK,Ohgaki H,Wiestler OD,Kleihues P,Ellison DW.The 2016 World Health Organization Classification of Tumors of the Central Nervous System:a summary[J].Acta Neuropathol,2016,131:803-820.
[7] Massimino M,Antonelli M,Gandola L,Miceli R,Pollo B,Biassoni V,Schiavello E,Buttarelli FR,Spreafico F,Collini P,Giangaspero F.Histological variants of medulloblastoma are the most powerful clinical prognostic indicators[J].Pediatr Blood Cancer,2013,60:210-216.
[8] McManamy CS,Pears J,Weston CL,Hanzely Z,Ironside JW,Taylor RE,Grundy RG,Clifford SC,Ellison DW;Clinical Brain Tumour Group.Nodule formation and desmoplasia in medulloblastomas-defining the nodular/desmoplastic variant and its biological behavior[J].Brain Pathol,2007,17:151-164.
[9] Tulla M,Berthold F,Graf N,Rutkowski S,von Schweinitz D,Spix C,Kaatsch P.Incidence,trends,and survival of children with embryonal tumors[J].Pediatrics,2015,136:e623-632.
[10] Ho B,Johann PD,Grabovska Y,De Dieu Andrianteranagna MJ,Yao F,Frühwald M,Hasselblatt M,Bourdeaut F,Williamson D,Huang A,Kool M.Molecular subgrouping of atypical teratoid/rhabdoid tumors:a reinvestigation and current consensus[J].Neuro Oncol,2020,22:613-624.
[11] Holdhof D,Johann PD,Spohn M,Bockmayr M,Safaei S,Joshi P,Masliah-Planchon J,Ho B,Andrianteranagna M,Bourdeaut F,Huang A,Kool M,Upadhyaya SA,Bendel AE,Indenbirken D,Foulkes WD,Bush JW,Creytens D,Kordes U,Frühwald MC,Hasselblatt M,Schüller U.Atypical teratoid/rhabdoid tumors(ATRTs) with SMARCA4 mutation are molecularly distinct from SMARCB1-deficient cases[J].Acta Neuropathol,2021,141:291-301.
[12] Hasselblatt M,Oyen F,Gesk S,Kordes U,Wrede B,Bergmann M,Schmid H,Frühwald MC,Schneppenheim R,Siebert R,Paulus W.Cribriform neuroepithelial tumor(CRINET):a nonrhabdoid ventricular tumor with INI1 loss and relatively favorable prognosis[J].J Neuropathol Exp Neurol,2009,68:1249-1255.
[13] Ibrahim GM,Huang A,Halliday W,Dirks PB,Malkin D,Baskin B,Shago M,Hawkins C.Cribriform neuroepithelial tumour:novel clinicopathological,ultrastructural and cytogenetic findings[J].Acta Neuropathol,2011,122:511-514.
[14]吴小延,黄永诗,苏丹婷,罗威,古家美,王芳,汤涛.H3K27M突变型弥漫性中线胶质瘤39例临床病理特征及预后分析[J].中国医刊,2022,57(04):409-415.
[15]李志敏,靳松.H3K27M突变型弥漫性中线胶质瘤1例并文献复习[J].中国临床医学影像杂志,2022,33(01):61-63.
[16]杜军,黄亮亮,张安莉,谢晶,李恒,吴海波.H3 K27M突变型弥漫性中线胶质瘤11例临床病理分析[J].诊断病理学杂志,2019,26(03):137-141.


