Front.aging-neurosci-α硫辛酸对小胶质细胞中寡聚β-淀粉样蛋白吞噬作用的影响
时间:2022-12-16 21:01:07 热度:37.1℃ 作者:网络
 阿尔茨海默病 (AD) 是一种具有认知障碍的不可逆神经退行性疾病,AD患者的大脑中,突触丧失可先于神经退行性变,脑组织逐渐萎缩,进而导致患者的记忆和学习能力下降,最终导致痴呆。突触改变实际上是神经退行性变的关键部分,它与AD的形态学病变、tau 和 Aβ 的神经毒性以及认知障碍密切相关,从而引起各种神经毒性作用,如炎症增加、氧化压增加,并随后损害大脑神经结构。
阿尔茨海默病 (AD) 是一种具有认知障碍的不可逆神经退行性疾病,AD患者的大脑中,突触丧失可先于神经退行性变,脑组织逐渐萎缩,进而导致患者的记忆和学习能力下降,最终导致痴呆。突触改变实际上是神经退行性变的关键部分,它与AD的形态学病变、tau 和 Aβ 的神经毒性以及认知障碍密切相关,从而引起各种神经毒性作用,如炎症增加、氧化压增加,并随后损害大脑神经结构。
有证据表明自噬和抗氧化剂在AD中发挥核心作用,根据氧化应激理论,许多抗氧化剂与预防AD进展有关。类维生素化合物 α-硫辛酸 (ALA) 是一种含硫辛酸和硫的有机化合物,是一种天然生物抗氧化剂,被证明通过血脑屏障影响中枢神经系统,已用于研究多种神经退行性疾病。因此,来自国立台湾师范大学的研究团队研究旨在研究ALA是否可以增强BV-2小鼠小胶质细胞中寡聚 β-淀粉样蛋白 (oAβ) 1-42吞噬作用,以研究AD中自噬发挥的作用。
 研究结果
研究结果
1、ALA对BV-2细胞中FAM-oAβ 1-42摄取的影响
与 ALA未处理组相比,100μM ALA 处理的BV-2细胞的荧光增加了 73.44 ± 8.99%,400 μM ALA 处理下荧光强度增加了 108.83 ± 51.07%,表现出剂量依赖性效应。未经处理的 FAM-oAβ 1-42与空白组的荧光没有显着差异。因此,作者证实ALA 对 BV-2 细胞荧光的增加并不是由 ALA 本身引起的,而是由 FAM-oAβ1-42 的摄取增加引起的。
 图1 ALA对BV-2 小鼠小胶质细胞中FAM-oAβ 1-42摄取的影响
图1 ALA对BV-2 小鼠小胶质细胞中FAM-oAβ 1-42摄取的影响
2、BV-2细胞中的信使RNA和oAβ1-42 吞噬作用相关受体表达
与未处理的 ALA 和 oAβ 组(对照组)相比,用 50、100、200 和 400 μM ALA 处理细胞;对于各个 ALA 治疗组(50、100、200 和 400 μM),CD36 的 mRNA 表达水平为对照组的1.81 ± 0.06、2.36 ± 0.33、3.63 ± 1.00 和7.29 ± 0.39 倍。此外,ALA 增加了未经 oAβ 1-42处理的 BV-2细胞中 CD36 mRNA 的表达;该结果与用1 μM oAβ 1-42处理的组相似。
ICC测量的CD36蛋白的表达如图2A所示,用 ALA 处理的细胞提高了CD36蛋白表达量。无论是否刺激oAβ 1-42,BV-2 细胞中的 CD36 蛋白表达随着 ALA 处理而增加。400 μM ALA 处理组的荧光强度约为未处理组的 1.3 倍(图 2B)。
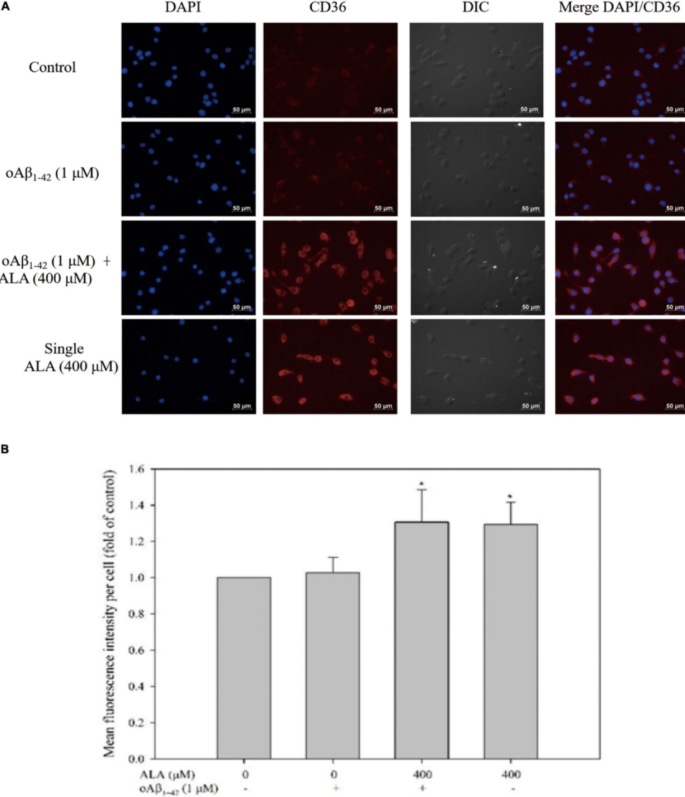 图2 ALA提高了 BV-2 小鼠小胶质细胞中 CD36 蛋白的表达
图2 ALA提高了 BV-2 小鼠小胶质细胞中 CD36 蛋白的表达
3、ALA通过BV-2细胞中COX-2/15-Deoxy- Δ12,14 -PGJ2导致PPAR-γ易位
对于各个 ALA 处理组(50、100、200 和 400 μM),ALA促进 BV-2 细胞并增加环氧合酶2(COX-2)/15-Deoxy- Δ12,14 -PGJ2的产生。ALA 组与 oAβ 1-42 共培养,在400 μM ALA 处理24 h的 BV-2 细胞中,产生的 15-脱氧-Δ12,14 -PGJ2 的量是未处理组的 6.92 ± 2.06 倍,与未处理组没有显着差异。在 BV-2 细胞中与 oAβ 1-42 共培养24 小时后,COX-2 蛋白的表达与未处理的 oAβ1-42组没有显着差异。然而,COX-2蛋白在BV-2 细胞中的表达随着 ALA 处理浓度的增加而增加(图 3A)。此外,COX-2 mRNA在BV-2细胞中的表达与蛋白质的表达相似。
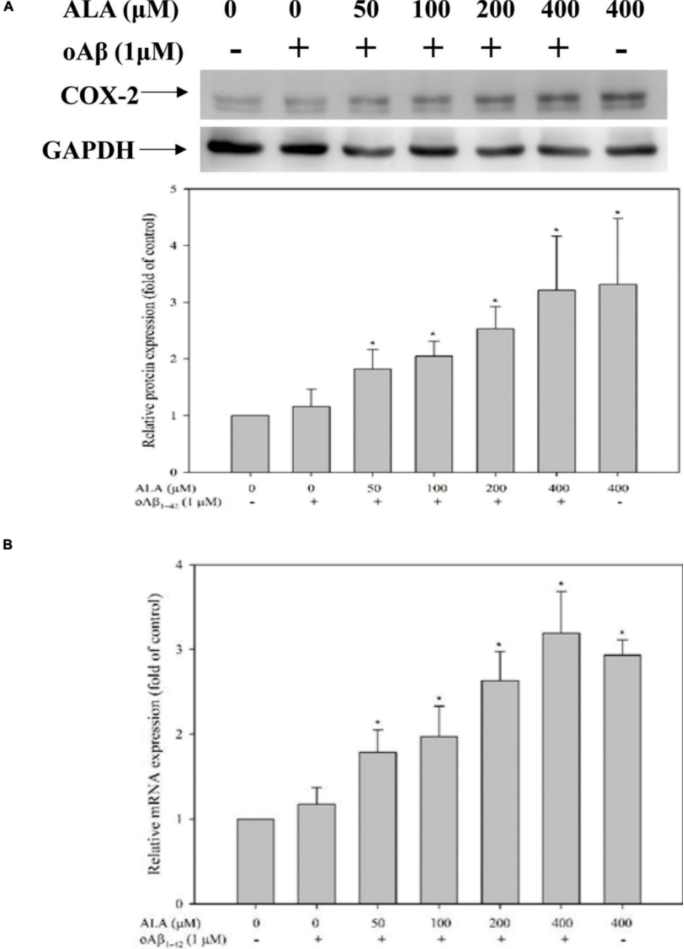 图3 BV-2 小鼠小胶质细胞中的ALA提高了环氧合酶 2 (COX-2) 的表达
图3 BV-2 小鼠小胶质细胞中的ALA提高了环氧合酶 2 (COX-2) 的表达
综上,这项研究证明了 ALA 促进小鼠小胶质细胞 BV-2 细胞摄取oAβ1-42的可能机制。ALA 处理增加了 BV-2 细胞中 COX-2 mRNA 和 COX-2 蛋白的表达。COX-2蛋白表达的增加间接加速了COX-2/15-Deoxy- Δ12,14 -PGJ2的产生,并作为PPAR-γ转录因子配体,导致PPAR-γ与过氧化物酶体增殖反应元件的易位和结合。 此外,ALA增加了 CD36 mRNA 的转录并增加了 CD36 mRNA的翻译,翻译出的CD36受体识别 oAβ1-42并触发oAβ1-42在 BV-2细胞中的吞噬作用。
先前的一项研究表明,每天补充 600 毫克ALA可以改善AD的病程。但是,该机制尚不清楚,许多关于 ALA 对AD的缓解作用的研究都集中在其抗氧化和抗炎特性上。作者发现,除了抗氧化和抗炎特性外,ALA 还可以增强小胶质细胞消除 oAβ1-42的能力,从而降低 oAβ1-42诱导的神经毒性作用,这可能为预防痴呆提供了新的干预手段。该研究揭示了吞噬作用的主要机制,为抗氧化剂、吞噬剂对AD的治疗作用提供了机制基础,但是该研究不足之处在于缺乏体内实验验证,所以未来的研究需要通过体内验证该实验结果。


