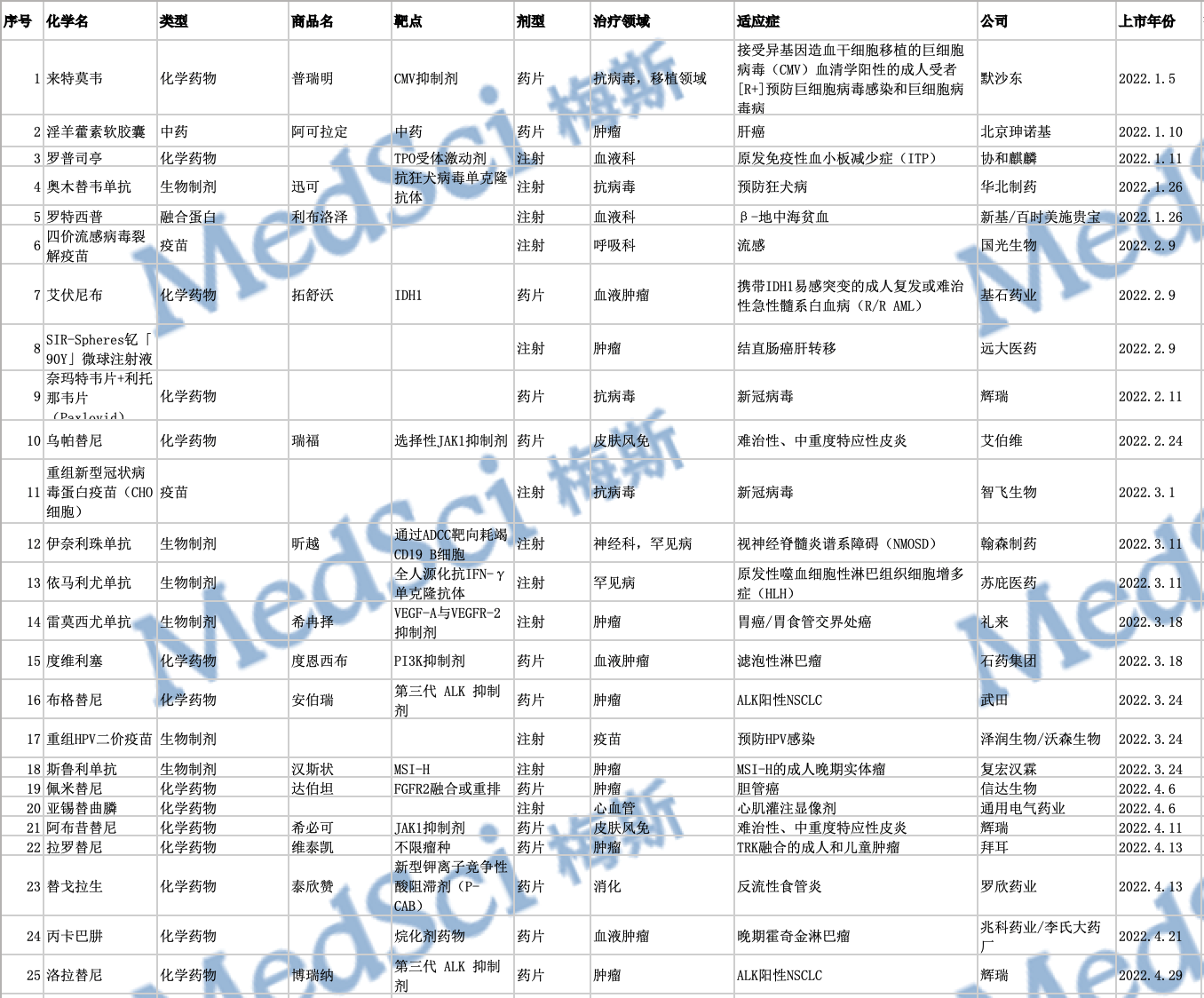
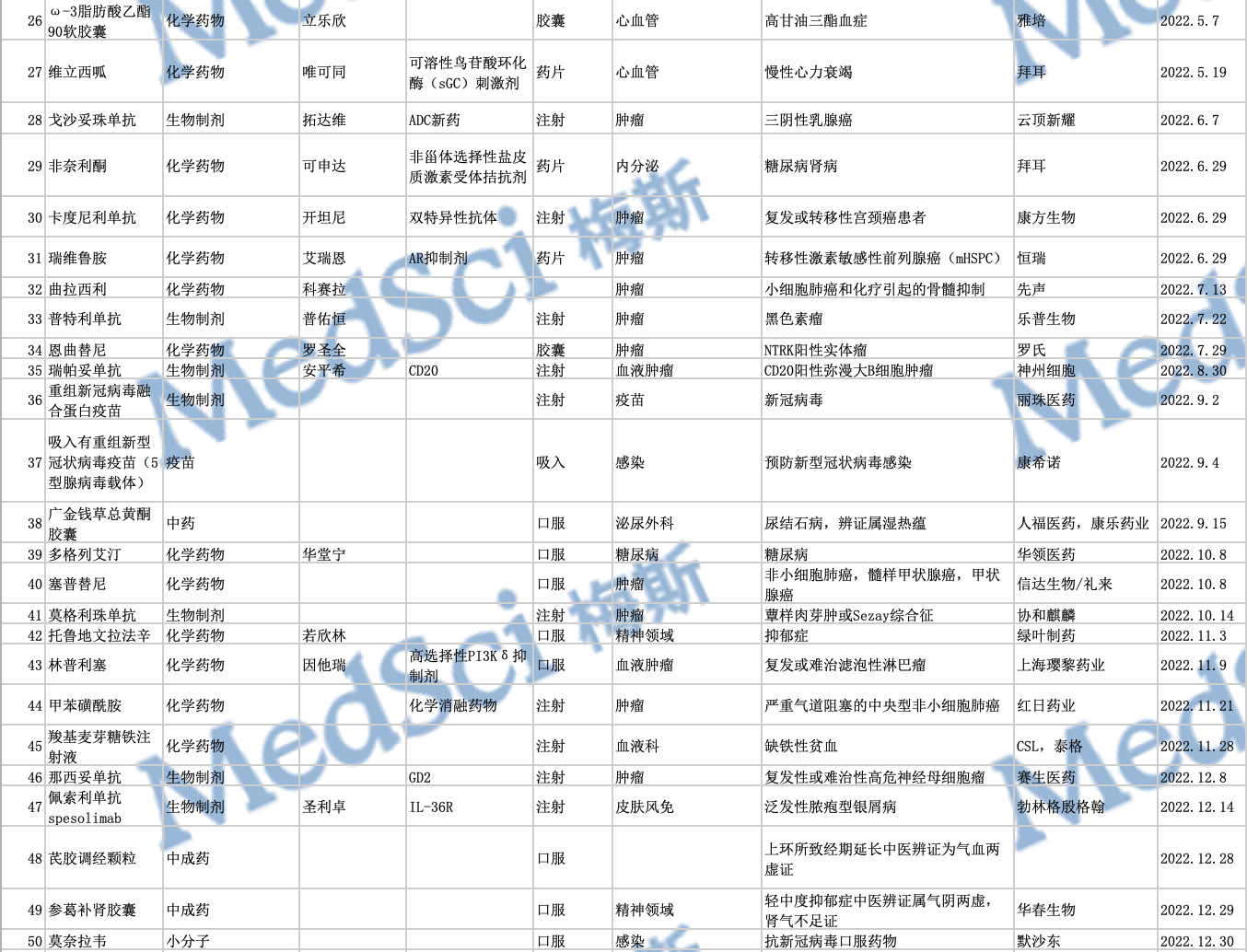
2022年中国NMPA批准上市的50款创新药物
时间:2023-01-13 06:01:53 热度:37.1℃ 作者:网络
2022年,中国药监局(NMPA)共批准了50款新药,其中进口新药有30款,国产新药有20款。从药物类型上看,包括28款化学药、13款生物药、5款疫苗以及4款中药。数量与2019年批准了51款新药,2020年批准了48款新药相仿,少于2021年创纪录地批准了83款新药。
从疾病领域看,2022年NMPA批准的新药中,抗肿瘤(实体瘤+血液瘤)药物独占鳌头,占比44%(22/50);治疗新冠药物(口服药+疫苗)位居第二,占比10%(5/50);其次是血液疾病新药(4,8%)、非新冠类病毒感染新药(3,6%)、免疫系统疾病新药(3,6%)等。
总体而言,2022年NMPA批准的新药中有不少亮点,在具体产品类别上也带来多款“首个”。这些新药的上市,为多种疾病提供了全新的疗法和更多的治疗选择。
国产创新药表现亮眼
我国创新药在2022年迎来了新的突破,多款全新机制新药(FIC)获批上市。
3月24日,NMPA批准斯鲁利单抗上市,它是一种抗肿瘤创新药,是复宏汉霖自主研发的PD-1(程序性死亡受体1)单抗。首个适应症为治疗微卫星高度不稳定(MSI-H)实体瘤。2022年11月1日,复宏汉霖宣布,斯鲁利单抗第二个适应症获批,为联合卡铂和白蛋白紫杉醇用于一线治疗不可手术切除的局部晚期或转移性鳞状非小细胞肺癌。同一年两个适应症获批。
6月29日,药监局附条件批准康方生物的PD-1/CTLA-4双抗卡度尼利单抗注射液(商品名:开坦尼)上市,用于治疗复发或转移性宫颈癌(R/M CC)。它是国内首款上市的双抗药物,也是首款获批用于晚期宫颈癌的免疫治疗药物,还是全球首款获批的PD-1/CTLA-4双抗。
10月2日,华领医药first in class降糖药多格列艾汀(dorzagliatin,商品名:华堂宁)获批上市,用于改善成人2型糖尿病患者的血糖控制。这是全球范围内首个获批上市的葡萄糖激酶启动剂(GKA)药物,是过去近十年来糖尿病领域首个全新机制的原创新药,也是首次在中国推出2型糖尿病全球首创新药。
新冠口服药应急批准上市
2022年2月11日,药监局按照药品特别审批程序,进行应急审评审批,附条件批准辉瑞Paxlovid(奈玛特韦片/利托那韦片组合包装)进口注册,用于治疗成人伴有进展为重症高风险因素的轻至中度新型冠状病毒肺炎(COVID-19)患者,例如伴有高龄、慢性肾脏疾病、糖尿病、心血管疾病、慢性肺病等重症高风险因素的患者。Paxlovid于2021年12月22日获FDA紧急使用授权。不到2个月,该药就进入了中国市场,以应对突发疫情。
12月29日,药监局按照药品特别审批程序进行应急审评审批,附条件批准默沙东公司新冠病毒治疗药物莫诺拉韦胶囊(商品名称:利卓瑞/Lagevrio)进口注册,用于治疗成人伴有进展为重症高风险因素的轻至中度COVID-19患者,例如伴有高龄、肥胖或超重、慢性肾脏疾病、糖尿病、严重心血管疾病、慢性阻塞性肺疾病、活动性癌症等重症高风险因素的患者。
肿瘤类药物,接近半壁江山
2022年度,有22款肿瘤类药物上市,其中实体瘤为18款,血液肿瘤为4款。占住近半壁江山。广谱抗癌药的出现,为这部分癌症患者带来了生存下去的希望!今年多款不限瘤肿有多款药物上市。
斯鲁利单抗是一种抗肿瘤创新药,是复宏汉霖自主研发的PD-1(程序性死亡受体1)单抗。2022年3月,该药首次获批国内上市,首个适应症为治疗微卫星高度不稳定(MSI-H)实体瘤。2022年11月1日,复宏汉霖宣布,斯鲁利单抗第二个适应症获批,为联合卡铂和白蛋白紫杉醇用于一线治疗不可手术切除的局部晚期或转移性鳞状非小细胞肺癌。
拉罗替尼是一个富有传奇色彩的抗癌药,已被美国FDA批准用于治疗NTRK基因融合的成人和儿童局部晚期或转移性实体瘤患者。作为全球首个不分肿瘤来源用于初始治疗的靶向药,拉罗替尼于2018年11月26日被FDA批准上市,用于成人和小儿具有神经营养受体酪氨酸激酶(NTRK)基因融合的实体瘤治疗。开启了泛癌种治疗的新纪元,这也让“一把钥匙开几把锁甚至多把锁”得以实现。2022年4月13日,“传奇”抗癌药 拉罗替尼(larotrectinib,硫酸拉罗替尼,商品名:Vitrakvi)终于获得中国国家药监局(NMPA)的批准上市 ,用于治疗 携带NTRK融合基因的实体瘤成人和儿童患者。 这表明,中国癌友们迎来了 全球首款专为NTRK基因融合癌症患者设计的口服TRK抑制剂。
恩曲替尼于2019年6月19日在日本批准上市,于2019年8月15日获FDA批准上市,用于治疗神经营养酪氨酸受体激酶(NTRK)融合阳性的晚期复发性实体肿瘤成人和儿童患者;以及用于治疗携带ROS1基因突变的转移性非小细胞肺癌。2021年10月28日,根据国家药品监督管理局药品审评中心(CDE)最新公示,Entrectinib胶囊上市申请被拟纳入优先审评审批。罗氏Entrectinib胶囊(恩曲替尼)以“符合附条件批准的药品”拟纳入优先审评,拟定适应症:NTRK融合阳性局部晚期或转移性实体瘤。2022年7月29日被批准上市。
罕见病疗法,批准速度加快
2022年1月,国家药监局药审中心发布了《罕见疾病药物临床研发技术指导原则》,这也是国家层面为推动更多药物研发、生产机构关注罕见病群体的需求,研发罕见病治疗药物做出的贡献。2022年药监局批准的新药中,罕见病也是获批新药较多的治疗领域。
1月11日,安进/日本协和麒麟(Kyowa Kirin)研发的第二代TPO受体激动剂注射用罗普司亭获得NMPA批准上市,用于治疗原发慢性免疫性血小板减少症(ITP)。
1月26日,新基(BMS)研发的红细胞成熟剂注射用罗特西普获得NMPA批准上市,用于治疗β地中海贫血患者。罗特西普是中国首个且唯一获批的红细胞成熟剂,也是十余年来中国首个获批治疗β-地中海贫血的创新药物。
3月11日,苏庇医药(Sobi)研发的干扰素γ(IFNγ)靶向疗法依马利尤单抗获得NMPA批准上市,用于特定的原发性噬血细胞性淋巴组织细胞增多症(HLH)成人和儿童患者的治疗;
同日,豪森制药引进的抗CD19单抗伊奈利珠单抗获批用于治疗抗水通道蛋白4(AQP4)抗体阳性的视神经脊髓炎谱系疾病(NMOSD)成人患者。伊奈利珠单抗是翰森制药首款上市的生物药,也是国内上市的首款CD19单抗。
10月14日,协和麒麟(KyowaKirin)靶向CCR4的莫格利珠单抗获得NMPA批准上市,用于两种罕见的非霍奇金淋巴瘤——塞扎里综合征(SS)或蕈样肉芽肿(MF)。
12月14日,勃林格殷格翰罕见皮肤病靶向生物制剂佩索利单抗(商品名:圣利卓/Spevigo)获得NMPA批准上市,用于治疗成人泛发性脓疱型银屑病(GPP)发作。佩索利单抗是一款可阻断白介素-36受体(IL-36R)激活的单克隆抗体,可抑制IL-36的信号传导,也是中国首个获批专门用于治疗成人GPP发作的治疗药物。
中药创新药研发,收获颇丰
近些年,在诸多利好政策及审评持续优化的驱动下,国内中药创新药获批品种数、申报上市品种数及申报临床品种数逐年上涨,中药创新药研发热情高涨。2022年,药监局批准了淫羊藿素软胶囊、广金钱草总黄酮胶囊、参葛补肾胶囊、芪胶调经颗粒4款1类中药创新药上市。
1月10日,NMPA批准了北京珅诺基1.2类中药创新药淫羊藿素软胶囊的上市申请,用于治疗既往未接受过全身系统性治疗的不可切除的肝细胞癌。该药物的主要成分是从淫羊藿中提取、分离、纯化得到的活性药物单体。
9月15日,NMPA批准了人福医药1.2类中药创新药广金钱草总黄酮胶囊的上市申请,适应症为清除湿热、利尿排石,用于湿热蕴结所致的淋沥涩痛,输尿管结石和上述证候者。该药的主要成份是从广金钱草中提取得到的总黄酮类成份。
12月28日,NMPA批准了安邦制药中药新复方制剂芪胶调经颗粒上市。该药品由黄芪、阿胶、党参、白芍等9味药组方,具有益气补血、止血调经功效,用于上环所致经期延长中医辨证属气血两虚证。
12月29日,NMPA批准了新疆华春生物药业1.1类中药创新药参葛补肾胶囊的上市申请。该药品益气,养阴,补肾,适用于轻、中度抑郁症中医辨证属气阴两虚、肾气不足证。该药品的上市为抑郁症患者提供了又一种治疗选择。
目前,每年均有多款创新药获批上市。
下为2022年中国审批上市创新药列表:
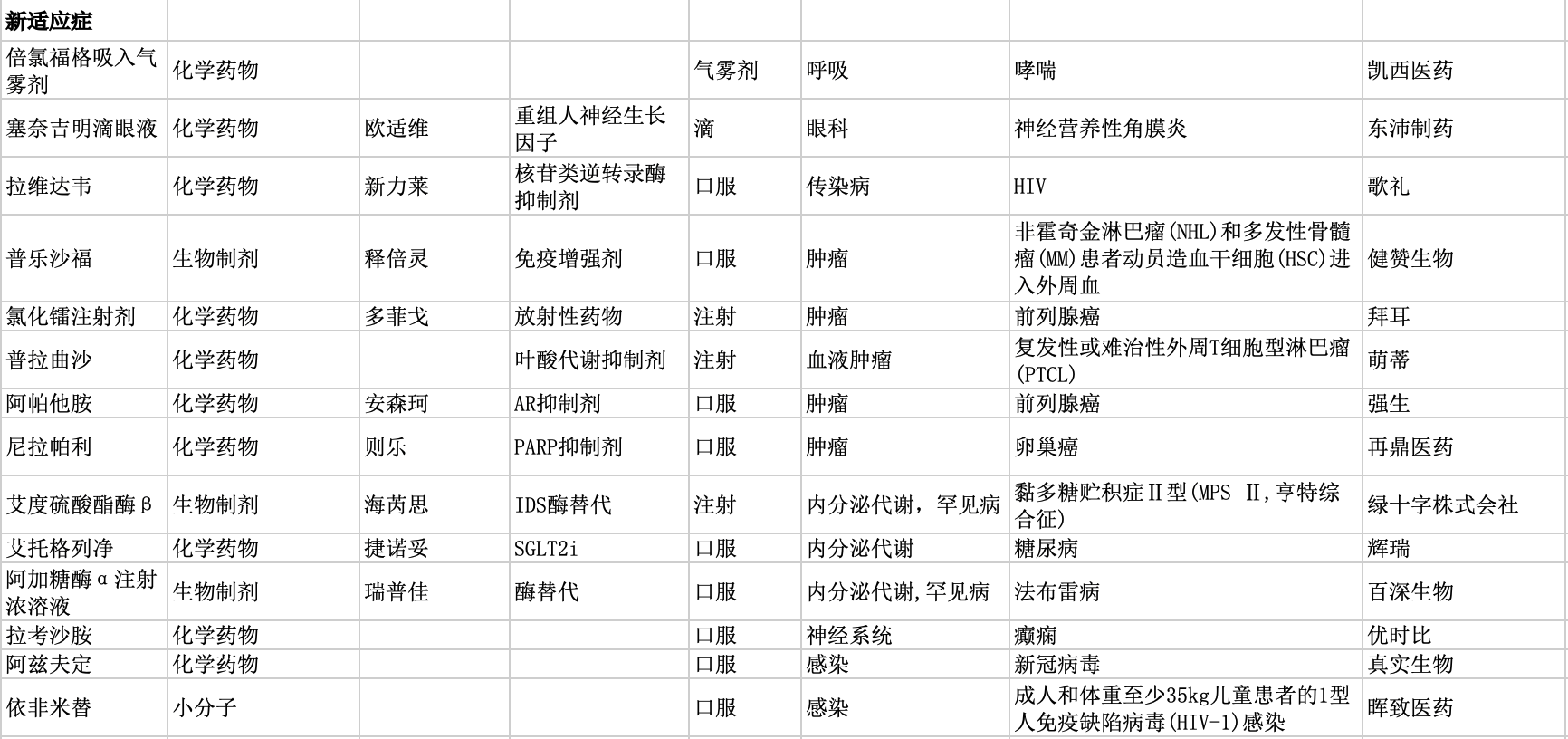
另外,还有一些次新药的新适应症被批准
推荐阅读:
梅斯盘点:FDA在2022年度批准的创新药(上)
梅斯盘点:FDA在2022年度批准的创新药(下)


