罗氏维泊妥珠单抗中国获批上市,BLOOD发表POLARIX研究亚洲人群分析结果
时间:2023-01-18 15:01:40 热度:37.1℃ 作者:网络
维泊妥珠单抗
2023年1月13日,罗氏制药全球首个靶向CD79b的抗体药物偶联物(ADC)——注射用维泊妥珠单抗(Polatuzumab Vedotin)两项适应症获得中国国家药品监督管理局(NMPA)批准,分别为:联合利妥昔单抗、环磷酰胺、多柔比星和泼尼松适用于治疗既往未经治疗的弥漫性大B细胞淋巴瘤(DLBCL)成人患者,以及联合苯达莫司汀和利妥昔单抗用于不适合接受造血干细胞移植的复发或难治性弥漫性大B细胞淋巴瘤成人患者。
维泊妥珠单抗用于初治DLBCL患者适应症的获批是基于全球III期研究POLARIX,该研究旨在比较R-CHOP(利妥昔单抗联合环磷酰胺、多柔比星、长春新碱和泼尼松)方案与Pola-R-CHP(维泊妥珠单抗联合利妥昔单抗、环磷酰胺、多柔比星和泼尼松)方案在DLBCL初治患者中的疗效和安全性。与R-CHOP组相比,Pola-R-CHP组2年PFS率显著改善(70.2% VS 76.7%),疾病进展、复发或死亡的相对风险降低27%,且两方案在安全性上表现相当,更值得注意的是Pola-R-CHP组足疗程治疗比例更高,而发生致剂量降低的不良事件更少。
POLARIX研究也对以中国人群为主的亚洲数据进行了亚组分析,结果PFS获益和其他关键疗效结果均与全球研究结果一致(2年PFS率66.5% VS 74.2%),降低疾病进展、复发或死亡的相对风险达36%,且安全性特征相当。研究详细结果发表于近日的《BLOOD》,通讯作者为朱军教授。

研究设计
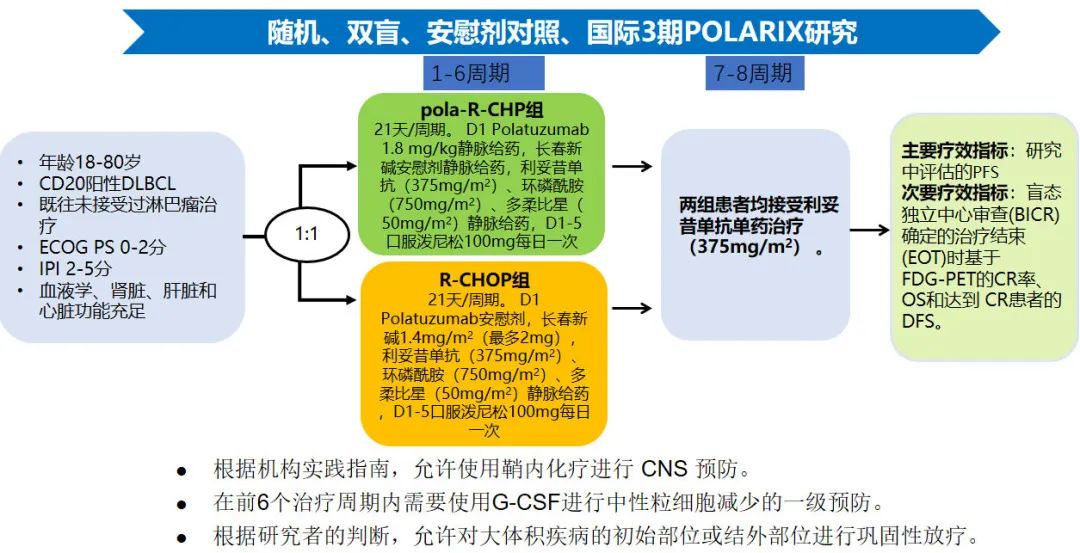
亚洲亚组人群(包括中国扩展队列)中的患者遵循相同的研究设计。
研究结果
患者
POLARIX研究的全球队列中160例来自亚洲(包括中国大陆及台湾地区、日本、韩国),中国扩展队列包括121例患者,因此亚洲亚组人群共包括281例患者(中国大陆150例、日本85例、韩国31例、中国台湾15例)。在这281例患者中,141例随机接受Pola‐R‐CHP,140例随机接受R‐CHOP,详细患者分布见图1。
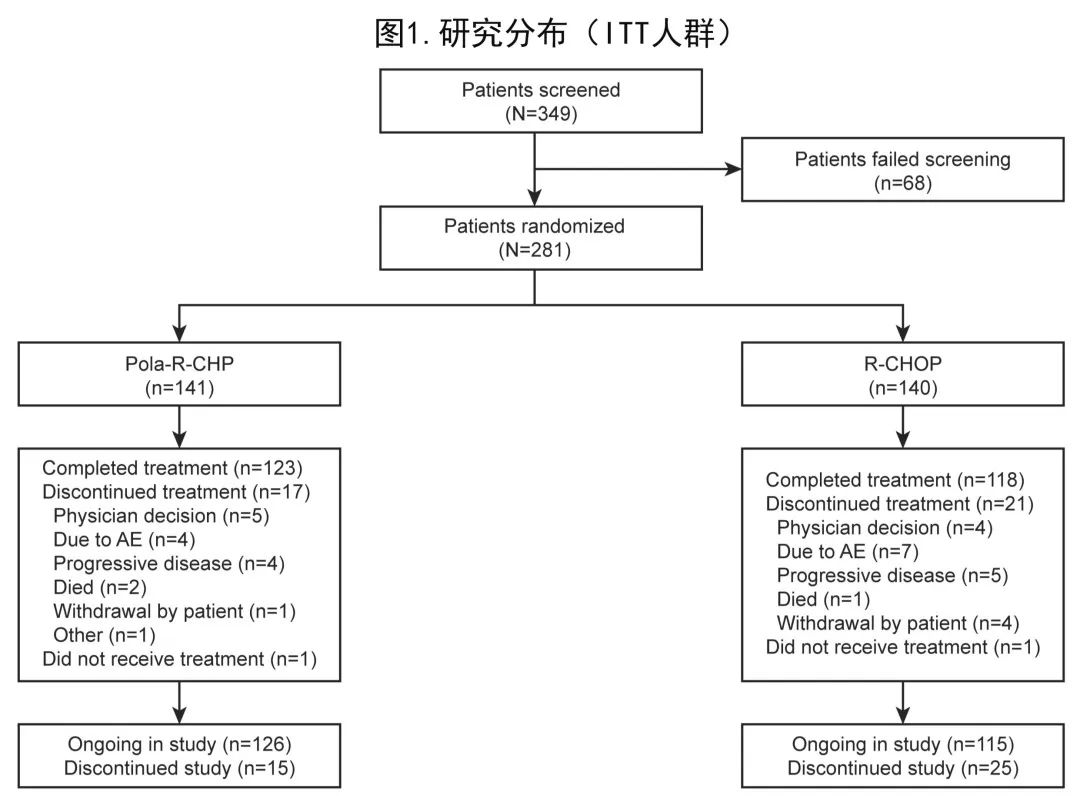
治疗组的人口统计学和基线特征大体平衡(表1)。Pola‐R‐CHP和R‐CHOP组中位年龄分别为63岁和64岁;大多数患者的 ECOG PS 为0-1(82.3%和86.4%)、IPI评分为3-5(61.7%和62.1%)、晚期Ann Arbor III–IV期(86.5%和85.0%)、乳酸脱氢酶升高(68.1%和70.7%)。两组间分层因素、IPI评分或大包块均平衡;但从诊断到启动治疗的中位时间有差异,Pola‐R‐CHP组为17天、R‐CHOP组为15天(而全球研究为26-27天)。总体而言,亚洲亚组人群的人口统计学和基线疾病特征与全球人群基本相似,但亚洲亚组人群更年轻,基线时大包块的患者更少且ABC细胞来源的患者比例略高。
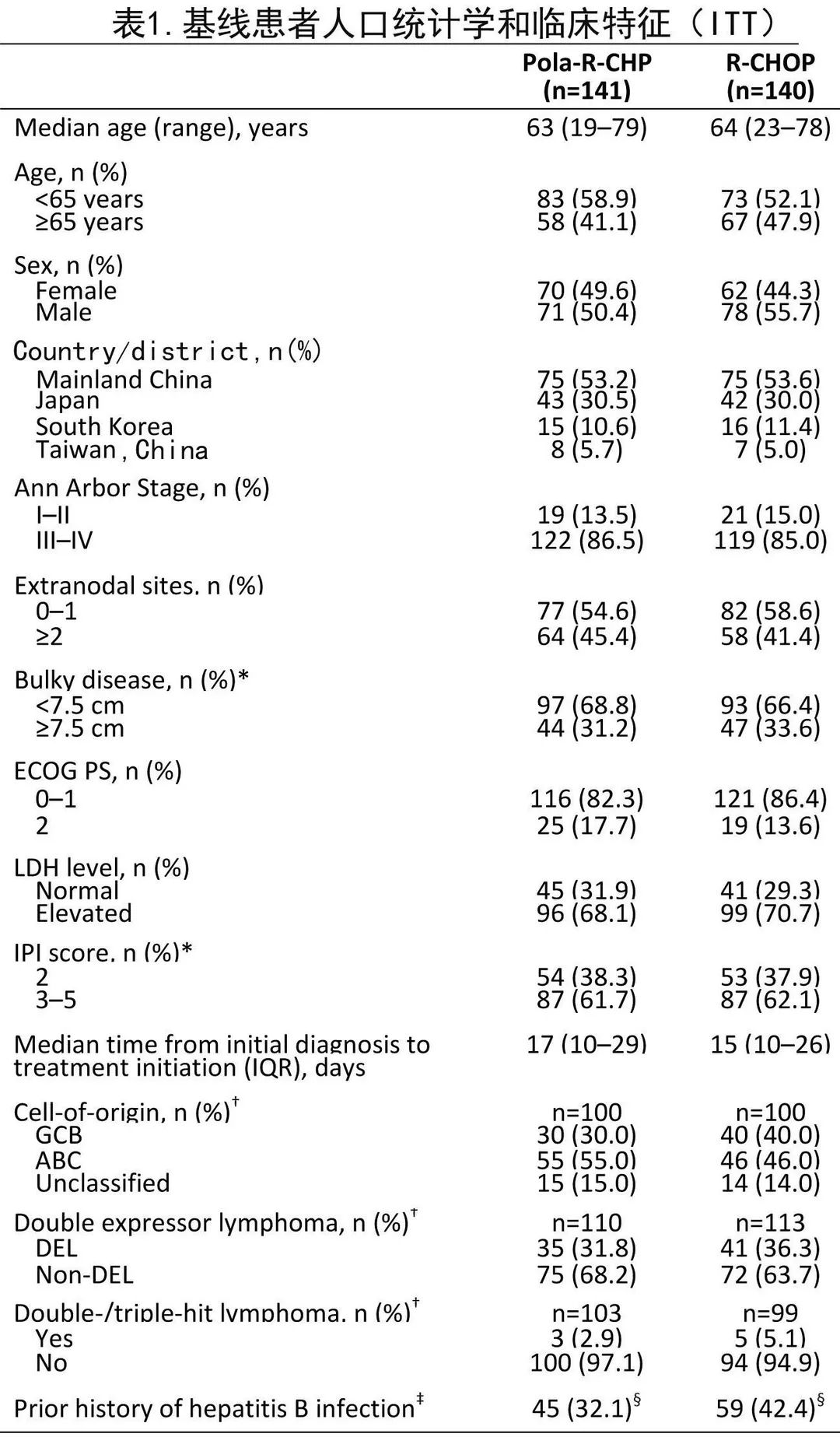
治疗暴露
共有279例患者接受了≥1剂研究治疗(Pola-R-CHP组140例患者,R-CHOP组139例患者)并纳入安全性可评估人群,大多数患者接受了所有计划剂量的化疗。两组均很少有患者提前中止研究治疗,Pola‐R‐CHP和R‐CHOP组分别有94.3%和89.2%的患者接受≥6个周期的任何研究药物治疗,分别有87.9%和84.9%的患者接受8个周期利妥昔单抗治疗。
疗效
中位随访24.2个月,PFS的 HR 为0.64(表2和图2A),与全球研究人群一致。Pola-R-CHP 组和 R-CHOP 组的2年PFS率分别为74.2%和66.5%(表2)。


亚洲亚组人群的关键次要疗效结果支持主要终点。EFS 结局与主要终点 PFS 的结果一致(未分层HR= 0.62);Pola-R-CHP组和R-CHOP组的2年EFS为74.2%和65.6%(表2和图2B),EOT 时独立中心审查通过FDG‐PET评估的 CR 率82.3%和77.9%。分析时 OS 数据不成熟(Pola‐R‐CHP组10例死亡 [7.1%];R‐CHOP组15例死亡 [10.7%];未分层HR= 0.64;表2和图2C)。在达到 CR 的患者中,DFS的 HR 为0.67(未分层,表2和图2D)。
后续抗淋巴瘤治疗与 PFS 结果相似,Pola‐R‐CHP组出现疾病复发并接受后续治疗的患者少于R‐CHOP组。数据截止时,Pola-R-CHP组和 R-CHOP 组分别有22.0%和32.9%的患者接受了≥1次后续抗淋巴瘤治疗。
安全性
亚洲亚组人群分析的关键安全性数据概述见表3和表4。
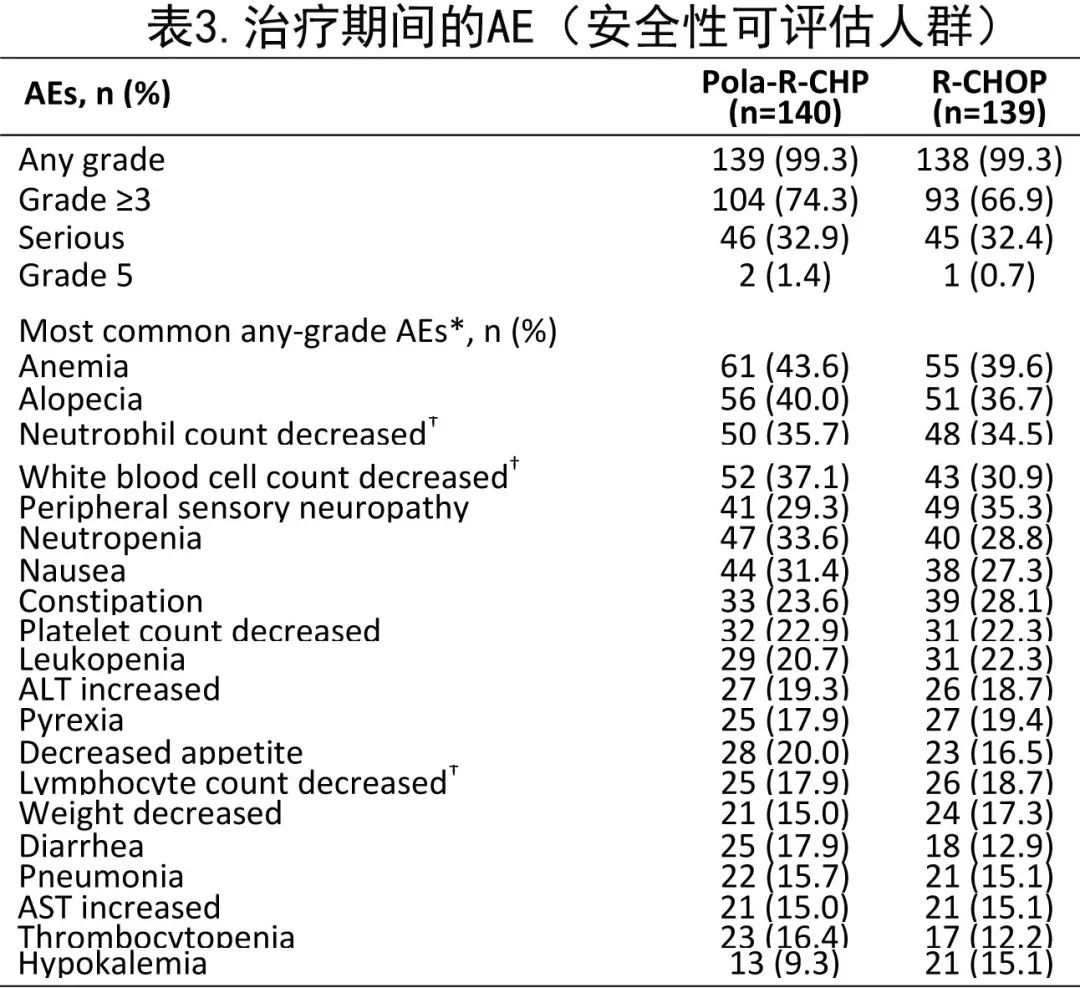
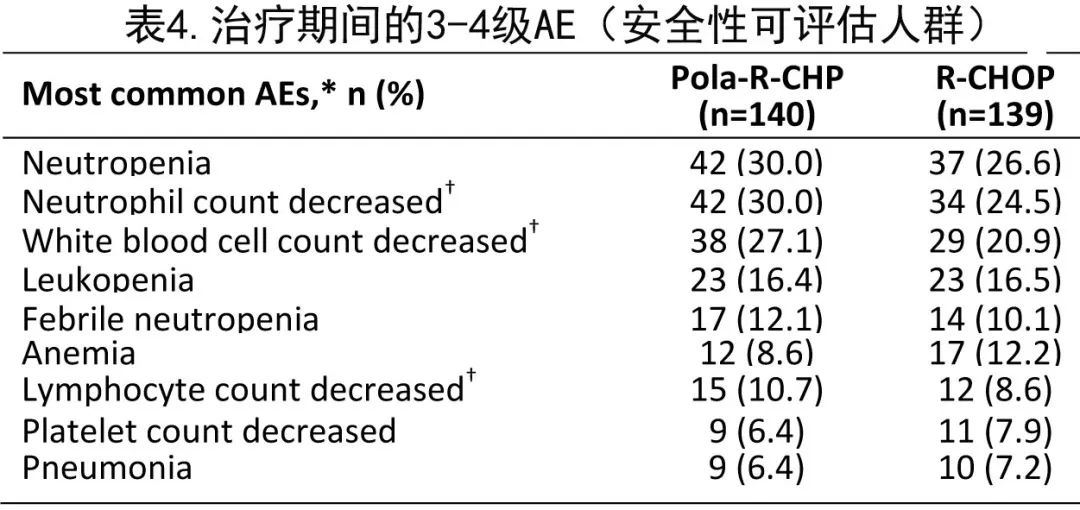
两组中任何级别 AE 的发生率均为99.3%。表3总结了任何级别的治疗期间出现的AE:最常见的 AE 为贫血 (Pola-R-CHP组43.6%;RCHOP组39.6%)、脱发(40.0%和36.7%)和中性粒细胞计数降低(35.7%和34.5%)。此外两组之间3-4级AE(72.9%和66.2%)和SAE(32.9%和32.4%)的发生率相当。最常见治疗期间出现的3-4级 AE 为中性粒细胞减少(30.0%和26.6%)、中性粒细胞计数降低(30.0%和24.5%)和白细胞计数降低(27.1%和20.9%;表4)。Pola-R-CHP 组发生2例 (1.4%)5级AE(怀疑新冠肺炎感染和不明原因死亡),R-CHOP组发生1例 (0.7%)5级AE(不明原因死亡)。
Pola-R-CHP 组和 R-CHOP 组导致任何研究治疗中止的 AE 总发生率分别为5.0%和7.2%。Pola-R-CHP 组4例患者 (2.9%) 因 AE 停用维泊妥珠单抗,R-CHOP组7例患者 (5.0%) 因 AE 停用长春新碱。Pola-R-CHP 组和 R-CHOP 组中因≥1此导致任何研究治疗剂量降低的 AE 的患者比例分别为8.6%和11.5%。
Pola‐R‐CHP和R‐CHOP组中性粒细胞减少(含中性粒细胞减少、中性粒细胞计数降低、白细胞减少和发热性中性粒细胞减少)的发生率分别为67.9%和60.4%(任何级别)和30.0%和26.6%(3-4级),发热性中性粒细胞减少分别为12.1%和10.8%。两组因中性粒细胞减少而停药(0.7%和0.0%)或减量(3.6%和2.9%)的患者比例相当,任何级别感染(41.4%和48.2%)、3-4级感染(10.0%和15.8%)、因感染而停药(2.9%和3.6%)和降低剂量(0.7%和1.4%)的比例也相当。
Pola‐R‐CHP和R‐CHOP组PN 发生率为44.3%和50.4%,且两组间 PN 的严重程度相似。除 R-CHOP 组1例患者发生3级事件外,所有事件均为1-2级(两组分别有5.7%和5.8%的患者发生2级PN)。在发生神经病变的患者中,Pola‐R‐CHP组和R‐CHOP组至任何神经病变发作的中位时间分别为2.2个月和0.8个月,至任何神经病变消退的中位时间分别为8.1个月和5.6个月。极少数患者因 PN 而中止任何研究治疗(Pola‐R‐CHP组无患者,R‐CHOP组2例患者 [1.4%]),而极少数患者因 PN 而减少维泊妥珠单抗或长春新碱剂量(分别为1.4%[n = 2]和2.9%[n = 4])。
筛选时 Pola‐R‐CHP组45例 (32.1%) 患者和R‐CHOP组59例 (42.4%) 患者有既往 HBV 感染史,HBV 再激活定义为基线后任何时间检测到PCR DNA。在这些高危患者中,Pola‐R‐CHP组21例 (46.7%) 患者和R‐CHOP组30例 (50.8%) 患者接受了 HBV 预防。两组分别有2例 (4.4%) 患者和11例 (18.6%) 患者在基线后任何时间出现 HBV 再激活;接受 HBV 抗病毒预防的患者中分别有1例 (4.8%) 和8例 (26.7%) 患者出现 HBV 再激活。R-CHOP 组5例患者在治疗期间发生 HBV 再激活,其余8例患者(Pola-R-CHP组2例,RCHOP组6例)在随访期间发生再激活。未发生暴发性乙型肝炎病例。
结论
亚洲亚组人群的 PFS (HR= 0.64) 结果与 POLARIX 全球研究的主要结果一致,次要疗效指标也支持主要终点结果,显示了 Pola-R-CHP 在EFS、治疗完成时的 CR 率和 DFS 方面的获益。分析时 OS 数据尚不成熟,但Pola‐R‐CHP组的死亡人数少于R‐CHOP组。
安全性方面,在亚洲亚组人群中,既往未经治疗的 DLBCL 患者对 Pola-R-CHP 通常耐受良好,且毒性可控。两组间中性粒细胞减少、发热性中性粒细胞减少和感染的发生率基本相似,3-4级 AE 和 SAE 的总体发生率也相似。Pola‐R‐CHP和R‐CHOP组中导致任何治疗中止或剂量降低的 AE 发生率也相当,表明Pola‐R‐CHP具有良好的耐受性,并且在研究的亚洲亚组人群中用维泊妥珠单抗替代长春新碱不会对治疗过程产生负面影响。治疗组之间 PN 的发生率和严重程度相似,亚洲亚组人群中Pola-R-CHP组PN的比例 (43.4%) 低于全球研究人群 (52.9%)。
在入组本研究的既往 HBV 感染患者中,Pola‐R‐CHP组4.4%和R‐CHOP组18.6%在基线后任何时间发生HBV再激活。由于既往感染 HBV 的人群代表的患者数量较少,因此无法得出明确的结论,但Pola‐R‐CHP的 HBV 再激活发生率似乎并不高于R‐CHOP。此外,这一发现并不能归因于接受常规 HBV 抗病毒预防与 HBV DNA PCR 监测指导治疗的患者比例的差异。这些结果表明,Pola‐R‐CHP在高危患者 HBV 再激活方面耐受性良好,但仍需要在持续警惕这一问题。
总的来说,POLARIX研究的亚洲亚组人群(以中国人为主)结果与全球人群一致,安全性特征相当,并且在亚洲患者中未观察到新的安全性信号。
参考文献
Yuqin Song, Herve Tilly, Shinya Rai,et al.Polatuzumab vedotin in previously untreated DLBCL: an Asia subpopulation analysis from the Phase 3 POLARIX trial.Blood . 2023 Jan 10;blood.2022017734. doi: 10.1182/blood.2022017734.
: , 。 视频 小程序 赞 ,轻点两下取消赞 在看 ,轻点两下取消在看


