J. Neuroinflammation | 张宝荣教授团队揭示ASC斑点促进帕金森病α-突触核蛋白病理进展
时间:2023-04-01 09:20:48 热度:37.1℃ 作者:网络
帕金森病(PD) 是第二大常见神经退行性疾病,其主要病理生理学特征是黑质区多巴胺能神经元的变性丢失和神经元中错误折叠的纤维状α-突触核蛋白(α-syn)的聚集。
近年来,神经炎症和病理蛋白聚集之间的相互作用关系引起广泛关注。其中,NLRP3炎症小体的激活是PD中显著且明确的炎症致病因素之一,已在PD患者大脑的尸检中观察到NLRP3炎症小体的激活。值得注意的是,炎症小体的激活过程中伴随支架蛋白ASC自聚形成斑点结构(ASC speck),并可分泌到胞外发挥功能,具有“类朊病毒样”方式聚集和传播炎症的特性。前期研究已发现ASC斑点可促进阿尔兹海默症病理蛋白的聚集和传播,然而,ASC斑点对帕金森病α-syn病理的调控仍是未知。
因此,本研究通过体内、外研究共同探索ASC斑点对PD病理的调控作用和相关机制,提示靶向ASC可能是抑制PD病理进展的一种新的治疗策略。
我们在人源性A53T突变的α-syn预制纤维 (PFFs) 刺激诱导的小胶质细胞系 BV2 细胞和原代小胶质细胞模型中,以及PFFs单侧纹状体立体定位注射诱导的慢性PD小鼠病理模型中,研究了ASC斑点对小胶质细胞NLRP3炎性激活和神经细胞α-syn病理的调控作用。通过转轴和旷场实验检测小鼠的运动行为功能。通过免疫荧光和免疫印迹等评估α-syn的病理负荷、小胶质细胞和多巴胺能神经元的变化。使用小胶质细胞和神经细胞共培养体系评估细胞内源性ASC蛋白敲降对PD的保护作用。
首先,我们的研究发现,PFFs 诱导的PD小鼠脑内ASC 斑点的形成与 α-syn病理的进展正相关(图1)。

图1:纹状体ASC蛋白表达和α-syn病理负荷正相关
ASC斑点可显著增加PFFs诱导的NLRP3炎性小体的激活和ASC斑点的释放(图2),并在小鼠脑内诱导小胶质细胞的激活增加、细胞焦亡,多巴胺能神经元的丢失和小鼠运动功能障碍。

图2:ASC斑点放大PFFs诱导的NLRP3炎性激活效应
此外,ASC斑点可显著增加PD小鼠脑内α-syn蛋白表达和磷酸化修饰增加,并促进病理蛋白的形成、聚集和传播(图3)。
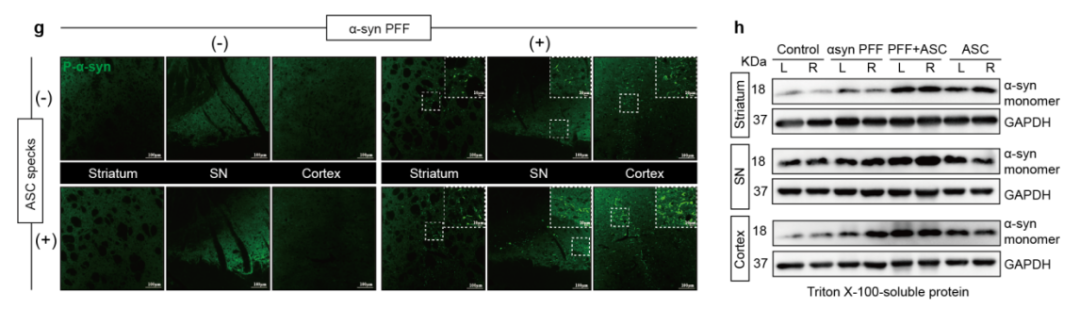
图3:ASC斑点促进PD病理进展
通过小胶质细胞和神经细胞共培养,我们发现内源性抑制ASC蛋白的表达可显著抑制小胶质细胞NLRP3炎性激活和神经细胞内α-syn聚集(图4)。
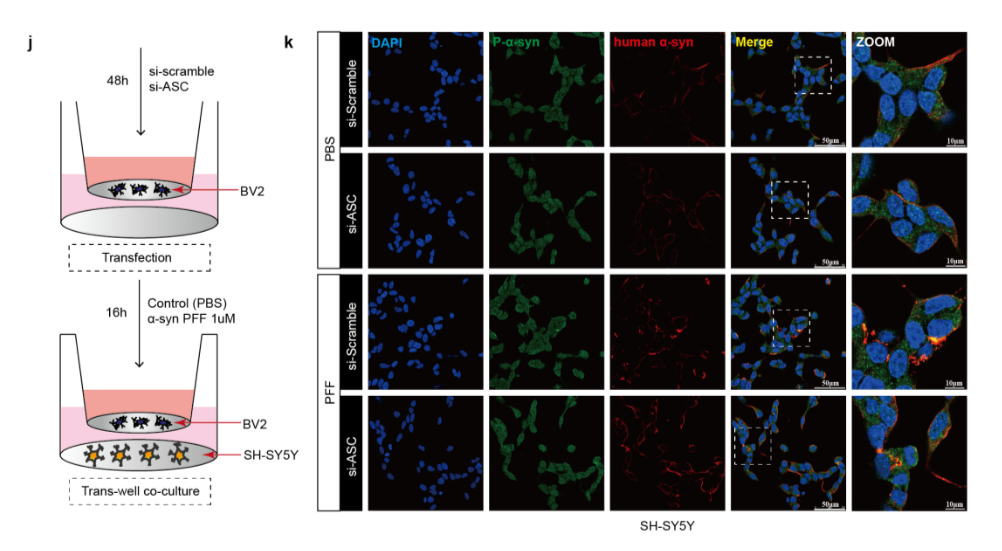
图4:敲降小胶质细胞内ASC可抑制神经细胞内α-syn异常聚集
本研究发现ASC斑点形成、NLRP3炎性激活和PD病理进展之间存在明显关联。在PD中,ASC斑点显著放大NLRP3炎症小体激活和反应性小胶质细胞增生,以恶性正反馈方式促进α-syn病理;ASC斑点还可导致多巴胺能神经变性和运动障碍的早期发生;而内源性 ASC 的敲降可保护小胶质细胞异常炎性体激活和神经元α-syn异常聚集,提示靶向ASC是抑制PD病理进展的潜在新方法。
该研究成果以“ASC specks exacerbate α-synuclein pathology via amplifying NLRP3 inflammasome activities”为题在线发表于领域核心期刊Journal of Neuroinflammation(最新影响因子9.587;中科院神经科学1区)。浙江大学医学院附属第二医院神经内科张宝荣教授和浦佳丽副教授为文章共同通讯作者,团队成员浙大二院神经内科郑冉博士为文章第一作者。该工作得到国家自然科学基金(81771216、 82001346、82001353)和浙江省重点研发计划(2020C03020)的资助。
【文献来源】
Zheng R, Yan Y, Dai S, Ruan Y, Chen Y, Hu C, Lin Z, Xue N, Song Z, Liu Y, Zhang B, Pu J. ASC specks exacerbate α‑synuclein pathology via amplifying NLRP3 inflammasome activities. J Neuroinflammation. 2023 Feb 5;20(1):26. doi: 10.1186/s12974-023-02709-w. PMID: 36740674; PMCID: PMC9899382.


