脓毒性休克的液体治疗如何个体化?
时间:2023-04-12 11:03:02 热度:37.1℃ 作者:网络




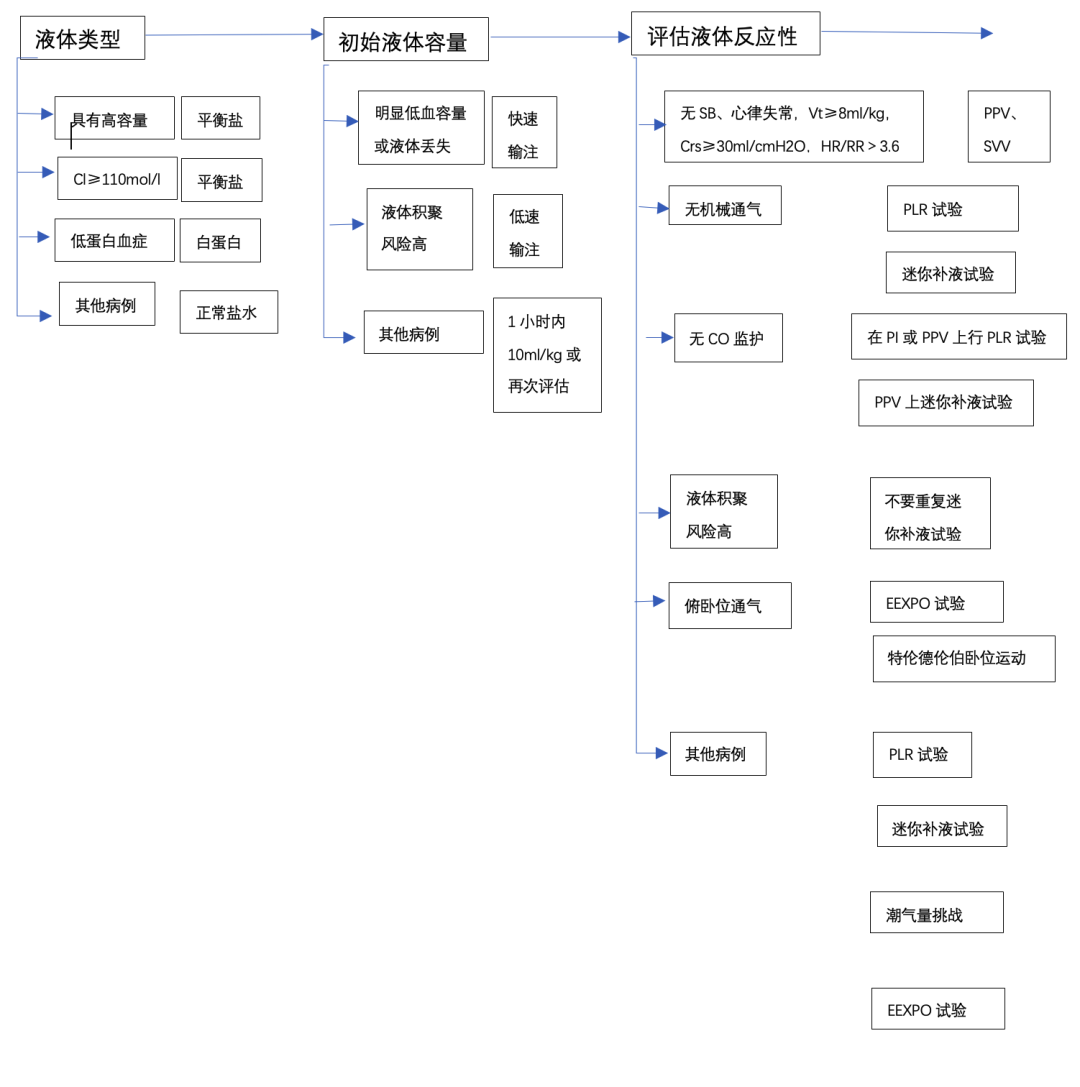

如何制定初始液体容量?
最新的SSC指南指出,低血压或血乳酸升高的脓毒症患者应在出现后3小时内接受≥30 mL/kg的晶体治疗。本卷仅基于一项观察性研究,旨在补偿初始脓毒性休克期间的相对和绝对低血容量。患者的体重是个体化的唯一参数。然而,不同患者的初始体积不足程度明显不同。首先,根据休克的严重程度,相对低血容量与静脉血管舒张有关。其次,在一些患者中,液体损失可能是绝对低血容量的原因,这也必须得到补偿。例如,腹膜炎期间的液体不足必须比肺炎期间更大。30mL/kg的任意容量的建议不可避免地会导致一些患者复苏不足,而另一些患者则会出现液体过载。此外,对液体给药的耐受性也取决于心脏功能。最初的液体治疗应该是个体化的。例如,仅根据患者情况决定减少初始输注量可能会增加死亡率。
在最开始的阶段,由于低血容量是恒定的,因此测试前负荷反应性是没有必要的,并且可能会延迟复苏。之后,应根据前负荷反应程度个体化扩容,以避免不必要的液体输注(图 1)。这是 SSC 推荐的,在这一点上,建议个体化治疗。评估前负荷反应性不应延迟,因为它在脓毒性休克发作后迅速消失。在 ANDROMEDA-SHOCK 研究中,在接受 27 mL/kg 的液体后,70% 的患者在纳入时仍有前负荷反应,其中,不到 20% 的患者在 4 小时后仍然如此。通过评估脓毒性休克期间的前负荷反应性来指导初始液体治疗可以降低液体平衡。
如何自定义前负荷反应性的测试或指标选择?
可以在其他地方找到详细说明指标和检测前负荷响应性的测试。我们在这里的目标是描述导致选择一个而不是另一个的原因。这个选择取决于三个问题(图 1)。
患者插管了吗?
被动抬腿 (PLR) 测试和迷你补液试验不需要机械通气。这使得它们可以对例如急诊室尚未插管患者使用。当然,基于心肺相互作用的测试只能用于插管和通气的患者。脉压变异度(PPV)和每搏量变异度(SVV)(绝对值)只能用于无腹腔内高压,窦性心律,心率与呼吸频率之比≥3.6、无自主呼吸、潮气量(Vt)≥8 mL/kg、呼吸系统顺应性≥30 mL/cmH2O的患者即少数休克患者。下腔静脉和上腔静脉直径的变化具有相同的局限性(除了心律失常和上腔静脉,高呼吸频率)。即使在最佳使用条件下,它的诊断价值也较低,尤其是对于下腔静脉的扩张性 。
即使在心律失常的情况下,,无论 Vt 和呼气末正压 压力水平如何,呼气末闭塞 (EEXPO) 测试(呼气末暂停 15 秒,在出现前负荷反应时会增加心输出量 (CO))也可用于通气患者。当然,患者必须忍受这种相当长的呼吸中断。在Vt为6 mL/kg的通气患者中,Vt挑战(Vt暂时增加到8 mL/kg,在预负荷反应的情况下会增加PPV)对自主呼吸有效,这使其广泛可用,它的有效性越来越好地得到证明。复张操作仅适用于 ARDS 患者而不是常规操作,这极大地限制了它们的使用。最后,在俯卧位时,Trendelenburg 动作可用于将血液输送到心腔并检测前负荷反应性。目前它几乎没有得到验证。在俯卧位,Vt 挑战也是有效的(图 1)。
进行了哪些血液动力学监测?
Vt 挑战、PLR 测试和迷你补液试验的巨大优势在于它们可以使用简单的 PPV 进行,即只需要一根动脉管路。对于 PLR 测试,许多其他变量可以代替 CO,例如通气患者的呼气末二氧化碳,或体积描记法的灌注指数。
EEXPO 测试需要精确测量 CO,因为诱发的每搏输出量变化很小。如果使用超声心动图,应结合呼气末和吸气末暂停,以放大速度时间积分的变化,使其更符合超声心动图的精度。
液体积聚的风险是多少?
迷你补液试验需要注射100-150毫升的液体,如果无效,则无法取出。如果液体积聚的风险很高,那么重复试验是不合理的。从这个角度来看,在手术室使用比重症监护室更适合(图1)。
如何个体化决定在液体中添加血管升压药?
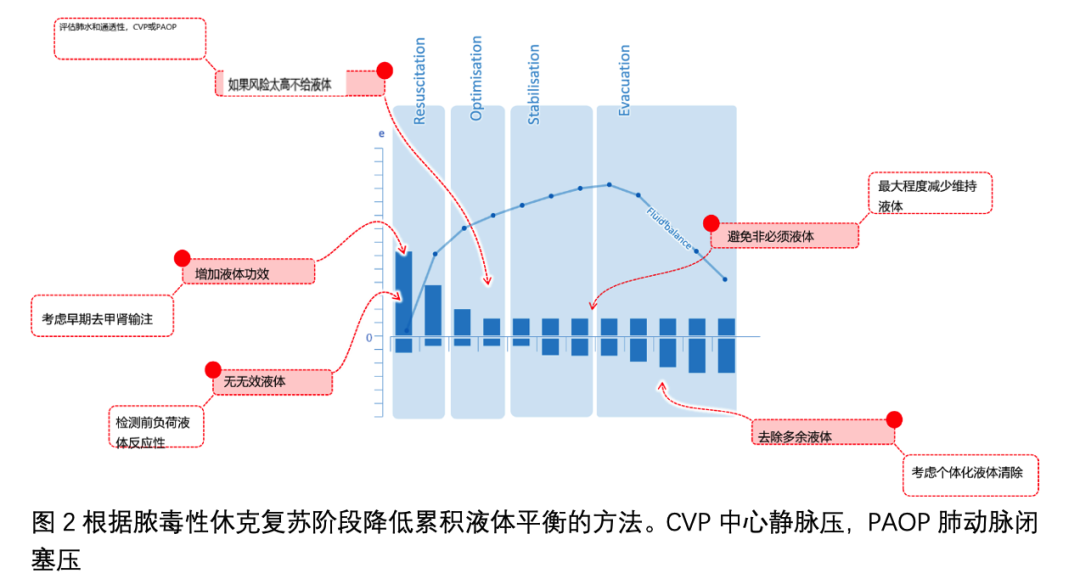
血管加压药可能与液体有协同作用一旦液体推注不再发挥任何益处,通常会开始使用去甲肾上腺素来增加动脉压。然而,它对全身静脉回流的影响不容忽视,因为它们可能有助于限制脓毒性休克期间的液体平衡(图 2)。通过与静脉 α-肾上腺素能受体结合,去甲肾上腺素诱导血管收缩,从而增加应激血容量的一部分。它增加平均全身压力,发挥类似液体的作用。此外,在血管加压药下进行的扩容可能对心脏前负荷产生更大的影响,因为它发生在收缩的静脉区域。
血管加压药可能在某些患者早期使用
去甲肾上腺素的这些静脉作用与补液有协同作用,这可能会减少复苏时补液的量(图 2)。对脓毒症患者的观察性研究表明,尽早开始使用去甲肾上腺素可以降低体液平衡,其中之一 他们将患者与倾向评分相匹配,表明在早期给予去甲肾上腺素时存活率更高。然而,已经报道了相反的观察结果。CLOVERS 研究将患者随机分为限制性策略(优先考虑较低的静脉输液量和血管加压药)和自由性策略(在开始使用血管加压药之前优先考虑较高的液体量)。
尽管在前 24 小时内给予的液体较少,但第 90 天的死亡率在各组之间没有差异。然而,干预组将早期去甲肾上腺素给药与限制性液体策略相结合,存在上述研究的缺陷,因此无法从这些结果中推断出仅早期去甲肾上腺素给药对预后的影响。
此外,在这项研究中,没有选择较早使用去甲肾上腺素的患者。对于大多数低血压的脓毒症患者,应该考虑早期给予去甲肾上腺素,以促进血压恢复。此外,去甲肾上腺素可能对血管显着扩张的患者最有效,如低舒张压(例如 <40mmHg)所示(图 1)。舒张期休克指数(心率除以舒张动脉压)比单独使用每个变量更能预测死亡,也可以考虑用于此目的。
此外,液体推注对 CO 的有效性是短暂的。在围手术期,250 mL 晶体液对 CO 的影响在 10 分钟后消失。由于血管扩张和毛细血管渗漏,脓毒症患者的持续时间可能更短。即使尚未进行调查,液体推注对微循环的影响也可能是短暂的。因此,在脓毒症患者中,用去甲肾上腺素恢复血液动力学可能会产生更持久的效果,尽管这尚未得到证实。
如何自定义停止输液的标准?
良好的液体管理应包括安全标准,表明液体输注的风险超过预期的益处。这些标准在纠正初始低血容量后的稳定阶段尤为重要(图 2)。两种临床情况可能证明监测特定指标是合理的。
ARDS 患者
在这些患者中,为了警惕额外输液的风险,人们通常使用动脉氧分压 (PaO2) 与氧气浓度 (FiO2) 的比值。然而,它也可以通过肺实变、与微血栓相关的分流等而降低,这些不受额外液体输注的影响。“先进”的血流动力学监测技术更直接地估计液体复苏的肺部风险。肺动脉导管估计肺毛细血管压力,推动液体进入间质。通过超声心动图估计这种压力在危重病人中的可靠性很差。
经肺热稀释法测量的血管外肺水和肺血管通透性直接反映了液体向间质和肺泡渗漏的风险。肺、水的最大值影响 ARDS 患者的预后,独立于其他严重程度标准。
肺部超声通过 B 线证明间质性肺水肿。虽然诊断间质性水肿可靠,但其量化肺水肿总量的价值只能通过繁琐的 B 线数计数。此外,它忽略了肺泡水肿,因此它不能很好地反映肺水总量。
腹内高压患者
尤其是在有腹部问题的患者中,应考虑腹内压 (IAP) 来估计液体积聚的风险,液体积聚通过内脏和壁层水肿增加 IAP。腹腔内高压会损害腹部器官(主要是肾脏)的灌注,并独立影响 ICU 患者的预后。在决定在稳定阶段进行液体推注之前,必须考虑这个变量。
不要忘记CVP!
无论患者如何,即使 CVP 不能预测前负荷反应性,其测量也提供了大量经常被忽视的信息。CVP 是器官血流的反向压力,CVP 水平升高与器官功能障碍有关。限制 CVP 的增加可能是一个合理的目标,并且可能有理由对 CVP 升高的患者设定更高的平均动脉压目标。
如何个性化治疗靶点?
液体推注旨在增加平均全身压力、心脏前负荷,从而增加每搏输出量和 CO,并最终改善组织氧合。但是,治疗目标必须适应可用的血液动力学监测和环境。
重症监护病房外
当在病房、院前或急诊科进行液体治疗时,临床检查必须寻找组织灌注改善的临床迹象:皮肤斑点消失,毛细血管充盈时间缩短,这种情况消失得更快,甚至在单次液体推注后也可能发生变化。由于观察时间很短,很少能改善器官功能,尤其是增加利尿作用(图1)。尽管应该一直寻找这些迹象,但它们很难反映CO的变化。
大量液体的主要作用是增加CO,而动脉压只是偶然增加。值得注意的是,平均动脉压的目标可能会适应既往高血压的存在。然而,脉压是监测 CO 变化时应该观察的,因为它是最能反映每搏输出量的压力值。平均动脉压的变化减弱,因为交感神经系统倾向于在 CO 变化时保持恒定。令人惊讶的是,恢复平均动脉压可被视为液体治疗的目标。
然而,即使是脉压的变化也不能完全反映 CO,通过无创血压监测进行评估时可能更是如此。同样,心率的降低对于检测液体引起的 CO 增加是不可靠的。这就是在可能的情况下直接测量 CO 以更好地评估液体影响的理由。
在重症病房
更多变量可用于估计液体功效。CO 很容易测量,可以通过经肺热稀释、肺动脉导管(推荐用于最严重的患者),也可以通过超声心动图测量。如果无法直接测量 CO 但有动脉管路,则 PPV 的降低反映了前负荷反应性的降低,并证明了对液体的反应。在插管和完全稳定通气的患者中,呼气末二氧化碳的增加与 CO 的增加平行。通过灌注指数量化的体积描记信号的振幅,正如一些研究所表明的那样,也可以反映流体引起的 CO 增加。
此外,必须评估对组织氧合的影响,因为CO的增加并不总是导致氧气消耗的改善,或者因为氧气消耗和输送是独立的,或者因为微循环紊乱。在重症监护室中,有几个变量可用于此目的。乳酸的减少与良好的预后有关,是一个有效的治疗目标。通过经常插入的中心静脉导管,静脉血氧饱和度和二氧化碳衍生的变量显示组织氧合得到改善。如果有肺动脉导管,这些变量可以从混合静脉血中更可靠地测量。在静脉血氧饱和度正常的情况下,静脉-动脉二氧化碳分压差与动静脉含氧量差的比值,呼吸商的估计被认为是厌氧代谢的标志,其反应比乳酸更快,假阳性更少。其正常值已被报告为<1.4,尽管已经报告了不同的阈值。
如何自定义液体消耗?
减少总液体平衡的方法之一是在复苏-优化-稳定-撤离(ROSE)概念的“撤离”阶段进行主动液体消耗(图2)。事实上,仅仅减少复苏液是不够的,因为维持液和置换液在重症监护室输注的液体中占很大比例。这种降级的方式是可变的,应该通过考虑有用性和安全性来个性化。
哪些患者应该进行液体清除?
如上文提到的变量所示,对于液体积聚最多的患者,液体消耗应该是最有益的:高左心室充盈压、高CVP、非常多的肺水、CT扫描上的肺充血迹象和IAP升高。软组织水肿的存在并不一定是必需的,因为相反,它们可能伴随着血管内部分的衰竭。
相反,如果液体积聚较少,例如在容易解决脓毒性休克时,液体消耗的好处就不那么明显了。因此,必须权衡进行这项工作的风险和可能带来的好处。
如何去除积液?
首先使用利尿剂。然而,在少尿或无尿的情况下,肾脏替代治疗期间的超滤是替代解决方案。在低白蛋白的情况下,20% 的高渗白蛋白可以对液体去除产生协同作用。在因急性肺损伤通气的患者中,将呼气末正压调整为 IAP,然后输注高渗白蛋白和呋塞米的策略导致累积液体负平衡并减少肺水和 IAP。
如何选择清除的液体剂量?
清除过多液体的风险在于改变血流动力学状态。为了确保液体消耗的安全性,必须考虑生理条件,这在实践中很少做到。首先,血流动力学状态必须稳定,血管升压药必须低剂量或停止使用。
然后,通过去除液体来降低心脏前负荷只能在前负荷反应性的情况下改变血流动力学状况。相反,如果心室前负荷无反应,则必须很好地耐受液体清除。
应将清除液体的决定视为存在前负荷无反应性。在一项针对处于休克稳定期的危重患者的研究中,超滤清除液体不会在没有前负荷反应性的患者中引发透析时低血压,并且在容量损失前PLR测试呈阴性也证明了这一点(图1)。即使在体外回路启动时,在前负荷反应性的情况下CO的降低比在前负荷无反应的情况下要频繁得多,其他因素也可能导致透析内低血压。然而,事实仍然是,前负荷反应性的存在必须促使不要清除额外的液体。
结论
尽管液体疗法看起来很简单,但它很复杂。液体是药物,效果不一致会具有显著的有害影响。就像任何药物一样,它们必须以正确的剂量给药,并且只给需要的患者服用。为了指导液体治疗,而不是依赖于所有患者的相同策略,可以进行个性化决策。考虑患者的特征(血管舒张的严重程度、液体积聚的重要性)、他/她的临床病史(评估初始低血容量的程度)、他的/她的生理状况(特别是前负荷反应性),应在逻辑上确保有效和安全的液体输送和排出。如果不考虑这些单独的标准,研究各种液体治疗策略的临床研究现在和将来都是负面的。


