脓毒症休克中的非肾上腺素能血管升压药的应用:综述和更新
时间:2023-08-18 19:38:52 热度:37.1℃ 作者:网络
背景
脓毒症和脓毒症休克是全世界重症监护病房(ICU)患者入院的主要原因,对资源利用和不良后果有重大影响。最近对文献的系统回顾和荟萃分析表明,脓毒症休克患者的住院死亡率为39%,与评估的时间点无关。脓毒症休克是一种医疗急症,如果输液治疗不足以实现血流动力学稳定,则必须立即使用血管活性药物以实现这一目标。目前的指南推荐去甲肾上腺素作为第一选择血管升压药;然而,某些情况下,如难治性脓毒症休克,可能需要大剂量的去甲肾上腺素,这可能与各种不良反应和死亡率增加有关。
因此,对于需要大剂量去甲肾上腺素的脓毒症休克患者,非肾上腺素能血管升压药被认为是一种可能的治疗选择。这些非肾上腺素能血管升压药包括精氨酸血管加压素(AVP)及其衍生物(特利加压素和塞立加压素)以及血管紧张素II。然而,很少有研究调查这些药物的作用,也没有留下关于它们可能对结果产生有益影响的结论性证据。
在这篇简明的综述中,我们讨论了需要大剂量去甲肾上腺素的患者中与脓毒症休克相关的病理生理学方面、使用非肾上腺素能血管升压药的临床机理以及使用这些药物的最新证据。
脓毒症休克对儿茶酚胺的低反应性
脓毒症休克的特点是循环高动力,主要是由于血管阻力降低和心输出量增加。血管低反应性,被定义为血管对升压药的反应降低,通常发生在脓毒症患者中,常需要逐渐增加去甲肾上腺素的剂量,以实现血流动力学稳定。这种疾病的病理生理学基础与血管收缩剂和血管舒张剂介质之间的不平衡有关。另一方面,血管对儿茶酚胺、AVP和血管紧张素II的反应性可能降低。
尤其是,儿茶酚胺“脱敏”是一种众所周知的现象,其原因是α1-肾上腺素能受体下调或受体与其细胞内信使之间的解偶联。脓毒症状态也与血浆AVP水平降低和AVP1型受体(V1R)表达下调有关。另一方面,各种血管舒张因子(例如:一氧化氮[NO]、肿瘤坏死因子α[TNF-α]、激肽和前列腺素)也在脓毒症期间释放。使得血管舒张作用增强的其他可能机制包括脓毒症导致的内源性过氧亚硝酸盐、超氧阴离子和前列环素产生增加;ATP敏感性钾通道(K-ATP)的激活;糖皮质激素不足。此外,在脓毒症晚期,血管低反应性与rho激酶抑制肌球蛋白轻链磷酸酶(MLCP)对抗血管平滑肌收缩有关。
使用非肾上腺素能血管升压药的基本原理
据报道,大剂量去甲肾上腺素与ICU中的死亡风险独立相关,可能是由于去甲肾上腺素治疗的可能副作用。事实上,大剂量的去甲肾上腺素可能导致外周和内脏缺血、急性心肌梗死、耗氧量增加和高血糖。去甲肾上腺素也被认为与重症患者的ICU获得性虚弱和免疫抑制有关。尽管在早期的观察性研究中,去甲肾上腺素治疗的不良反应可能被患者的病情严重程度所混淆,但Asfar及其同事进行的随机对照试验(RCT)表明,脓毒症休克患者接受大剂量去甲肾上腺素以达到80-85 mmHg的平均动脉压(MAP)目标的心律失常发生率高于低目标(MAP 65-70 mmHg)组。这表明大剂量去甲肾上腺素的有害影响本身可能与疾病的严重程度无关。
在一些研究中也评估了肾上腺素作为替代性血管升压药来使用。在对280名脓毒症休克患者进行的随机对照试验中,肾上腺素在实现MAP目标方面与去甲肾上腺素一样有效,尽管肾上腺素存在潜在的药物相关副作用。在对32项研究进行的系统回顾和荟萃分析表明,与去甲肾上腺素相比,使用肾上腺素对患者的生存并无益处。
在难治性脓毒症休克中,两种儿茶酚胺制剂的联合治疗也可能适得其反,对相同的受体(例如β受体)产生刺激,并增加耗氧量。一项随机对照试验纳入了330例脓毒症休克患者,把给予肾上腺素与去甲肾上腺素联合多巴酚丁胺进行比较。肾上腺素组患者28天的存活率低于去甲肾上腺素+多巴酚丁胺组。此外,在随机分组后的第一天,肾上腺素组的pH值低于对照组,乳酸水平高于对照组。
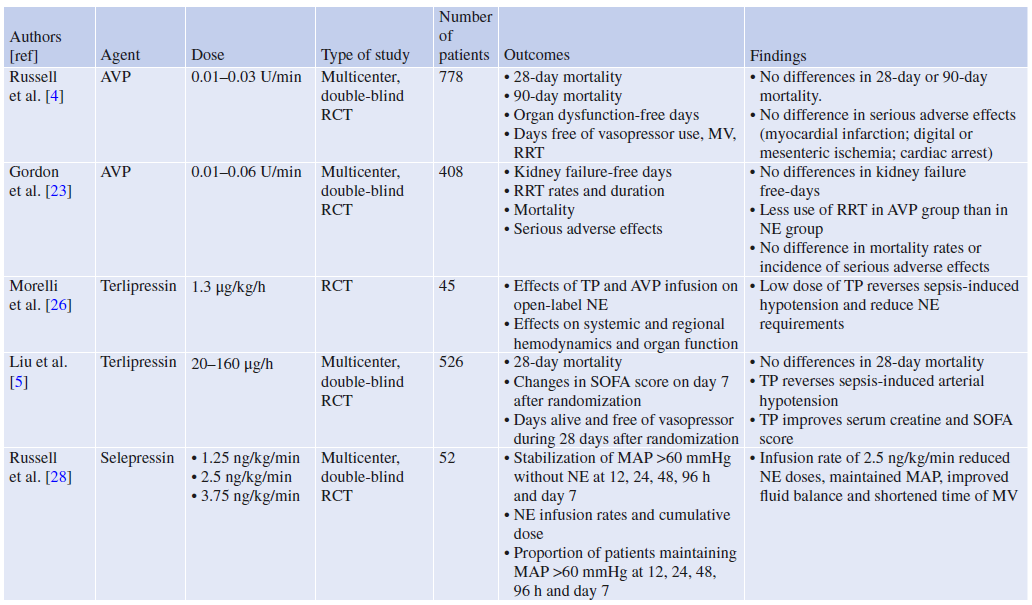
综上所述,大剂量去甲肾上腺素或儿茶酚胺联合使用可能产生的有害影响,或许为使用非肾上腺素能血管升压药提供了合理的理由。图1显示了非肾上腺素能血管升压药对血管平滑肌细胞的作用机制。最近对23项研究(4380名患者)进行的荟萃分析表明,在非肾上腺素能血管升压药中联合去甲肾上腺素与略微显著降低28天死亡率相关。此外,非肾上腺素能血管升压药的应用显示出一些优势,例如增加6小时电击逆转成功率,缩短机械通气时间,改善肾功能。尽管如此,由于RCT证据不足(表1),当前指南中仅建议在去甲肾上腺素中联合AVP(高达0.03 U/min)或肾上腺素以达到65 mmHg的目标MAP,或联合AVP(高达0.03 U/min)以减少去甲肾上腺素的剂量。需要进一步的随机对照试验来提供更多关于这些潜在有用血管活性药物的信息。
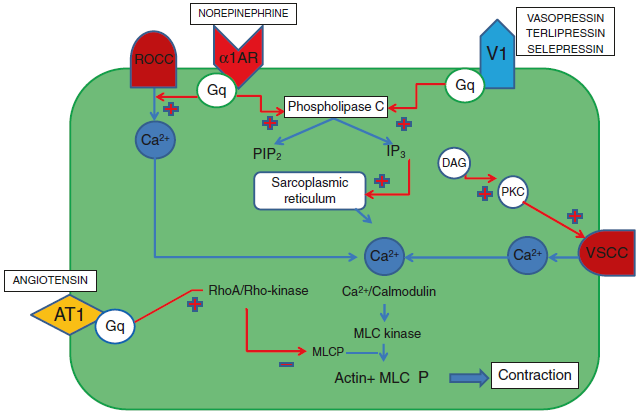
图1. 非肾上腺素能血管升压药对血管平滑肌细胞的作用机制。ROCC 受体操纵的钙通道,VSCC 电压敏感钙通道,α1AR α-1肾上腺素能受体,V1 加压素V-1受体,AT1 血管紧张素II受体1型,Gq 鸟嘌呤核苷酸结合蛋白、Ca++ 离子钙、PIP2 磷脂酰肌醇4,5-二磷酸、IP3 肌醇1,4,5-三磷酸、DAG 二酰甘油、PKC 蛋白激酶C、MLC 肌球蛋白轻链、MLCP 肌球蛋白轻链磷酸酶
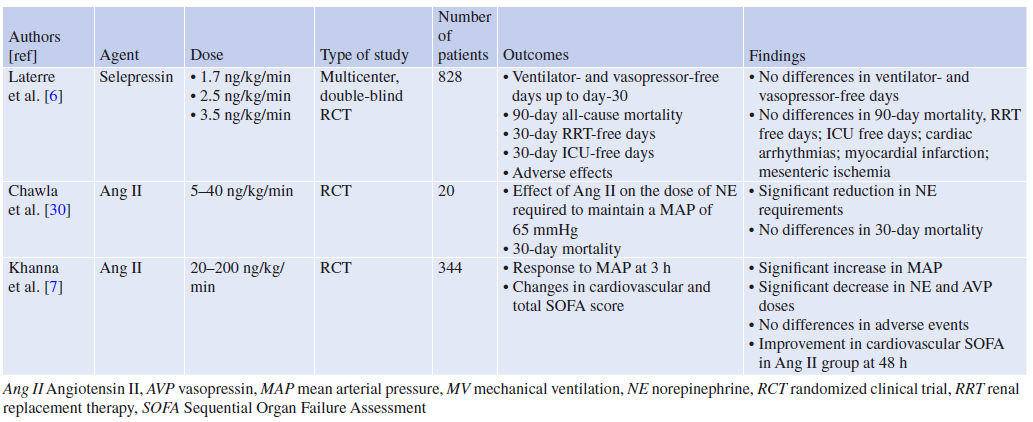
表1.针对非肾上腺素能升压药对脓毒症休克患者预后的可能影响的随机对照研究汇总表
可用的非肾上腺素能血管升压药
加压素及其衍生物
加压素
AVP(也称为“抗利尿激素”)是一种由下丘脑视上核和室旁核产生的九肽,由垂体后叶根据血液渗透压、血压和血容量的变化而释放。AVP通过与特定受体结合发挥作用,如V1a、V1b和V2。V1a-R刺激可导致血管系统平滑肌显著收缩;同时,V1a-R激活可诱导肺血管和冠状动脉血管扩张,这可能是通过内皮细胞释放NO介导的。激活V1b-R导致垂体释放促肾上腺皮质激素(ACTH),刺激V2-R涉及水稳态机制(抗利尿作用),通过NO诱导血管舒张,并释放作用于肝脏水平的凝血因子。脓毒症休克时的AVP浓度通常低于其他类型的循环衰竭。由于这种相对的AVP缺乏,在脓毒症休克期间给予AVP可能会增加血压。此外,脓毒症中可发生AVP超敏反应,可能是由于V1a-R的数量和/或亲和力减少以及下丘脑-垂体轴活动增加所致。AVP可显著降低去甲肾上腺素需求量和心率。相反,与去甲肾上腺素相比,静脉输注AVP也可能更多地改变内脏灌注,从而减少脊髓干和门静脉的血流量。
一项大型多中心、随机、双盲试验比较了779例脓毒症休克患者使用低剂量AVP加开放标签去甲肾上腺素与单独使用去甲肾上腺素的疗效(VASST试验)。AVP以0.01 U/min的剂量开始输注,并滴定至最大0.03 U/min,而去甲肾上腺素以5μg/min的剂量开始输注,并滴定至最大15μg/min。初始目标MAP为65-75mmHg,只有在最大研究药物输注量未达到目标MAP时,开放标签血管升压药才会增加。尽管AVP输注使得去甲肾上腺素总剂量迅速下降,但作者发现两组在28天死亡率或严重不良反应方面并没有显著差异。轻症的脓毒症休克(定义为去甲肾上腺素剂量<15μg/min)患者,给予AVP治疗,死亡率显著降低。随后,在VANISH试验中,纳入了409例脓毒性休克患者,目的是观察与去甲肾上腺素相比,早期使用AVP是否能改善患者的肾脏预后。研究中,为了维持MAP目标65–75 mmHg ,AVP的滴定剂量为VASST试验中使用剂量的两倍(高达0.06 U/min),去甲肾上腺素的滴定剂量为12μg/min。患者随机分为四组:AVP+氢化可的松组;AVP+安慰剂;去甲肾上腺素+氢化可的松;去甲肾上腺素+安慰剂。与去甲肾上腺素相比,早期使用AVP并没有增加无肾衰竭的天数。然而,AVP保留了为维持血压所需的去甲肾上腺素总剂量。与去甲肾上腺素组相比,AVP组前7天的血清肌酐水平较低,尿量稍多。此外,各组之间的死亡率没有显著差异。这些观察结果表明,尽管使用AVP对脓毒症休克患者死亡率的影响尚未得到证实,但它可能是减少去甲肾上腺素需求的安全辅助手段。然而,目前的证据不支持在脓毒症休克患者中常规使用这种药物。
特利加压素
特利加压素是一种合成的三甘氨酰加压素,与AVP相比,具有更长的作用时间(4-6小时)和更高的血管V1a受体选择性。它作为一种前体药,由肝脏和肾脏缓慢降解为赖氨酸加压素。由于其有效半衰期长,特利加压素通常是大剂量快速推注给药(约每4-6小时1毫克)。然而,对于脓毒症休克患者来说,特利加压素的最佳给药方式(快速推注还是持续缓慢输注)尚无共识。在内毒素血症的实验模型中,持续输注特利加压素改善了心肌、肝脏和肾脏灌注。很少有试验将特利加压素与其他血管加压素在人体内的应用进行比较。在20例脓毒症休克患者中,Albanese及其同事发现去甲肾上腺素和特利加压素均增加MAP。此外,特利加压素比去甲肾上腺素更有效地降低耗氧量。Morelli等对45例脓毒症休克患者进行了随机对照试验,比较了特利加压素和AVP对开放标签去甲肾上腺素需求的影响。特利加压素组患者持续输注特利加压素1.3μg/kg/h;AVP组患者持续输注0.03 U/min的AVP。对照组接受固定剂量的去甲肾上腺素(15μg/min)。与输注去甲肾上腺素或AVP相比,相对低剂量的特利加压素在逆转脓毒症引起的低血压和减少去甲肾上腺素需求方面有效。最近,一项多中心随机双盲试验纳入了526名脓毒症休克患者:260名患者被随机分为特利加压素组,266名患者被分为去甲肾上腺素组。特利加压素以20μg/h开始输注,滴定至最大160μg/h,去甲肾上腺素以4μg/min开始输注,滴定至最大30μg/min;在这两组中,初始目标MAP为65–75 mmHg。特利加压素组(40%)和去甲肾上腺素组(38%)的28天死亡率无显著差异。两组之间的存活天数和无血管升压药的天数也没有显著差异。相反,特利加压素组的严重不良事件比去甲肾上腺素组更常见(30% VS 12%;P<0.001)。综上所述,在AVP不可用时,特利加压素可被视为一种替代性血管升压药,以减少难治性脓毒性休克患者对去甲肾上腺素的需求。然而,目前的证据不支持在脓毒症休克患者中常规使用特利加压素。
塞立加压素
AVP刺激血管收缩受体(V1a)和血管舒张受体(V1b和V2)。在这方面,选择性V1a-R激动剂塞立加压素的使用可能更有助于优化脓毒性休克的血流动力学。在羊脓毒症模型中,与AVP和去甲肾上腺素相比,早期给予塞立加压素可改善血流动力学参数。第一次人体2a期试验表明,2.5 ng/kg/min剂量的塞立加压素能够快速停用去甲肾上腺素,同时可维持足够的MAP。塞立加压素还可以改善液体平衡,缩短机械通气时间。最近,SEPSIS-ACT试验验证了selepressin可能改善患者预后的假设,即与安慰剂相比,存活天数增加,且不使用机械通气和血管升压药。SEPSIS-ACT是一项多中心、盲法、随机、安慰剂对照试验,旨在确定多重给药方案的塞立加压素治疗脓毒症休克的疗效。患者被随机分配到3种塞立加压素给药方案中的1组(1.7,2.5,3.5 ng/kg/min;n=585)之中或安慰剂组(n=283)。在纳入了817名患者后,试验因无效而停止。在仅用去甲肾上腺素的患者中,与安慰剂相比,使用塞立加压素并不能减少机械通气时间和也不增加无血管升压药天数或降低关键次要终点(90天死亡率、肾脏替代治疗[RRT],不良反应率)。因此,目前的证据不支持在这些患者中使用塞立加压素。
血管紧张素Ⅱ
血管紧张素II是肾素-血管紧张素-醛固酮系统(RAAS)的主要产物,该系统控制对抗低血压和低血容量的基本稳态机制。在脓毒症休克期间,给予血管紧张素II可改善血流动力学状态,使去甲肾上腺素剂量减少。ATHOS试验,一项II期RCT,分析血管紧张素II在分布性休克治疗中的作用,并在此背景下寻求最佳血管紧张素II剂量。20名脓毒症休克患者随机接受血管紧张素II或安慰剂治疗。血管紧张素II的初始剂量为20 ng/kg/min,加上治疗分布性休克的标准护理疗法(去甲肾上腺素加AVP或肾上腺素)。血管紧张素II给药6小时,每小时调整剂量(最小5 ng/kg/min;最大40 ng/kg/min),以达到65mmHg的MAP。与安慰剂组相比,血管紧张素II可显著降低去甲肾上腺素的需求量。两组的30天死亡率相似。2017年,一项国际RCT(ATHOS-3)表明,与安慰剂相比,血管紧张素II可导致MAP显著上升。此外,在随机化后的前48小时内,血管紧张素II组的血管升压药去甲肾上腺素和AVP的剂量显著减少,而安慰剂组则没有下调。有趣的是,两组之间的不良反应没有差异。最近,在需要体外膜肺氧合(ECMO)和RRT持续的患者中使用血管紧张素II的研究取得了一些有益的结果(血管升压药的需求减少,利于RRT的脱机)。然而,血管紧张素II的安全性从未在血管扩张性休克和并发心肌功能障碍的患者中进行过测试。事实上,血管紧张素II可能由于其优先的血管收缩作用而增加后负荷从而减少心输出量。仍需要进行大规模随机对照试验,以研究血管紧张素II对难治性脓毒性休克患者的可能影响,并确定哪些患者可能受益于或可能不受益于该疗法。
未来展望
虽然非肾上腺素能血管升压药尚未显示出对脓毒症休克患者的预后有影响,但未来的研究应着眼于确定可能受益于这些药物的患者亚组。特别是,治疗目标不仅要考虑全身血流动力学参数(如:MAP和心输出量),也应考虑微血管灌注的指标。事实上,所谓的“血液动力学不一致”或宏观血液动力学参数不能反映微血管灌注可能是脓毒症休克患者治疗成功的重要决定因素。
结论
难治性脓毒症休克可能需要大剂量的去甲肾上腺素,这可能与各种不良反应和死亡率增加有关。在这些患者中,使用非肾上腺素能血管升压药可能是一种可行的治疗选择。很少有研究调查了这些药物的作用,没有留下关于其可能对结果有益的结论性证据。目前的证据不支持常规使用这些药物;然而,AVP可能是减少脓毒症休克患者对去甲肾上腺素需求的安全辅助手段。


