朱俊桥医生:儿童室管膜肿瘤最新诊疗进展
时间:2023-08-27 15:43:32 热度:37.1℃ 作者:网络
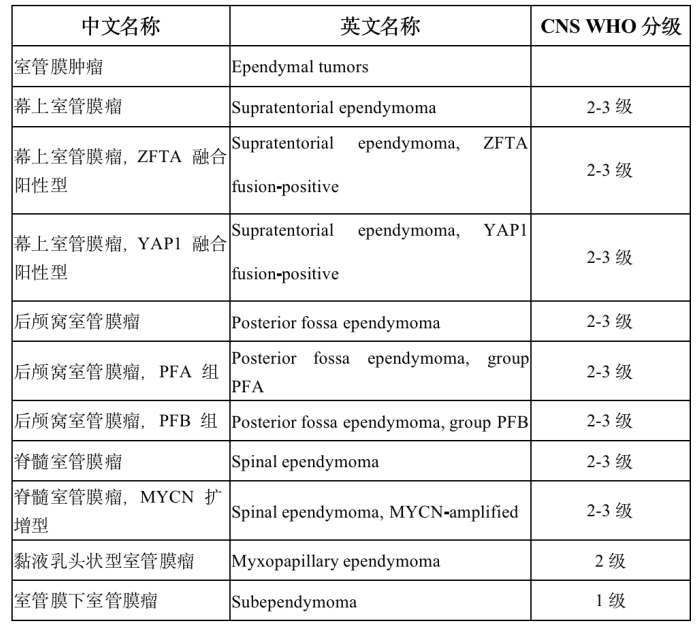
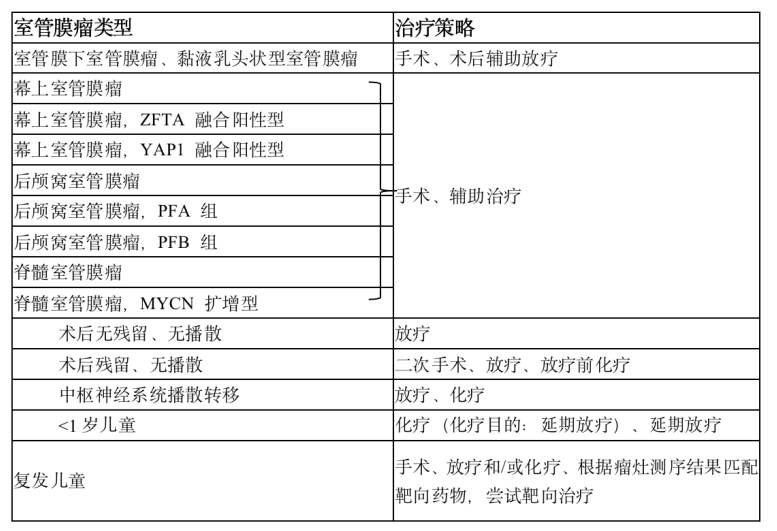
1 概述 室管膜肿瘤来源于脑室和脊髓中央管内衬的室管膜细胞,可发生于神经系统的任何部位,发病率为0.29-0.6/10万,占颅内胶质瘤的5%-6%,约69%发生于儿童,占儿童脑肿瘤的9%。室管膜肿瘤具有通过脑脊液在神经系统内(包括脊髓)播散的潜能。肿瘤的级别越高,转移的发生率也越高,全身性转移罕见。儿童颅内室管膜肿瘤发病高峰年龄为4-6岁,最常见于后颅窝,脊髓内亦可见。[1] 2 适用范围 经肿瘤组织病理学确诊的0-18岁室管膜肿瘤初诊患儿。 3 诊断 3.1 临床表现 由于室管膜肿瘤生长部位不同,临床表现差别很大,颅高压在幕上及幕下上位都是最常见的临床表现,最常见体征则为视盘水肿。室管膜肿瘤根据其发病部位临床表现如下:①幕下(后颅窝)室管膜肿瘤:后颅窝是室管膜肿瘤常见的发病部位,后颅窝部肿瘤可侵犯第四脑室引起梗阻性脑积水。幕下室管膜肿瘤较其他肿瘤更易延伸至颈部蛛网膜下腔,患儿更易表现出颈部僵硬、颈痛、斜颈和斜头;肿瘤侵犯脑干时,可出现呃逆、注视麻痹、面部感觉障碍、听力减退等颅神经损害症状;侵犯小脑可表现走路不稳、眼球震颤、共济失调和肌力减退。②幕上室管膜肿瘤:幕上室管膜肿瘤可导致头痛、癫痫或与发病部位相关的局灶性神经功能缺损。③脊髓室管膜肿瘤:脊髓室管膜肿瘤通常是黏液乳头状瘤,常表现为背部疼痛、下肢无力、肠道和膀胱功能障碍。[1] 3.2 脑脊液检查 肿瘤细胞学检查阳性脑脊液可伴随着非特异性的蛋白升高及细胞数增多,但是脑脊液检查阴性并不意味着不存在肿瘤播散。可以采取术中切除肿瘤前穿刺抽取脑脊液进行肿瘤细胞学检查。若在术后行腰穿检查,应该在术后2周后,以避免由于手术操作后造成的假阳性结果。[1] 3.3 影像学检查 ①头部CT检查:评价后颅窝肿瘤作用有限。肿瘤实质呈稍高密度或等密度。出血和钙化多见,瘤周水肿明显,强化时多呈显著不均质强化。②MRI检查:常用的检查方法,行全脑全脊髓平扫和增强扫描有助于发现可能的转移性病灶。通常表现为第四脑室底部的占位病变,常伴梗阻性脑积水。影像学上可能与髓母细胞瘤难以鉴别。 鉴别要点:室管膜瘤 MRI常见第四脑室占位,粘连紧密,强化不均匀,形态不规则,常向上堵塞导水管下口,向下延伸至延颈交界,且向周围侵袭性生长。髓内室管膜瘤上下边界常有“鼠尾征”表现。[1] 3.4 病理学诊断 室管膜肿瘤典型的组织学表现为单一形态的圆形或椭圆形细胞、布满染色质的核,室管膜形成的真性菊形团和血管周的假性菊形团。2021年WHO根据室管膜肿瘤的解剖部位分类,可分为幕上(20%-30%)、后颅窝(50%-60%)和脊髓(约为20%)共3个部位,每一部位分类下包含数种典型基因分型病理分为以下类型,包括:①幕上室管膜瘤;②幕上室管膜瘤,ZFTA 融合阳性型;③幕上室管膜瘤,YAP1 融合阳性型;④后颅窝室管膜瘤;⑤后颅窝室管膜瘤,PFA 组;⑥后颅窝室管膜瘤,PFB 组;⑦脊髓室管膜瘤;⑧脊髓室管膜瘤,MYCN 扩增型;⑨黏液乳头状型室管膜瘤;⑩室管膜下室管膜瘤。[1-3] 具体分型WHO分级可参考表1。 表1 2021 年世界卫生组织中枢神经系统肿瘤分类(第五版)室管膜肿瘤分类 3.5诊断标准 术前影像学结合术后病理诊断可以确诊室管膜肿瘤。 3.6鉴别诊断 后颅窝室管膜肿瘤需要与髓母细胞瘤、星形细胞瘤鉴别;侧脑室室管膜肿瘤需要与脉络丛乳头状肿瘤、室管膜下巨细胞型星形细胞瘤鉴别;幕上脑实质内室管膜肿瘤需要与低级别星形细胞瘤、胶质母细胞瘤鉴别。[1] 4 治疗 本规范重点参考美国儿童肿瘤协作组、欧洲神经肿瘤学会诊疗指南、诊疗方案。治疗总体策略建议见表2。[4] 表2 中枢神经系统室管膜肿瘤治疗策略 4.1手术治疗 ①肿瘤切除:手术治疗的目的是在不引起神经功能缺损的情况下,最大限度地切除肿瘤(因为手术切除程度是一项重要的预后因子)。手术入路多采用后正中入路或者旁正中入路。术后2周进行腰椎穿刺寻找“脱落转移灶”。取10 mL脑脊液进行细胞学检查,如果存在恶性细胞,可以对其进行定量计数(可以用于随后治疗)。如果腰椎穿刺结果阳性,可以确定“脱落转移灶”。如果腰椎穿刺结果阴性,则对于临床意义不大(灵敏度不高)。脑室外引流获得的脑脊液标本敏感性低于腰椎穿刺获得的脑脊液。②脑室腹腔分流手术:不建议术前行脑室腹腔分流手术。如果患儿术后或者在放化疗过程中出现了脑室扩大,颅高压表现,且不能缓解,可行脑室腹腔分流术,重建脑脊液循环平衡。[1,4] 4.2 放射治疗 室管膜瘤的放射敏感性仅次于髓母细胞瘤,列第二位。手术切除肿瘤后辅以放疗(术后放疗可以改善生存率:50%接受放疗的患者的生存期较未接受放疗的患者长2年,未接受放疗的患者5年生存率为 20%-40%,接受放疗的患者该数据上升至40%-80%)。[1,4]年龄>3岁患者的放疗见下文。 4.2.1 颅脑放疗 ①传统治疗:瘤床 45-48 Gy(复发者另加 15-20 Gy);②最近推荐治疗方案:三维适形放疗,剂量略高(瘤床及周边1 cm 59.4 Gy);③调强放疗可以获得相似的局部控制,但可能会对正常组织影响较小。[1,4] 4.2.2 脊髓放疗 大多数只在具有“脱落转移灶”或脑脊液细胞学检查阳性的情况下使用(然而,对于是否进行预防性脊髓放疗尚有争议)。①低剂量全脊髓放疗(一个疗程平均剂量 30 Gy)。②增加“脱落转移灶”部位的放射剂量。③由于存在副作用,故3岁以下婴幼儿不推荐放疗。当治疗失败时采用放疗,约30%的年龄<3岁的婴幼儿可以避免放疗并获得类似的生存率。这种选择性放疗的概念可能也适用于年长一些的儿童。 4.3 化学治疗 化疗可作为手术和放疗的辅助手段,术后有明确残留灶而未再次手术或者是肿瘤播散的患儿应进行化疗。[1,4,5]婴幼儿患儿化疗目的是推迟放疗或在放疗前患儿处于无肿瘤残留状态。 对于年龄<18 个月、WHO Ⅱ或Ⅲ级患儿,可选择长春新碱+卡铂+甲氨蝶呤+环磷酰胺+顺铂方案化疗。 对于年龄>18 个月、WHO Ⅱ或Ⅲ级、术后有残留患儿,可给予长春新碱+依托泊苷+环磷酰胺±顺铂方案化疗。 对于术后残留较多的患儿(残留病灶>5 mm),可于二次手术前行长春新碱+卡铂+环磷酰胺方案及长春新碱+卡铂+依托泊苷方案化疗,之后行二次手术切除残留病灶。 5 并发症及辅助治疗 5.1 放疗并发症 内分泌功能障碍、神经认知功能以及感觉功能障碍常见于全脑全脊髓放疗后。其严重程度与患儿放疗时年龄和放疗的剂量相关。迟发性中风、血管狭窄闭塞性疾病、血管畸形、中风样偏头痛等脑血管疾病亦见于颅脑放疗后。另外放疗会增加再次出现恶性肿瘤可能性。[1] 5.2 化疗毒副反应 长春新碱+卡铂+甲氨蝶呤+环磷酰胺+顺铂方案常见3、4级血液毒性、胃肠道反应和神经毒性,3、4级听力受损及肾毒性少见。长春新碱+依托泊苷+环磷酰胺±顺铂方案常见 3、4级血液毒性、神经毒性和听力受损。长春新碱被公认具有多种神经毒性,长期使用可造成自主神经功能障碍、颅神经受累、远端感觉异常以及腱反射消失等。化疗后可出现3、4级血液学毒性。贫血严重者需要输注红细胞,血小板计数<20×109/L 时可输注血小板,伴有明显出血症状或感染表现时输注指征可适当放宽。化疗后出现粒细胞缺乏者可以化疗后24 h开始给予粒细胞集落刺激因子注射。粒细胞缺乏合并感染时,在取送各种培养后,须立即给予初始经验性治疗,待病原体明确后,再进行针对性治疗。顺铂有神经毒性和耳毒性,用药前及用药过程中应常规检测听力。铂类药物会引起肾脏损害,用前需要计算肾小球滤过率,若明显降低,铂类药物需适当减量。环磷酰胺可引起出血性膀胱炎,应用时需要常规应用美司钠预防出血性膀胱炎,并给予充分水化碱化液静点。[1] 6 随访 术后随访包括头部及脊髓增强核磁、体格检查。术后第1年,每3个月复查1次;术后2-3 年,每6个月复查1次;术后4-5年,每1年复查1次。[1] 参考文献 [1] 儿童室管膜肿瘤诊疗规范(2021年版)[J]. 全科医学临床与教育, 2021, 19(09): 773-6. [2] Ellison DW, Aldape KD, Capper D, et al. cIMPACT‐NOW update 7: advancing the molecular classification of ependymal tumors[J]. Brain pathology (Zurich, Switzerland), 2020, 30(5): 863-6. DOI:10.1111/bpa.12866. [3] Spino M, Snuderl M. Genomic Molecular Classification of CNS Malignancies[J]. Adv Anat Pathol, 2020, 27(1): 44-50. DOI:10.1097/PAP.0000000000000254. [4] Rudà R, Reifenberger G, Frappaz D. EANO guidelines for the diagnosis and treatment of ependymal tumors. Neuro Oncol. 2018 Mar 27;20(4):445-456. doi: 10.1093/neuonc/nox166. [5] Wu J, Armstrong TS, Gilbert MR. Biology and management of ependymomas. Neuro Oncol. 2016 Jul;18(7):902-13. doi: 10.1093/neuonc/now016. Epub 2016 Mar 28.