【专家述评】| 淋巴瘤CD30免疫组织化学检测及结果判读规范
时间:2023-09-11 16:57:41 热度:37.1℃ 作者:网络
[摘要] CD30可在多种淋巴瘤中表达,其中经典型霍奇金淋巴瘤(classical Hodgkin lymphoma,CHL)和间变性大细胞淋巴瘤(anaplastic large cell lymphoma,ALCL)最为常见。近年来,靶向CD30的抗体药物偶联物维布妥昔单抗已获批应用于复发/难治性CHL和ALCL患者的治疗,并取得显著疗效。然而,该靶向治疗药物能否使其他类型淋巴瘤患者获益目前尚不明确,精确评估CD30表达水平对此类淋巴瘤患者的临床试验和个体化治疗有重要的指导意义。目前,CD30检测仍主要通过免疫组织化学染色的方法,尚缺乏统一、规范的检测流程及结果判读标准。本文通过分析CD30的检测现状,联合多中心研究探索CD30免疫组织化学检测流程及结果判读方法,并结合文献和专家经验,最终达成淋巴瘤CD30免疫组织化学检测及结果判读共识,希望能有助于淋巴瘤CD30表达的规范化检测。
[关键词] 淋巴瘤;CD30;免疫组织化学;检测规范;判读标准
[Abstract] CD30 can be expressed in a variety of lymphoma subtypes, among which classical Hodgkin lymphoma (CHL) and anaplastic large cell lymphoma (ALCL) are the most common ones. Recently, Brentuximab vedotin, the antibody-drug conjugate targeting CD30, has been approved in the treatment of patients with refractory and relapsed CHL and ALCL, and has achieved significant curative effect. However, whether CD30-targeted therapy could benefit patients with other types of lymphoma remains largely unknown. Accurate evaluation of the expression level of CD30 may thus have important guiding significance for the clinical trials and individualized treatment of patients with those lymphomas. To date, CD30 detection is mainly via immunohistochemical staining, however, with no unified and standardized process and interpretation method. We herein described the current status on CD30 testing, and explored the procedures of immunohistochemical detection and interpretation of the results through multicentric studies. A consensus was finally reached, which was based on the combination of our research results, literature review, experts’ experience, and internal discussion among the panel members, and might hopefully contribute to standardization of the immunohistochemical detection and interpretation of CD30 expression in lymphomas.
[Key words] Lymphoma; CD30; Immunohistochemistry; Standards for detection; Criteria for interpretation
CD30阳性淋巴瘤病理专家组成员
(以姓名汉语拼音字母为序)
敖启林 | 华中科技大学同济医学院附属同济医院病理科
陈 刚 | 福建省肿瘤医院病理科
陈燕坪 | 福建省肿瘤医院病理科
陈子航 | 四川大学华西医院病理科
冯晓莉 | 中国医学科学院肿瘤医院病理科
巩文辰 | 天津市肿瘤医院病理科
郭凌川 | 苏州大学附属第一医院病理科
黄雨华 | 中山大学肿瘤防治中心病理科
蒋翔男 | 复旦大学附属肿瘤医院病理科
况 东 | 华中科技大学同济医学院附属同济医院病理科
赖玉梅 | 北京大学肿瘤医院病理科
李向红 | 北京大学肿瘤医院病理科
李小秋 | 复旦大学附属肿瘤医院病理科
刘卫平 | 四川大学华西医院病理科
孟 斌 | 天津市肿瘤医院病理科
饶慧兰 | 中山大学肿瘤防治中心病理科
时云飞 | 北京大学肿瘤医院病理科
童 星 | 苏州大学附属第一医院病理科
王健超 | 福建省肿瘤医院病理科
吴梅娟 | 浙江省肿瘤医院病理科
薛学敏 | 中国医学科学院肿瘤医院病理科
赵 莎 | 四川大学华西医院病理科
1 淋巴瘤CD30的表达、临床意义及检测现状
淋巴瘤是一组具有高度异质性的淋巴造血组织肿瘤,传统上分为霍奇金淋巴瘤和非霍奇金淋巴瘤(non-Hodgkin lymphoma,NHL)两大类,后者按细胞系起源又进一步分为若干种B细胞、T细胞和自然杀伤(natural killer,NK)细胞性肿瘤。CD30作为肿瘤坏死因子家族成员之一,是一种相对分子质量为120×103的跨膜蛋白,可在活化淋巴细胞和多种淋巴瘤细胞中表达,发挥其多重生理及病理学作用。在不同类型的淋巴瘤中,CD30的表达特点不尽相同。在绝大部分经典型霍奇金淋巴瘤(classical Hodgkin lymphoma,CHL)和间变性大细胞淋巴瘤(anaplastic large cell lymphoma,ALCL)中, CD30通常呈高表达,表现为所有肿瘤细胞CD30免疫染色均呈较强阳性结果。外周T细胞淋巴瘤中也有较多亚型(包括血管免疫母细胞性T细胞淋巴瘤、非特指性外周T细胞淋巴瘤、结外NK/T细胞淋巴瘤、肠病相关T细胞淋巴瘤及诸多原发性皮肤T细胞淋巴瘤等)频度不等地表达CD30,但表达水平存在较大个体差异。此外,相当多的大B细胞性NHL亚型(如原发性纵隔大B细胞淋巴瘤、灰区淋巴瘤、EB病毒阳性的弥漫性大B细胞淋巴瘤、间变型弥漫性大B细胞淋巴瘤等)也经常呈现CD30阳性的表型。CD30的表达不但对于特定类型淋巴瘤的诊断和鉴别有帮助,而且对于患者的预后评估也有一定价值。约64%的非特指性外周T细胞淋巴瘤可表达CD30[1]。35%~75%的结外NK/T细胞淋巴瘤表达CD30并具有预后预测意义[2],也有研究[3]表明,CD30阳性的弥漫性大B细胞淋巴瘤治疗结局显著优于CD30阴性组。近年来,CD30还被用来研发淋巴瘤靶向治疗的药物,抗体药物偶联物维布妥昔单抗(brentuximab vedotin)由针对CD30的单克隆抗体[重组嵌合免疫球蛋白G1(immunoglobulin G1,IgG1)]与微管蛋白抑制剂单甲基澳瑞他汀E共价结合组成[4],并于2020年5月正式获得国家药品监督管理局批准用于治疗复发/难治性CHL和ALCL患者。此前多项临床研究[5-6]均显示,结合CD30靶向治疗的免疫治疗和化疗不仅能改善CHL和ALCL患者的预后,还能对其他多种NHL,特别是外周T细胞淋巴瘤亚型治疗的优化发挥重要作用。应用CD30靶向治疗的前提是对肿瘤的CD30表达状态进行评估, CD30的规范化检测及结果判读对于淋巴瘤的精准治疗至关重要。
目前,临床检测CD30表达的主流方法仍是应用石蜡包埋组织的免疫组织化学染色。影响CD30免疫组织化学染色效果的常见技术问题包括抗原修复不足(加热时间太短或温度低)、一抗浓度过低及检测体系灵敏度不够等。Nordi QC[7]于2017年发布的CD30免疫染色评估报告显示,有17%的病理学实验室存在CD30染色不足,表现为着色强度较弱乃至假阴性。针对这些问题,Nordi QC提出了一些改善措施和建议:① 选用优质CD30抗体,Ber-H2、CON6D/5和JCM182这3种抗体均可获得最佳染色效果,其中Ber-H2抗体已为多数病理学实验室所采用;② 抗原修复需在碱性缓冲液或改良的低pH值缓冲液中进行,配合灵敏性、特异性均较好的检测系统;③ 推荐使用扁桃体组织作为外部对照,滤泡生发中心周边活化的大、中淋巴细胞和滤泡间区部分免疫母细胞会出现阳性着色,阳性信号强弱不等,定位于细胞膜或细胞质(伴或不伴核旁高尔基体所在区着色);④ 如果实验室所选用的CD30抗体无法达到最佳染色条件,则需要更换抗体[7]。
如何半定量判读CD30免疫组织化学染色结果,目前尚无统一标准。基于肿瘤细胞的细胞膜或细胞质染色强度(如划分为0~3+共4个等级)与阳性细胞的百分比所设置的半定量评分方法,仍是评估CD30表达水平最理想的方法[8-9]。然而,这种兼顾阳性细胞比例和染色强度的评分方法在日常诊断实践中并不易推广,在不同病理科医师之间乃至同一病理科医师在不同时期的观察结果可重复性都不高。所以,目前国际病理学界更多是推荐在规定阳性强度(指定位精确、明确可辨的阳性着色,如1+以上的阳性着色)的前提下,单纯评估阳性细胞占比的方法。细胞图像分析等计算机辅助图像分析技术能兼顾单个细胞的阳性强度及阳性细胞的比例,有助于对蛋白表达水平进行更精准的量化评估,但技术平台仍有待普及。本规范专家组成员通过多中心临床研究,针对淋巴瘤CD30免疫组织化学规范化检测及结果判读达成诸多技术层面共识,总结如下。
2 淋巴瘤CD30染色条件优化的多中心研究
染色流程的探索主要包括CD30抗体和检测平台的选择及染色流程的优化。研究先使用统一分发的多亚型淋巴瘤标本在本规范专家组成员单位按各自染色条件进行CD30免疫染色(图1),并把染色结果汇总、比对,从中选出最满意的染色方案(最终选定瑞士Roche公司即用型Ber-H2抗体及其Ventana染色平台)。选定染色方案后,进一步优化染色条件,并对比不同染色条件下的染色效果,最终确定标准染色流程。
3 建议进行CD30免疫组织化学检测的淋巴瘤及标本类型
基于CD30在不同类型淋巴瘤中的表达情况及药物治疗的可及性[3,10-12],建议在以下淋巴瘤类型中开展CD30检测:CHL、ALCL、大B细胞性NHL[包括但不局限于弥漫性大B细胞淋巴瘤(非特指性)、原发性纵隔大B细胞淋巴瘤、 EB病毒阳性的弥漫性大B细胞淋巴瘤、灰区淋巴瘤等]、其他外周T细胞及NK细胞淋巴瘤(包括但不局限于非特指性外周T细胞淋巴瘤、血管免疫母细胞性T细胞淋巴瘤、原发性皮肤CD30阳性淋巴组织增生性疾病、结外NK/T细胞淋巴瘤等)。标本类型参照《淋巴组织肿瘤病理诊断规范》[13],包括切除/切取活检标本、直视下或经内镜钳夹标本、空芯针穿刺活检标本、细胞学标本及冷冻切片标本等。无论何种标本,均应保证有足量的肿瘤细胞用于染色评估。

图1 同一标本在A、B、C、D四个中心采用不同条件染色会导致CD30染色结果相差悬殊
Fig. 1 The immunostaining results of CD30 using the same specimen might differ remarkably in four different centers (A, B, C, D) if different staining protocols were employed
4 CD30的免疫组织化学染色
4.1 组织标本前期处理
4.1.1 标本固定
淋巴结或体积较大的组织标本应在新鲜状态下及时切开、固定并石蜡包埋,建议使用4%的甲醛溶液作为固定液,固定时间6 ~48 h。溶液体积应为标本体积的15~20倍。固定操作可在15~25℃的室温下完成。
4.1.2 组织制片
组织切片的厚度要求为2~4 μm,并将组织贴于带有正电荷的载玻片上。制片后应尽快染色(白片存放时间不宜超过30 d),以免组织的抗原性随时间延长而减弱。
4.2 染色流程
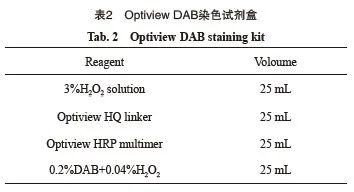
检测试剂包括CD30抗体、Optiview DAB染色试剂盒及Optiview DAB增强染色试剂盒(表1~3),具体参考试剂说明书。检测平台可使用BenchMark GX、XT或Ultra全自动免疫组织化学染色系统。其他还需要:① 清洗缓冲液,组分为Tris缓冲液,规格2 L/瓶,使用前用蒸馏水稀释至20 L,pH值为7.4~7.8;② 组织前处理缓冲液,即CC1修复液,组分为即用型Tris缓冲液,规格2 L/瓶,pH值为8.5;③ 苏木精和返蓝液。
主要染色步骤如下(步骤2~12均在自动免疫组织化学染色仪内完成):
(1)烘烤切片,在65℃烤箱内放置1 h;
(2)用EZ prep脱蜡液脱蜡;
(3)用CC1修复液95℃加热56 min,进行抗原修复;
(4)用3%H2O2溶液在37℃下处理切片4 min;
(5)滴加CD30抗体100 μ L,36℃温育36 min;
(6)滴加Optiview HQ linker,37℃温育8 min;
(7)滴加Optiview HRP multimer,37℃温育8 min;
(8)滴加Optiview amplification H2O2和Optiview Amplifier,37℃温育4 min;
(9)滴加Optiview amplification multimer,37℃温育4 min;
(10)滴加0.2%DAB+0.04%H2O2,37℃显色8 min;
(11)滴加苏木精,37℃温育16 min;
(12)滴加返蓝液,37℃温育16 min;
(13)洗片,脱水,透明,封片。
由于组织固定、处理过程、实验室设备和环境条件的差异,可能需要根据个体样本、所采用的检测试剂及研究者个人习惯的不同而适当增加或减少一抗温育、组织预处理或抗原修复的时 间。


4.3 关于Optiview Amplification系统的说明
本规范所推荐的染色流程是在瑞士Roche公司抗CD30商品化试剂盒说明书基础上进行了优化。研究[7]指出,相当多的实验室可能存在CD30染色缺陷,主要表现为检测系统灵敏度低,染色强度不足,从而导致假阴性。而采用Optiview Amplification系统,能在一定程度上改善检测灵敏度和染色强度,但同时也会带来一些新问题,如阳性信号会出现更多“颗粒状”染色模式,非特异性着色有所增加,因此判读结果时需要予以注意。
4.4 染色质量控制
4.4.1 内部质量控制
固定液选择、固定时间、切片制作及白片储存条件均按照规范(参照4.1节)执行,抗体等试剂选用以及染色流程均按照说明书或上述规范(参照4.2节)执行,切实做好每一批次染色的质量控制。
使用4%的甲醛溶液固定、石蜡包埋的正常扁桃体组织作为外对照质控组织进行平行染色。每次成功的染色,均应见到扁桃体组织中CD30阳性细胞的存在,多表现为数量不等、分布于滤泡生发中心周边或滤泡间区的大、中淋巴细胞,阳性信号定位于这些细胞的细胞膜或细胞质,伴或不伴核旁高尔基体所在区点状着色,阳性细胞的着色强度通常强、中、弱不等。而其他淋巴细胞或间质成分通常为CD30阴性,形状不规则或定位不精确的阳性着色可能是抗体、检测试剂盒或其他因素导致的背景着色,不应视作阳性信号。需要注意的是,由于组织处理条件的不同,外对照组织的成功染色有时也并不能完全排除待测样本假阴性结果的可能。所以,在关注外对照组织染色结果的同时,还应注意观察待测样本中内对照阳性细胞的染色情况(通常会有阳性淋巴细胞存在)。
4.4.2 外部质量控制
实验室每年至少定期参加2次室间质评活动并获得证书。主要通过参加国内权威病理质控中心举办的室间质评活动来完成,也可通过与其他实验室比对验证检测结果。
5 CD30免疫组织化学染色结果的判读方法
靶细胞的细胞膜、细胞质(伴或不伴核旁高尔基体所在区)出现明确且定位精确的棕色着色信号判读为阳性(图2A),无着色或虽有着色但形态或定位存疑者判读为阴性。对于肿瘤细胞普遍高水平表达CD30的淋巴瘤类型(包括绝大部分CHL和ALCL病例),可直接报告“CD30阳性”(即默认100%的肿瘤细胞阳性)。其他类型淋巴瘤的染色结果则推荐半定量判读整张切片中的阳性细胞所占比例。例如,在观察时,可选择若干个(至少20个)有代表性(需注意不可人为挑选“热点”区域计数)的高倍镜视野(推荐使用20倍物镜),分别计算各个视野内阳性肿瘤细胞占所有肿瘤细胞的百分比,并计算整张切片范围内的阳性肿瘤细胞占比的平均值(图2B)。阳性细胞占比推荐以10%为递升,依次为10%、20%、30%、40%、50%、60%、70%、80%、90%和100%,低于10%者设5%和<5%两档。计算阳性细胞占比原则上以整张切片为基准,如阳性细胞分布存在较大区域异质性,亦可备注热点区域数值,如可记成:CD30阳性瘤细胞占30%(热点区约70%)。需要注意的是,在部分淋巴瘤(如部分外周T细胞淋巴瘤亚型或一些富于炎症细胞的大B细胞淋巴瘤等)病例中,要计算肿瘤细胞中的CD30阳性细胞比例往往存在困难,因为在此类病灶中,除肿瘤细胞表达CD30外,还有相当多的反应性淋巴细胞也表达CD30,而我们在免疫组织化学切片上又难以精确区分哪些阳性细胞是肿瘤细胞,哪些是反应性细胞。在这种情形下,我们推荐计算整张切片中的CD30阳性细胞(无论肿瘤细胞抑或反应性淋巴细胞)占所有淋巴样细胞(不包括组织细胞、血管内皮细胞等非淋巴细胞)的百分比,并以此占比来反映病灶CD30的表达水平(图2C)。还有部分淋巴瘤(如结节性淋巴细胞为主型霍奇金淋巴瘤等)病例的CD30阳性细胞均非肿瘤细胞(图2D),对于这种情况我们也需要予以特别注明。

图2 CD30免疫组织化学染色结果判读方法
Fig. 2 Interpretation methods of CD30 immunostaining results
A: Positive signals were evident as distinct brown stains localized to the cell membrane, cytoplasm, with or without a paranuclear Golgi pattern. B: When the tumor cells could be clearly recognized among reactive cells, the ratio of CD30-positive tumor cells to all the tumor cells should be calculated. C: When the tumor cells could not be easily distinguished from reactive cells, the ratio of all CD30-positive cells to all lymphoid cells was recommended. D: The situation of merely some reactive cells baring CD30 expression should be specified as well.
在传统的病理学诊断实践中,CD30阳性与否往往只作定性判断,而不描述其表达水平。对于高表达CD30的肿瘤(如CHL或ALCL),这种定性判断固然有其合理性,但对于表达水平存在较大变异的NHL患者而言,半定量化描述肿瘤组织中CD30的表达水平可能更有利于临床医师作出是否使用靶向治疗药物的决策。本规范专家组成员单位在统一免疫组织化学染色和结果判读方案后,进行了多中心染色结果对照研究和一致性验证,发现染色和判读结果高度一致(图3),表明上述方案具有较好的可操作性和可重复性。
图3 在统一免疫组织化学染色和结果判读方案后,多中心CD30染色结果与专家判读高度一致
Fig. 3 Improved consistency of CD30 staining results and interpretation by pathologists from multiple centers were achieved when a standardized protocol was adopted
6 总结
淋巴瘤CD30表达的半定量检测,是临床治疗方法进步对病理学诊断提出的新要求,也体现了肿瘤规范化和个体化诊治的总体趋势。本研究在结合文献报道[14]及前期多中心研究结果的基础之上提出了淋巴瘤CD30免疫组织化学检测及结果判读规范,希望能对国内外CD30的规范化检测有所帮助。需要特别指出的是,CD30免疫组织化学染色方案存在多样性和可及性问题,其他试剂或染色条件能否达到甚至优于本规范所推荐的方案,还需要后续研究进一步验证。此外,淋巴瘤CD30的表达可能还存在时间和空间异质性问题,单次、单病灶的免疫组织化学检测本身可能存在一定的技术缺陷。本规范有待通过后续研究和临床实践进一步完善。
利益冲突声明:所有作者均声明不存在利益冲突。
[参考文献]
[1] SABATTINI E, PIZZI M, TABANELLI V, et al. CD30 expression in peripheral T-cell lymphomas[J] . Haematologica, 2013, 98(8): e81-e82.
[2] WANG G N, ZHAO W G, LI L, et al. Prognostic significance of CD30 expression in nasal natural killer/T-cell lymphoma[J]. Oncol Lett, 2017, 13(3): 1211-1215.
[3] HU S M, XU-MONETTE Z Y, BALASUBRAMANYAM A, et al. CD30 expression defines a novel subgroup of diffuse large B-cell lymphoma with favorable prognosis and distinct gene expression signature: a report from the international DLBCL rituximab-CHOP consortium program study[J]. Blood, 2013, 121(14): 2715-2724.
[4] FRANCISCO J A, CERVENY C G, MEYER D L, et al. cAC10- vcMMAE, an anti-CD30-monomethyl auristatin E conjugate with potent and selective antitumor activity[J]. Blood, 2003, 102(4): 1458-1465.
[5] PRO B, ADVANI R, BRICE P, et al. Brentuximab vedotin (SGN-35) in patients with relapsed or refractory systemic anaplastic large-cell lymphoma: results of a phase Ⅱ study[J]. J Clin Oncol, 2012, 30(18): 2190-2196.
[6] YOUNES A, GOPAL A K, SMITH S E, et al. Results of a pivotal phase Ⅱ study of brentuximab vedotin for patients with relapsed or refractory Hodgkin’s lymphoma[J]. J Clin Oncol, 2012, 30(18): 2183-2189.
[7] NORDI Q C. Control N-IQ. CD30[M]. 2017.
[8] LI B, ESCHRICH S A, BERGLUND A, et al. Use of the total cancer care system to enrich screening for CD30-positive solid tumors for patient enrollment into a brentuximab vedotin clinical trial: a pilot study to evaluate feasibility[J]. JMIR Res Protoc, 2017, 6(3): e45.
[9] HIRSCH F R, VARELLA-GARCIA M, BUNN P A Jr, et al. Epidermal growth factor receptor in non-small cell lung carcinomas: correlation between gene copy number and protein expression and impact on prognosis[J]. J Clin Oncol, 2003, 21(20): 3798-3807.
[10] KIM H K, MOON S M, MOON J H, et al. Complete remission in CD30-positive refractory extranodal NK/T-cell lymphoma with brentuximab vedotin[J]. Blood Res, 2015, 50(4): 254-256.
[11] PRINCE H M. CD30 As a target for the treatment of cutaneous T-cell lymphoma[J]. J Clin Oncol, 2015, 33(32): 3691-3696.
[12] XU M L, GABALI A, HSI E D, et al. Practical approaches on CD30 detection and reporting in lymphoma diagnosis[J]. Am J Surg Pathol, 2020, 44(2): e1-e14.
[13] 《淋巴瘤病理诊断规范》项目组. 淋巴组织肿瘤病理诊断规范[J]. 中华病理学杂志, 2019, 48(5): 346-349.
The Project Team of Standardization for Diagnosis Tumor Pathology of Lymphomas. Standardization for diagnosis tumor pathology of lymphomas[J]. Chin J Pathol, 2019, 48(5): 346-349.
[14] 李小秋, CD30阳性淋巴瘤病理专家组. CD30在淋巴瘤中的表达及检测:现状与挑战[J]. 中国癌症杂志, 2022, 32(6): 512-518.
LI X Q, CD30 Positive Lymphoma Pathology Expert Group. Detection of CD30 expression in lymphomas: status and challenges[J]. China Oncol, 2022, 32(6): 512-518.


