Blood Adv:当代三药/四药诱导下原发难治多发性骨髓瘤的预后:梅奥千例回顾性研究
时间:2023-09-17 20:05:27 热度:37.1℃ 作者:网络
原发难治多发性骨髓瘤
多发性骨髓瘤(MM)的诱导治疗一般包括三类不同药物,即蛋白酶体抑制剂(PI)、免疫调节剂(IMiD)和单克隆抗体(mAb),然后联合或不联合自体造血干细胞移植(ASCT)和维持治疗直至进展,该疗法大幅提高了MM患者的无进展生存期(PFS)和总生存期(OS)。
MM的当前风险分层系统集中于细胞遗传学(FISH)和肿瘤-宿主相互作用的相关因素(例如β2M和IDH),以识别预后较差的患者。但有一部分患者初始治疗无缓解(原发难治),即使没有传统的高危因素也预后非常差。然而,在新药联合时代或一线使用mAb的时代,尚无研究评估原发难治性疾病对于生存的影响。
梅奥诊所Shaji K. Kumar教授牵头一项回顾性研究,旨在探索MM标准诱导治疗下实现血液学缓解的意义、原发难治性疾病对 PFS 和 OS 的影响,及挽救化疗对后续生存结局的影响。研究结果近日发表于《Blood Advances》。

要点
1、随着现代疗法的使用,原发难治性疾病的发生率有所下降,但它仍是生存期缩短的显著风险因素。
2、挽救性自体移植可能是这些患者获益最大的选择。
研究结果
作者回顾性分析了梅奥诊所2017-2019期间使用三药或四药诱导方案的连续MM患者共1127例,诊断时的中位年龄为62.6岁(257例 [22.8%] 年龄大于70岁,22例 [2%] 年龄大于80岁),队列中62%(N=699) 为男性。ISS 分期方面,Ⅰ期382例 (37.7%),Ⅱ期365例 (36%),Ⅲ期267例 (26.3%);R-ISS Ⅰ、Ⅱ、Ⅲ期分别为246例 (25.9%)、571例 (60%)、134例 (14.1%)。只有1.7%的患者同时有淀粉样变性的证据。大多数患者(932例患者 [82.7%])接受硼替佐米-来那度胺-地塞米松 (VRd) 作为诱导治疗,其中718例(23%缺失)患者有可用的治疗计划(64.1%为硼替佐米每周给药,33.1%每两周给药,每月2.5%给药),其次为卡非佐米-Rd(KRd;8.3%)、四联方案(PI/IMiD基石加mAb;7.2%)和其他治疗方案(例如elotuzumab-Rd;1.8%)。677例 (61.3%) 患者接受了一线ASCT,队列的其余部分未接受 ASCT 或将其作为挽救治疗。原发难治患者与队列其余患者的干细胞产量(CD34+ 细胞)和尝试次数无统计学显著差异。FISH 分层方面,562例 (54.4%) 患者无高危特征,355例 (34.4%) 有1个初始浆细胞克隆异常,116例 (11.2%) 有≥2个异常。BM中克隆性浆细胞的中位百分比为50%。与初始缓解者相比,原发难治患者更有可能具有传统的高危特征(FISH、mSMART和R-ISS)。表1总结并比较了诱导时缓解可评估患者 (n=1086) 的基线人口统计学和临床特征。
诱导治疗4或6个周期后评估治疗的初始反应,1086例 (96.3%) 患者的缓解评估信息可用。其中1013例 (93.3%) 达到≥轻微缓解 (MR),304例 (28%) 达到部分缓解 (PR),61.9%(672) 达到>VGPR;73例 (6.7%) 患者在初始诱导周期内达到 SD 或PD。图1中的条形图显示了基于不同诱导方案达到的缓解;接受四联和三联治疗的患者之间基线疾病特征无统计学显著差异;评估时所有联合方案的 VGPR/CR 率均> 60%,更具体地说,尽管不同方案达到的缓解之间未见统计学显著差异,但接受四联治疗的患者的 VGPR/CR 率最高(66.7% vs KRd组为63.7%,VRd组为60.9%),且原发难治率最低(2.5% vs KRd组为4.4%,VRd组为7.4%)。

整个队列的生存结局和多变量分析
整个队列的估计中位随访持续时间为68.1个月,中位 PFS 为38.9个月,中位估计 OS 为135.5个月。
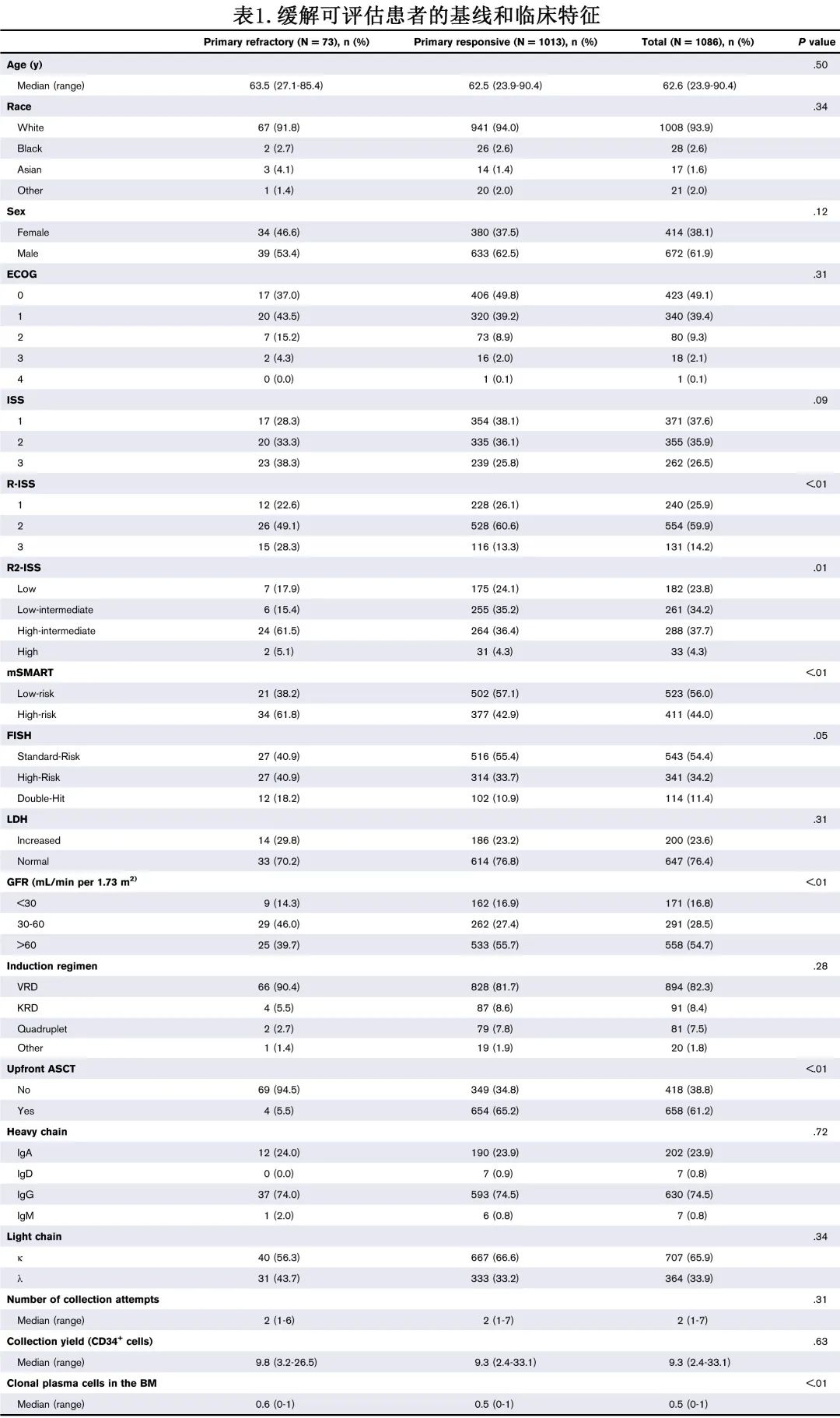
基于4个或6个诱导周期后的血液学缓解情况比较PFS 和OS,发现与诱导时≥MR的患者相比,原发难治患者的 PFS(4.2个月vs MR、PR和 VGPR/CR 分别为9.7、32.6和50.8个月;P<0.01)和OS(51.3个月vs 141.8、150.7和135.5个月;P<0.01;图2A-B)均显著缩短。
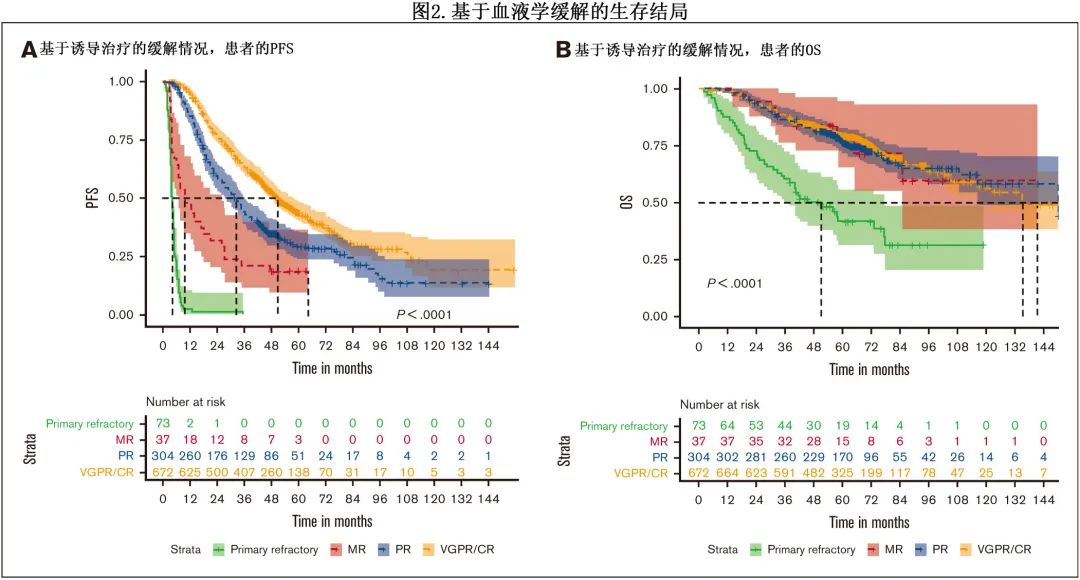
为了避免可获得4-6个周期随访的患者潜在的永生时间偏倚(immortal time bias),对6个月时的 OS 进行了里程碑分析(landmark analysis),结果原发难治患者的 OS 仍显著短于初始治疗有效的患者(分别为50.3 vs 135.8个月;P<0.01;图3)。
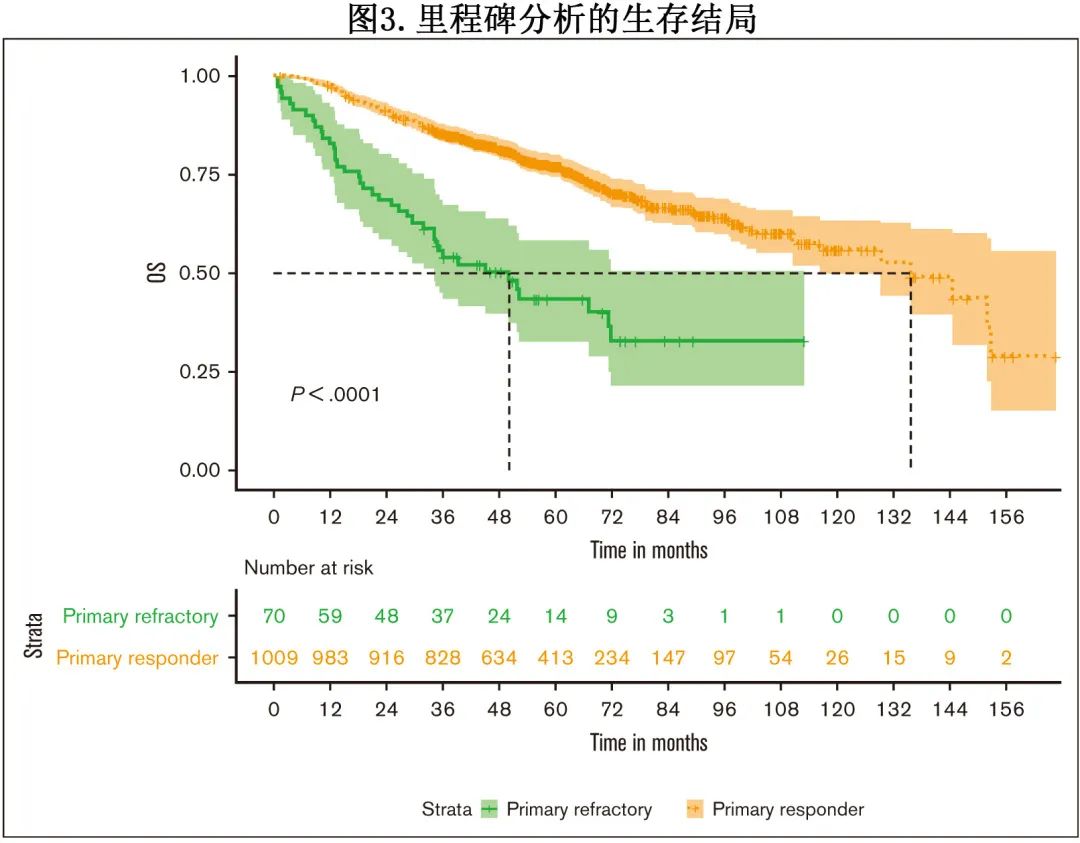
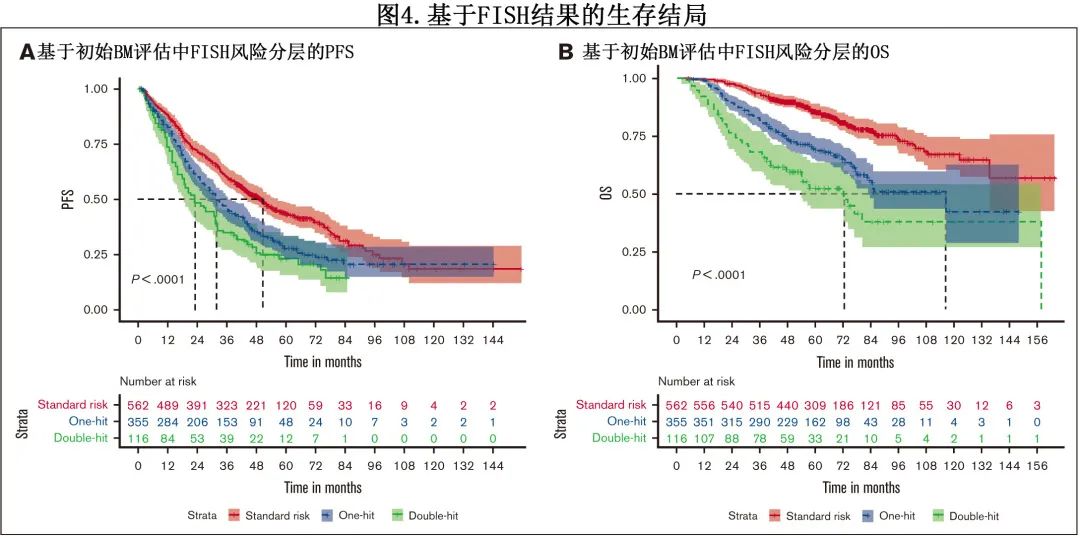
然后比较了原发难治患者和早期复发患者(诊断后18个月内),发现两组的中位 OS 几乎相同,表明其疾病生物学相似(分别为51.3个月vs 48.2个月)。FISH结果方面,双打击 MM 患者的 PFS 显著短于1种高危异常或标危患者(分别为23.1个月vs 31.7个月vs 50.8个月;P<0.01);OS中也观察到多发细胞遗传学异常的不利影响,中位 OS 分别为72.5个月vs 116.6个月和未达到;P<0.01;图4A-B)。
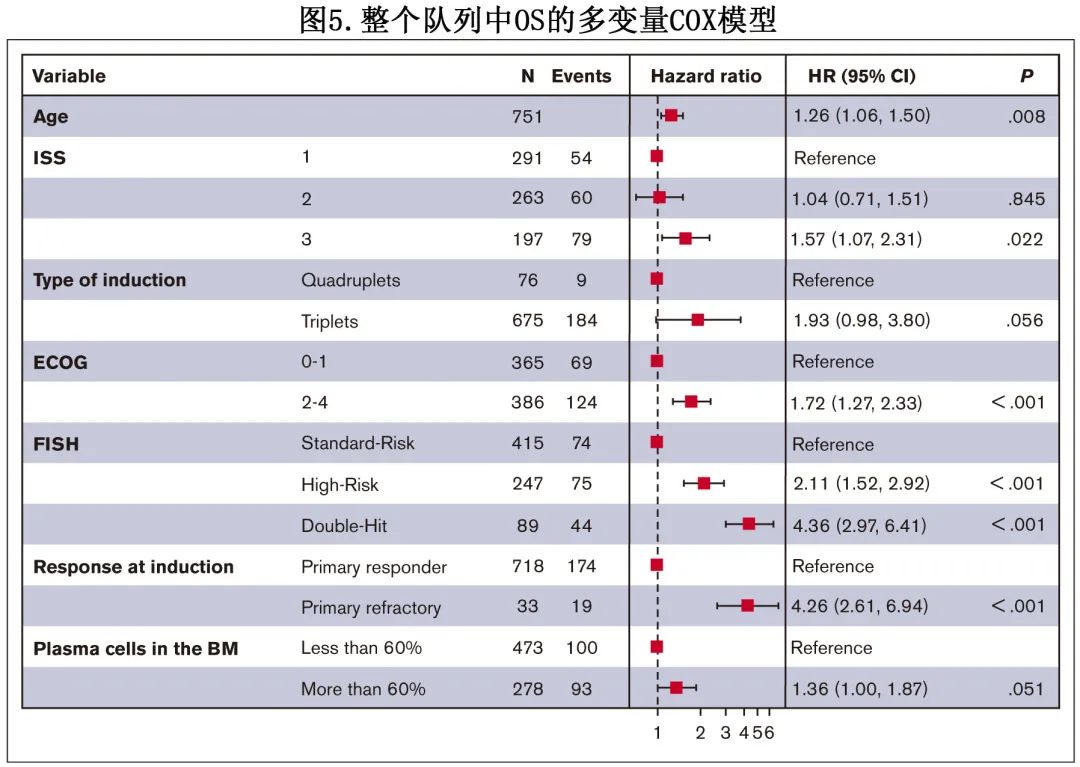
为确定整个队列中与不良 OS相关的因素,进行了单变量和多变量分析。在单变量分析中,原发难治患者OS 缩短的风险增加 (HR=3.5)。多变量模型中包括单变量分析中的其他显著因素,发现年龄(10年间隔)(HR=1.3) 、ISS 3期 (HR=1.6) 、ECOG PS状态 (HR=1.7) 、单打击和双打击高危FISH(分别为HR=2.1和HR=4.4)、原发难治性疾病(HR=4.3)与生存期缩短独立相关(图5)。
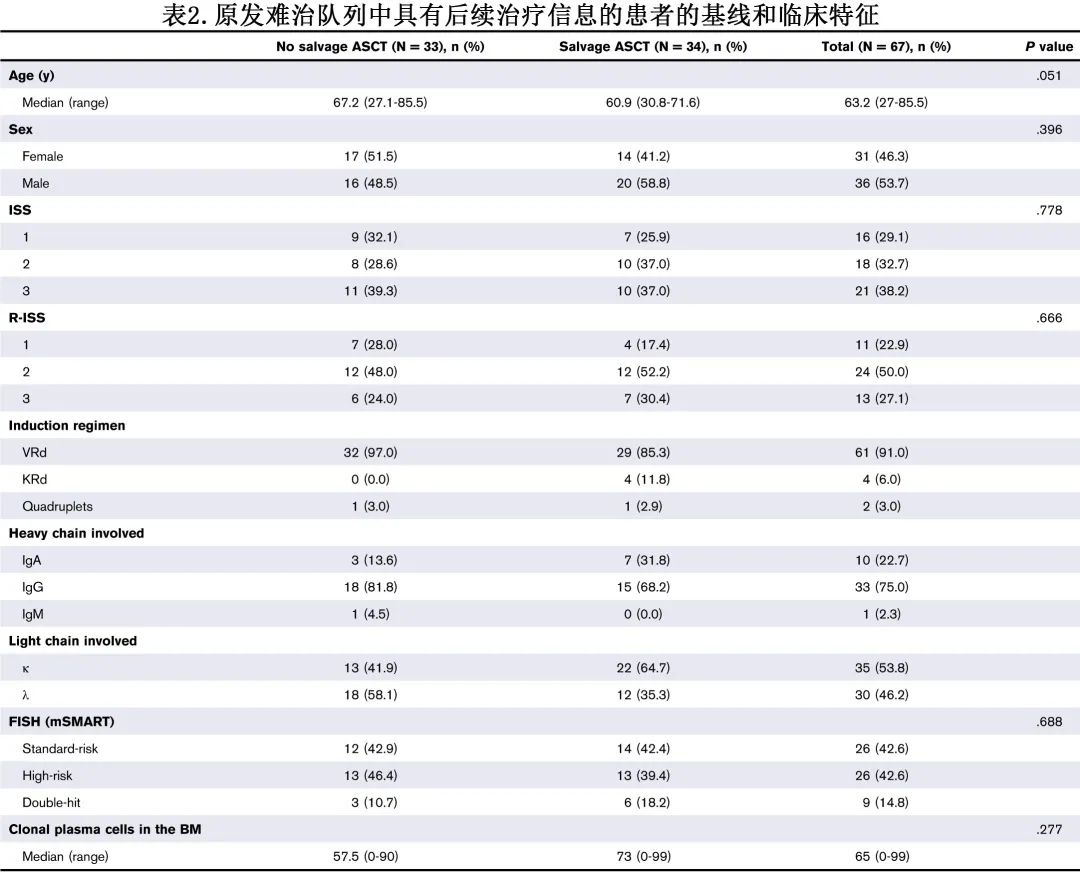
原发难治队列的临床结局和挽救治疗
在仅有原发难治患者的亚组分析中,5例患者未接受挽救治疗并在首次进展后4个月内死亡,1例患者无后线治疗信息,剩余67例患者具有后续治疗信息。首次复发后的中位第二次 PFS 和第二次 OS 分别为11.9个月和45.1个月。临床难治24例,生化难治49例。尽管临床 PD 患者的第二次PFS(分别为5.4个月和12.1个月)和第二次OS(分别为21.7个月和48.3个月)在数值上更短,但未达到统计学显著性,可能是由于患者数量较少。
在已知后续治疗的患者中,33例 (49.3%) 接受挽救性化疗和 ASCT 作为二线治疗,而23例 (34.2%) 接受达雷妥尤单抗作为二线治疗的一部分。对于接受挽救性 ASCT 的患者,与未接受挽救性 ASCT 的患者相比,基线和临床特征无统计学显著差异,但中位年龄分别为60.9 vs 67.2岁(P=0.51;表2)。
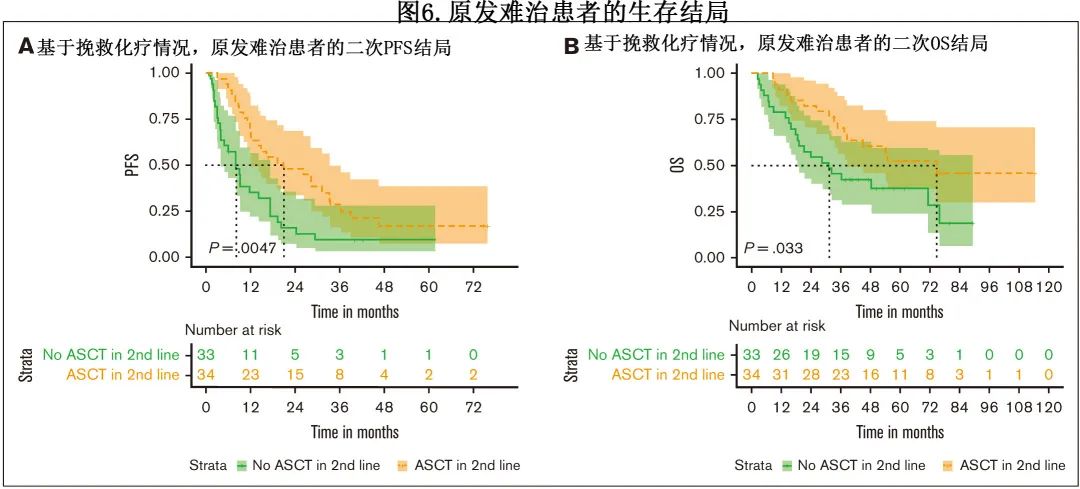
接受二线 ASCT 的患者与未接受ASCT的患者相比,第二次 PFS(分别为20.9个月和8.1个月;P<0.01)和第二次OS(分别为74.7 vs 31.3个月;P=0.02)均有所延长(图6A-B)。
尽管患者数量较少 (25 vs 13),但通过年轻患者(65岁)的亚组分析同样显示了二线 ASCT 的获益,中位 PFS 为15.5个月,中位 OS 为74.7个月,而未ASCT患者分别为4.1个月和48.3个月。与未接受达雷妥尤单抗作为二线治疗的患者相比,接受达雷妥尤单抗作为二线治疗的患者无任何显著生存差异。此外2007年至2014年间原发难治患者与2015年至2019年接受治疗的患者的 PFS 和 OS 无统计学显著差异。
总结
初始治疗无效的多发性骨髓瘤患者的结局比初始缓解者更差,该人群缺乏有效的治疗方法,但当前治疗时代原发难治性疾病的转归尚未研究。作者审查了在梅奥诊所接受三药/四药诱导治疗的 MM 患者,以评估原发难治性疾病的发生率和挽救治疗在该人群中的影响。1086例MM患者在4-6个周期后评价血液学缓解,其中93.3%(1013例)缓解,而6.7%(73例)为原发难治性疾病。在单变量和多变量分析中,原发难治患者的中位总生存期为51.3个月,生存期缩短的风险增加(风险比分别为3.5和4.3)。在原发难治患者的亚组分析中,接受二线自体干细胞移植患者与未移植患者相比,第二次无进展生存期(20.9 vs 8.1个月;P<0.01)和第二次总生存期(74.7 vs 31.3个月;P=0.02)均延长。
作者认为,在当今时代,早期进展仍是PFS和OS缩短的显著因素,即使校正常见高危因素后仍是如此,而挽救性 ASCT 可能是该人群获益最大的选择。
参考文献
Charalampous C,et al. Outcomes of patients with primary refractory multiple myeloma in the era of triplet and quadruplet induction therapy.Blood Adv . 2023 Aug 22;7(16):4371-4380. doi: 10.1182/bloodadvances.2023009681


