慢性阻塞性肺病 (COPD) 的缺氧驱动理论……被揭穿了!
时间:2023-09-30 11:10:06 热度:37.1℃ 作者:网络
缺氧驱动理论是呼吸医学中最有趣但最不为人所知的临床理论之一。该理论认为,长期滞留二氧化碳的人会失去高碳酸状态下的呼吸动力。因此,根据该理论,由于大脑不再对高碳酸血症有反应,唯一剩下的自主神经驱动是低氧血症。因此,在这种情况下,如果给病人补充足够的氧气,使他们的 PaO2 水平远高于 60 mm Hg,他们也会失去低氧血症的呼吸动力。
这一理论不时受到质疑,质疑的主要依据是临床观察,即表现出典型动脉血气 (ABG) 提示二氧化碳潴留的患者不会在 PaO2 水平升高时简单地停止呼吸。
我们都曾在某个时候听过这样的话:“不要给慢性阻塞性肺病患者供氧”。这让我们相信,对于慢性阻塞性肺病 (COPD) 患者来说,吸氧确实是一件坏事。这导致医疗保健专业人员不敢向氧饱和度低的慢性阻塞性肺病患者提供氧气;是的,即使是严重缺氧的患者!为什么人们如此害怕氧气和慢性阻塞性肺病这两个词出现在同一个句子中?因为一个流传甚广的小神话让人们相信氧气会“消除”缺氧驱动……
让我们从呼吸生理学开始
中枢化学感受器存在于脑脊液 (CSF) 中,对 pH 值变化敏感。pH 值的变化可能是由于体内二氧化碳 (CO 2 )水平的变化而发生的。当体内CO 2水平增加(高碳酸血症)时,CO 2会与脑脊液内的水(H 2 O)结合,转化为碳酸(H 2 CO 3),进而释放出氢离子(H + ) 降低 pH 值。当体内CO 2水平降低(低碳酸血症)时,氢离子会与碳酸氢根离子(HCO 3 –)结合并转化为碳酸,然后转化为CO2。 这种平衡是通过呼吸中枢建立呼吸频率来维持的,该呼吸频率将 CO 2维持在 35 – 45 mmHg 的正常范围内,并将 pH 值维持在 7.35 – 7.45 的正常范围内。
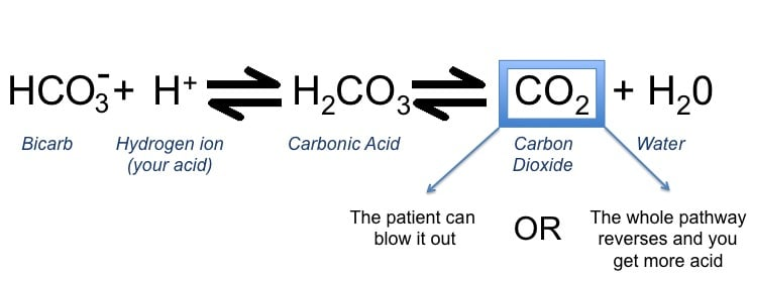
当呼吸中枢意识到中枢化学感受器的 pH 值下降时,它会刺激膈肌,导致人呼吸。呼吸系统在主动脉弓和颈动脉分叉处也有外周化学感受器。与中枢化学感受器类似,外周化学感受器可以对 pH 值降低做出反应。然而,它的主要备用目的是当呼吸中枢意识到 PaO 2低于 60 mmHg(大约与 90% 的氧饱和度相关)时被激活。这反过来又会刺激隔膜,使人呼吸。这个小而漂亮的备份系统被称为我们的缺氧驱动器;是的,我们都有一个!
慢性阻塞性肺病患者的呼吸生理学
对于长期CO 2水平较高的人,例如CO 2潴留的COPD 患者,涉及中枢化学感受器的正常呼吸机制会导致不必要的高呼吸频率。随着碳酸氢根离子增加与氢离子结合以达到正常范围内的 pH 水平,身体逐渐开始对 CO 2进行进行性通气脱敏。这称为代谢补偿。
这里有两点需要注意:
-
从技术上讲,是氢离子降低了血液 pH 值,而不是二氧化碳独立触发了呼吸
-
一旦发生代谢代偿并且 pH 值恢复正常,中枢化学感受器就会停止感知呼吸的需要,但这并不意味着 pH 值不能改变患者的“新常态”
尽管血液中的CO 2含量较高,但随着时间的推移,pH 值会趋于正常化,因此身体开始利用其缺氧驱动力作为触发患者呼吸的主要系统。因此,现在低 PaO 2将刺激呼吸。
这给我们带来了更重要的两点:
-
是的,COPD 患者呼吸的主要动力来自继发于低 PaO 2的外周化学感受器的刺激
-
不,这并不意味着在 pH 值比“新常态”更酸的情况下,中枢化学感受器不能受到刺激
缺氧驱动理论
所以缺氧驱动理论如下:如果你给CO2 潴留者太多的氧气,他们的PaO2就会增加,你就会破坏他们的缺氧驱动呼吸,从而导致呼吸暂停。
正是这一理论让我与一名COPD患者打了医疗应急电话,该患者的氧气饱和度为75%,通过鼻导管吸入2升/分钟的氧气,因为“他们是二氧化碳潴留患者,我不想给他们太多氧气”。想知道我到达后要做的第一件事吗?我给这位慢性阻塞性肺病患者戴上普通面罩,氧饱和度为 75%,然后将氧气流量调高、调高、调高;直到我的氧饱和度达到 88 – 92%,然后我降低氧气流量以维持患者的氧饱和度。
如果读完本文后您只记得一件事,那就是:患者在死于呼吸暂停之前会死于缺氧!
揭穿缺氧驱动理论的神话
好的,我们给 COPD 患者吸氧,他们的 PaO 2就会上升。这是他们体内将发生的一系列事件:
-
由于外周化学感受器的PaO 2不会较低,因此它们不会触发呼吸的需要。
-
由于患者没有触发呼吸,他们的 CO 2将开始上升
-
随着 CO 2开始上升,氢离子也会增加,从而导致 pH 值下降
-
pH 值的下降将再次导致中枢和外周化学感受器启动,从而再次刺激患者呼吸
-
这将使它们的 CO 2水平回落,以达到通过代谢系统很好地补偿回到正常范围的 pH 值
因此,“消除”COPD患者的缺氧驱动力不会“消除”他们的呼吸驱动力,因为他们的中枢化学受体会在某个时候发挥作用。因此,缺氧驱动理论被揭穿了!
临床实践中的缺氧驱动
考虑一下这样的场景:一名 COPD 患者到达急诊室时呼吸频率为 45 bpm,呼吸室内空气时氧饱和度为 70%。进行动脉血气分析,结果显示 PaO 2为 44 mmHg,PaCO 2为 66 mmHg,pH 为 7.35。值班护士通过面罩为患者提供 10 升/分钟的氧气,几分钟后,患者的呼吸频率为 26 bpm,呼吸费力明显减轻。另一项动脉血气显示 PaO 2为 90 mmHg,PaCO 2为 80 mmHg,pH 为 7.25。
我们是否削弱了病人的呼吸动力?或者我们是否足以缓解缺氧,使患者恢复正常的呼吸模式?但是CO 2的增加又如何呢?
因此,增加氧气会减慢呼吸速度?......
COPD患者由于其疾病的性质,往往具有慢性升高的二氧化碳水平。该理论认为,由于化疗受体中二氧化碳水平的长期升高,对这些高水平变得耐受,因此二氧化碳不再是该人的呼吸动力。因此,驱使他们呼吸的是缺氧驱动,或较低水平的氧气。
缺氧驱动理论接着说,如果你给这些病人太多的氧气,你就削弱了他们的缺氧驱动。由于他们的化疗受体已经耐受高水平的二氧化碳,因此他们也失去了这种动力,他们的呼吸将开始减慢,导致二氧化碳水平进一步升高,并导致酸中毒。
Aubier及其同事证明,呼吸驱动的减少并不是COPD急性加重患者氧诱导的高碳酸血症的主要原因。
对于 COPD 患者的这种现象有两种解释:VQ 不匹配和霍尔丹效应
VQ 不匹配
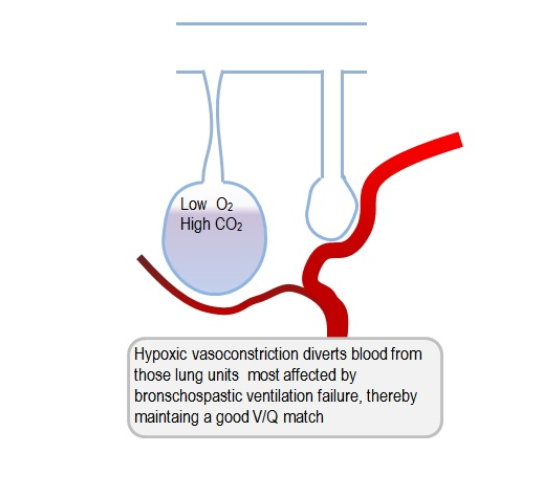
身体非常聪明地试图让我们活下去!因此,对于某些肺泡可能无法通气的慢性阻塞性肺病患者,身体通过肺血管系统的缺氧血管收缩将血液引导至功能良好的肺泡来克服这一问题。因此,V/Q 匹配得到增强,气体交换得到优化。为这些患者提供氧气可以克服观察到的缺氧血管收缩,并且流向通气不良的肺泡的血流量增加,从而导致患者的 V/Q 不匹配。结果,气体交换受到损害,影响 PaO2 和二氧化碳。
霍尔丹效应
霍尔丹效应与玻尔效应相反。玻尔效应告诉我们,血液中二氧化碳和氢离子的浓度会影响血红蛋白对氧的亲和力。它增加运动组织可以吸收的氧气量。此外,它还增加了血液从肺泡吸收的氧气量。
霍尔丹效应有利于通过氧气压力的变化来卸载或装载二氧化碳。这意味着氧气压力的变化有助于装载或卸载二氧化碳。肺部的氧气压力很高。因此,它有助于释放二氧化碳。在组织中,氧气压力很低,可以吸收二氧化碳。这就是所谓的霍尔丹效应。
组织产生二氧化碳并排出。二氧化碳进来并加载。大多数二氧化碳变成 HCO3 离子,并以碳酸氢盐的形式转移到肺部。这是玻尔效应的逆过程。
反应: CO 2 + H 2 O <=> H + + HCO 3 –
霍尔丹效应是血红蛋白的一种特性,其中二氧化碳 (CO2) 浓度的增加将取代血红蛋白 (Hb) 中的氧气,而氧气与血红蛋白的结合又会取代血液中的二氧化碳。换句话说,血液的脱氧增加了其携带二氧化碳的能力。相反,含氧血液的二氧化碳容量降低。
因此,如果你通过给血液补充氧气来增加血液中的氧,那么通过霍尔丹效应,二氧化碳分子将被置换为氧气。
这会导致血液中二氧化碳的增加或PaCO2升高。二氧化碳的升高通常通过增加每分钟通气排出体外,但慢性COPD患者不能增加每分钟通气量。
在无法增加分钟通气量的严重慢性阻塞性肺病患者中,霍尔丹效应约占通气导致的 PaCO2 增加总量的 25%。
脱氧血红蛋白比含氧血红蛋白对二氧化碳的亲和力更强。因此,当我们的患者到达急诊室时,氧饱和度为 70%,PaCO 2为 66 mmHg,脱氧血红蛋白可能保留了相当数量的二氧化碳,而这些二氧化碳不会出现在动脉血气中。
当含氧血红蛋白释放出它们在脱氧状态下所持有的二氧化碳时,就会发生霍尔丹效应,导致 PaCO 2升高。如果患者此时呼吸肌没有疲劳,无论是否缺氧,他们的中枢化学感受器都会感觉到二氧化碳水平上升到患者正常参数之外,并会增加呼吸频率以清除额外的二氧化碳。如果霍尔丹效应导致二氧化碳持续较高且 pH 值较低,我们需要警惕即将发生的 2 型呼吸衰竭,并准备好我们的非侵入性或插管设备。
慢性阻塞性肺病患者缺氧的处理
只要维持氧合和循环,就有可能在严重的呼吸性酸中毒中存活下来,并且不会产生不良后果。没有呼吸的患者的问题在于他们没有吸氧。
请记住:患者在死于呼吸暂停之前会先死于缺氧!
因此,当有疑问时,氧气是个好人!但就像生活中的一切一样,一切都要适度!目前治疗 COPD 急性加重的证据是将氧疗滴定至氧饱和度在 88-92% 之间。这很可能是由于我们长期以来对低氧驱动的信念以及 2010 年对 405 名患者进行的一项小型研究表明,与接受高流量非滴定氧气的患者相比,将氧气滴定至氧气饱和度的患者死亡率较低,为88–92%。这进一步巩固了给COPD患者输氧是不好的观点。然而,给任何患者提供高流量的非滴定氧气都是不好的!
高流量非滴定氧疗慢性阻塞性肺病组死亡率的增加可能仅仅归因于观察到的氧中毒的有害影响。氧中毒与各种临床后果相关,包括肺容量减少、吸收性肺不张引起的低氧血症、高碳酸血症加剧以及气道和肺实质损伤。在我们有进一步的证据表明 COPD 患者较高的饱和度水平无害之前,目标是 88-92%。
最重要的是:如果您的患者缺氧,请调高氧气!让它们达到 88 – 92% 的可接受范围,然后将氧气减少到尽可能低的流量以维持此范围。唯一一次看到 CO 2潴留患者因氧气增加而失去呼吸动力时,是当有人呼吸困难、精疲力尽、呼吸肌疲劳到无法呼吸的程度时。没有进一步的能力吹掉多余的CO 2。但猜猜怎么了?这被称为 2 型呼吸衰竭,“正常”患者在相同情况下也会有类似的结果!
我们不要再让我们可怜的慢性阻塞性肺病患者处于缺氧状态了;缺氧理论被揭穿了!
References
Austin, M. A., Willis, K. E., Blizzard, L., Walters, E. H., & Wood-Baker, R. (2010). Effect of high flow oxygen on mortality in chronic obstructive pulmonary disease patients in prehospital setting: Randomised controlled trial. The British Medical Journal, 341(c5462), 1-8. doi: 10.1136/bmj.c5462
Abdo, W. F., & Heunks, L. M. (2012). Oxygen-induced hypercapnia in COPD: Myths and facts. The Journal of Critical Care, 16(5), 323 – 327. doi: 10.1186/cc11475
Feller-Kopman, D. J., & Schwartzstein, R. M. (2019). Mechanism, causes and effects of hypercapnia. Retrieved from: https://www.uptodate.com/contents/mechanisms-causes-and-effects-of-hypercapnia
Johnson, D. C. (2019). Control of ventilation. Retrieved from: https://www.uptodate.com/contents/control-of-ventilation
Life in the Fast Lane. (2019). Oxygen and CO2 retention in COPD. Retrieved from: https://litfl.com/oxygen-and-carbon-dioxide-retention-in-copd/
Malhotra, A., Schwartz, D. R., & Schwartzstein, R. M. (2020). Pulmonary consequences of supplemental oxygen. Retrieved from: https://www.uptodate.com/contents/pulmonary-consequences-of-supplemental-oxygen
Stoller, J. K., Barnes, P. J., & Hollingsworth, H. (2019). Management of exacerbations of chronic obstructive pulmonary disease. Retrieved from: https://www.uptodate.com/contents/management-of-exacerbations-of-chronic-obstructive-pulmonary-disease


