病理干货 | 子宫内膜癌全面进入分子分型时代
时间:2023-10-31 20:37:28 热度:37.1℃ 作者:网络
01 子宫内膜癌简介
子宫内膜癌是常见的妇科恶性肿瘤之一,发病率逐年上升。2020年中国子宫内膜癌新发病例81 964例,死亡病例16 607例 [1] [2]。风险因素包括高体重指数(body mass index,BMI)、糖尿病、代谢综合征、雌激素治疗、不孕、初潮早、绝经晚、林奇综合征、Cowden综合征、聚合酶校正相关息肉综合征(polymerase proofreading- associated polyposis,PPAP)等 [3] [4]。90%以上的子宫内膜癌患者发病年龄超过50岁,中位诊断年龄为63岁 [3];4%的患者诊断时小于40岁 [5],部分患者有保留生育功能的意愿。80%的子宫内膜癌患者诊断时为早期,肿瘤局限在子宫体内,其5年生存率大于95% [3],如有局部扩散或远处转移,则5年生存率分别降至68%或17% [6]。
02 分子分型的趋势
-
1983年Bokhman [5]依据临床病理学特征和预后将子宫内膜癌分为两种类型:Ⅰ型为雌激素依赖型,与肥胖、高血脂、雌激素水平升高相关,包含1~2级的子宫内膜样癌,发现时多为早期,通常预后较好 [7];Ⅱ型为非雌激素依赖型,包含3级的子宫内膜样癌和非子宫内膜样肿瘤(如浆液性癌和透明细胞癌) [8],发现时偏晚期,预后较差 [9]。但由于Bokhman分型过于简单Ⅰ和Ⅱ型定义标准相对模糊、对患者复发风险分层不够精确等原因,在指导后续治疗选择上的作用非常有限,无法有效地指导临床实践 [10]。
-
2013年,癌症基因组图谱(TCGA)多组学研究[10]全面揭示了子宫内膜癌的分子遗传图谱,提出新的分子分型策略,依据多组学特征和预后的关联性分为4个亚型:POLE、MSI、CNH和CNL,用于患者预后和复发风险评估。后来由于临床实现难度大,后被简化成ProMisE分型 [11]与Tans-PORTEC分型 [12]。由于该分型贴合临床实践,简单易操作,于是分子分型开始用于指导临床辅助治疗的选择。
-
2020年,分子分型被纳入美国国立综合癌症网络(NCCN)指南和世界卫生组织(WHO)女性生殖器官肿瘤分类标准(第5版)中。
-
2021年,基于分子分型的风险评估规则被纳入欧洲妇科肿瘤协会(ESGO)指南中[13]。
-
2021年,中国抗癌协会妇科肿瘤专业委员会与中华医学会病理学分会、国家病理质控中心先后发布了《子宫内膜癌诊断与治疗指南(2021年版)》、《子宫内膜癌分子检测中国专家共识(2021年版)》。至此,我国也正式进入到子宫内膜癌的分子时代。
03 子宫内膜癌分类
2020年世界卫生组织(WHO)对子宫内膜癌病理学类型进行了修订,并整合了子宫内膜癌的分子分型。
3.1.子宫内膜癌主要病理学类型
1) 子宫内膜样癌(endometrioid carcinoma)非特指型(non otherwise-specified,NOS):POLE超突变型内膜样癌(POLE-ultramutated endometrioid carcinoma)、错配修复缺陷型内膜样癌(mismatch repair-deficient endometrioid carcinoma)、p53突变型内膜样癌(p53-mutated endometrioid carcinoma)、无特异性分子谱的内膜样癌(no-specific molecular profile endometrioid carcinoma)。
2) 浆液性癌非特指型(serous carcinoma NOS)。
3) 透明细胞癌非特指型(clear cell carcinoma NOS)。
4) 未分化癌非特指型(carcinoma,undifferentiated,NOS)。
5) 混合细胞癌(mixed cell carcinoma)。
6) 中肾腺癌(mesonephric adenocarcinoma)。
7) 鳞状细胞癌非特指型(squamous cell carcinoma NOS)。
8) 黏液性癌,肠型(mucinous carcinoma,intestinal type)。
9) 癌肉瘤非特指型(carcinoma NOS)。
3.2. 子宫内膜癌分子分型
根据WHO女性生殖器官肿瘤分类(第5版)的命名,分为:
1) POLE超突变型-POLE mut(POLE mutation)
2) MSI-H型或或错配修复系统缺陷型-MSI-H/MMRd(MMR deficiency)
3) 无特异性分子谱-NSMP(non-specific molecular profile)
4) p53突变型或高拷贝型-p53 abn(p53 bnormality)
不同组织对分子分型的命名不同,判读也略有差异,但都分为4类,以下为分子分型命名对照表:
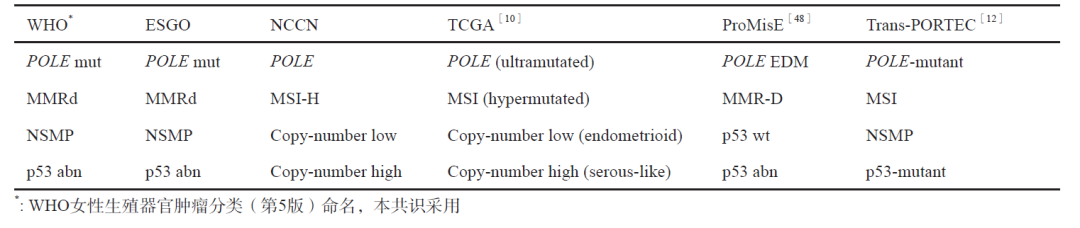
▲(图 2分子分型命名对照表)
04 分子分型检测内容
4.1. POLE mut检测
包括热点突变检测、与POLE基因核酸外切酶结构域致病突变检测 [13]。POLE基因编码DNA聚合酶ε催化亚基,用于修复DNA复制错误,该基因核酸外切酶结构域包含外显子9~14,该区域发生 致病突变将导致子宫内膜癌表现“超突变”表型(≥100个突变/Mb)。80%以上的POLE 基因致病变异发生在9号和13号外显子,常见的5个热点突变包括P286R、V411L、S297F、A456P和S459F,覆盖95.3%的已知POLE基因致病变异位点。在条件允许的情况下,可考虑POLE基因核酸外切酶结构域致病突变检测,推荐检测范围覆盖POLE基因9~14号外显子区域,可采用高通量测序方法进行,该区域变异的致病性依据COSMIC 10 signature、突变类型、肿瘤突变负荷(TMB)、复现突变等因素进行综合判定。
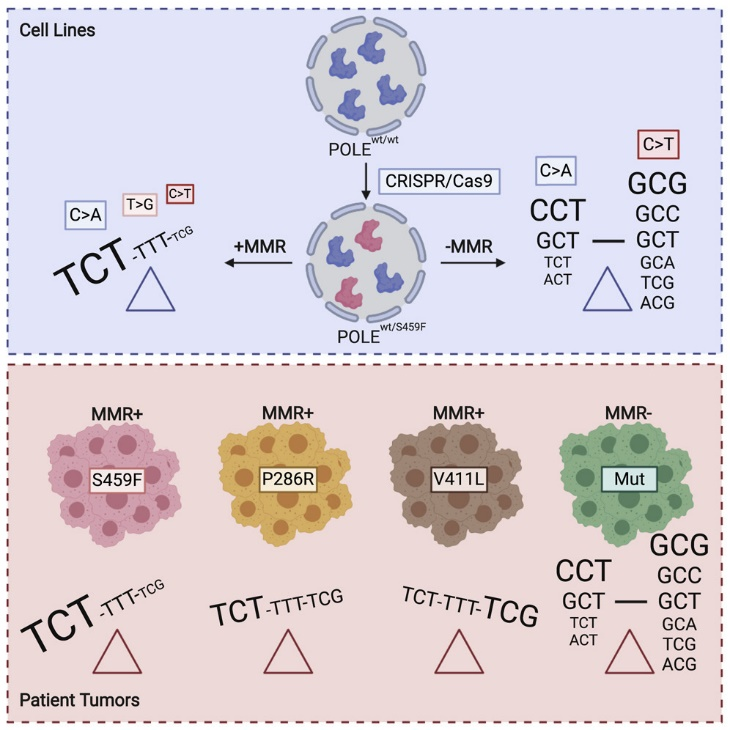
▲(图 3 POLE突变)
4.2.MMR/MSI状态检测
推荐MMR蛋白(免疫组织化学法)或MSI(PCR法或高通量测序方法)检测。免疫组织化学法检测4个MMR蛋白(MLH1、PMS2、MSH2和MSH6)的表达情况。肿瘤细胞核4个MMR蛋白表达完整/正常为pMMR,肿瘤细胞核一个或多个MMR蛋白表达缺失/异常为dMMR。也可以用DNA MSI检测(PCR或高通量测序)代替MMR检测。MMR与MSI检测具有高度一致性。
4.3.p53状态
推荐p53蛋白表达(免疫组织化学法)或TP53基因突变(高通量测序方法)检测进行判断。TCGA研究 [10]中,TP53基因突变在CNH(copy-number high)和CNL(copy-number low)两个分子表型中互斥。CNH组常见TP53基因突变(突变类型包括无义突变、错义突变、插入缺失、移码突变和剪切变异,即影响p53蛋白氨基酸序列的突变),发生比例约92.0%。因此,TP53基因突变可用于替代CNH分型,而p53蛋白免疫组织化学检测和TP53基因突变一致性可达92.1% [14],临床实践中采用p53蛋白免疫组织化学检测更易实现,但需注意由此可能导致约15%的CNH人群被分类到NSMP组 [10] [15]。p53蛋白免疫组织化学表达呈现完全阴性、细胞核弥漫强阳性表达或细胞质表达时,为p53蛋白表达异常,提示TP53基因为突变状态。p53蛋白表达呈现细胞核散在阳性时,为p53蛋白表达正常,提示TP53基因为野生型状态。高通量方法检测TP53基因突变建议覆盖TP53基因所有外显子区及邻近剪切位点,发生任何无义突变、错义突变、插入缺失、移码突变和剪切变异等变异,提示TP53基因为突变状态 [10]。TP53基因发生同义突变或无任何突变,可判断TP53基因为野生型状态。
05 分子分型的检测方案
专家共识推荐对所有确诊的子宫内膜癌患者进行林奇综合征筛查 [16]
-
专家共识推荐对所有确诊的子宫内膜癌患者进行分子分型,检测样本可选择活检、刮宫或手术切除的肿瘤标本 [16]。
-
在资源有限地区,不能对所有子宫内膜癌患者进行普遍检测时,对于术后传统临床病理学评估提示不需要进行辅助治疗的患者,可考虑省略POLE基因突变检测,但仍建议进行MMR/MSI状态和p53状态检测 [16]。
-
基本推荐(经济性):联合POLE基因热点突变检测(Sanger测序)、MMR蛋白检测(免疫组织化学法)/MSI检测(PCR法)和p53蛋白检测(免疫组织化学法)进行分子分型。
-
可选推荐(国内检测现状):采用高通量测序方法检测POLE基因突变、MSI状态和TP53基因突变进行分子分型。POLE基因突变检测包括热点突变检测或POLE基因核酸外切酶结构域致病突变检测。
06 分子分型的判读顺序
分子分型建议遵循以下判读顺序:
1) 首先依据POLE基因检测结果进行判断,发生POLE基因致病变异时,则判定为POLE mut;
2) 在POLE基因为野生型或发生非致病变异时,再依据MMR/MSI状态进行判断,若为dMMR或MSI-H,则判定为MMRd;
3) 若MMR/MSI状态为pMMR或MSS(MSI-L和MSS均归类为MSS)时,进一步依据p53状态进行判断,若p53蛋白表达异常或TP53基因为突变状态,则判定为p53 abn,若p53蛋白表达正常或TP53基因为野生型状态,则判定为NSMP(2A类)
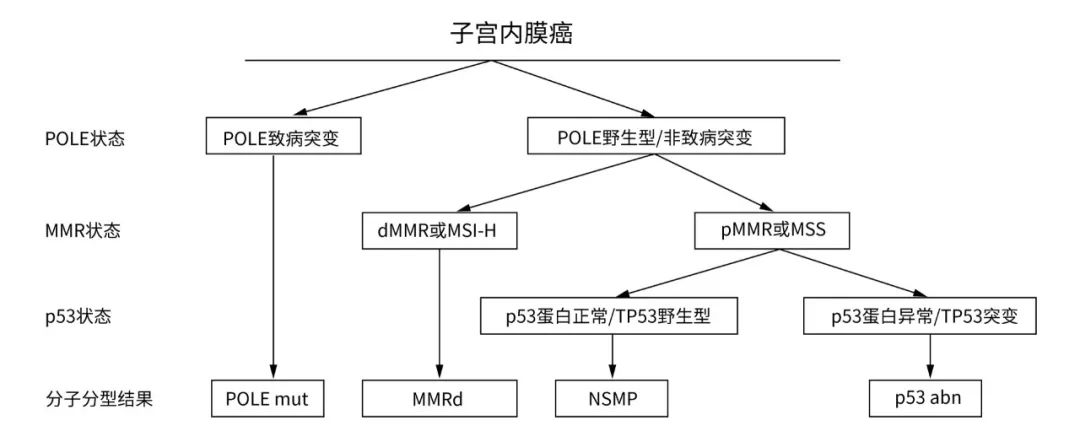
▲(图 4分子分型推荐检测路径)
07 分子分型的指导意义
子宫内膜癌分子分型在不依赖肿瘤形态学特征的前提下,通过分子特征进行分类,提升了子宫内膜癌诊断的准确性和可重复性。结合临床病理学特征和分子分型对子宫内膜癌进行风险分层和指导临床诊疗是今后子宫内膜癌诊疗的方向。
-
其中POLE超突变型预后很好,这类患者如果手术分期为Ⅰ~Ⅱ期,术后可考虑随访,不做辅助治疗。
-
MSI-H型预后中等,对免疫检查点抑制剂的治疗敏感,但目前的证据仅限于晚期和复发病例。
-
NSMP型预后中等,对激素治疗较敏感,年轻患者保育治疗效果较好。
-
p53突变型预后最差,对化疗可能敏感。
*本文(包括图片)仅供行业交流学习用,不作为医疗诊断依据。
*图片截取自《子宫内膜癌分子检测中国专家共识(2021年版)》,如有侵权请联系编辑删除。
参考文献
[1]“Chen W, Zheng R, Baade P D, et al. Cancer statistics in China, 2015. CA Cancer J Clin, 2016, 66(2): 115~132.”.
[2]“SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2017[J]. CA Cancer J Clin, 2017, 67: 7-30.”.
[3]“DOLL K M, TSENG J, DENSLOW S A, et al. High-grade endometrial cancer: revisiting the impact of tumor size and location on outcomes[J]. Gynecol Oncol, 2014, 132(1): 44-49.”.
[4]“BENEDETTI PANICI P, BASILE S, SALERNO M G, et al. Secondary analyses from a randomized clinical trial: age as the key prognostic factor in endometrial carcinoma[J]. Am J Obstet Gynecol, 2014, 210(4): 363.e1-363363.e10.”.
[5]“BOKHMAN J V. Two pathogenetic types of endometrial carcinoma[J]. Gynecol Oncol, 1983, 15(1): 10-17.”.
[6]“KWON J S, SCOTT J L, GILKS C B, et al. Testing women with endometrial cancer to detect Lynch syndrome[J]. J Clin Oncol, 2011, 29(16): 2247-2252.”.
[7]“URICK M E, BELL D W. Clinical actionability of molecular targets in endometrial cancer[J]. Nat Rev Cancer, 2019, 19(9): 510-521.”.
[8]“American College of Obstetricians and Gynecologists. ACOG practice bulletin, clinical management guidelines for obstetrician-gynecologists, number 65, August 2005: management of endometrial cancer[J]. Obstet Gynecol, 2005, 106(2): 413-425.”.
[9]“VOSS M A, GANESAN R, LUDEMAN L, et al. Should grade 3 endometrioid endometrial carcinoma be considered a type 2 cancer-a clinical and pathological evaluation[J]. Gynecol Oncol, 2012, 124(1): 15-20.”.
[10]“Cancer Genome Atlas Research Network, KANDOTH C, SCHULTZ N, et al. Integrated genomic characterization of endometrial carcinoma[J]. Nature, 2013, 497(7447): 67-73.”.
[11]“TALHOUK A, MCCONECHY M K, LEUNG S, et al. A clinically applicable molecular-based classification for endometrial cancers[J]. Br J Cancer, 2015, 113(2): 299-310.”.
[12]“STELLOO E, NOUT R A, OSSE E M, et al. Improved risk assessment by integrating molecular and clinicopathological factors in early-stage endometrial cancer-combined analysis of the PORTEC cohorts[J]. Clin Cancer Res,2016, 22(16): 4215-4224.”.
[13]“LEÓN-CASTILLO A, DE BOER S M, POWELL M E, et al. Molecular classification of the PORTEC-3 trial for highrisk endometrial cancer: impact on prognosis and benefit from adjuvant therapy[J]. J Clin Oncol, 2020, 38(29): 3388-3397.”.
[14]“S I N G H N , P I S K O R Z A M , B O S S E T , e t a l . p 5 3 immunohistochemistry is an accurate surrogate for TP53 mutational analysis in endometrial carcinoma biopsies[J]. J Pathol, 2020, 250(3): 336-345.”.
[15]“MCALPINE J, LEON-CASTILLO A, BOSSE T. The rise of a novel classification system for endometrial carcinoma; integration of molecular subclasses[J]. J Pathol, 2018, 244(5): 538-549.”.
[16]“中国抗癌协会妇科肿瘤专业委员会, 中华医学会病理学分会, & 国家病理质控中心. (2021). 子宫内膜癌分子检测中国专家共识(2021年版). 中国癌症杂志.”.


