JCO Oncol Pract:原发性CNS淋巴瘤的诊断、病理和治疗
时间:2023-11-26 23:27:01 热度:37.1℃ 作者:网络
PCNSL
原发性 CNS 淋巴瘤 (PCNSL) 是一种罕见的淋巴瘤,占 CNS 恶性肿瘤的3%,其脑活检相关的独特风险使诊断较为复杂,而能够穿过血脑屏障的有效药物限制性同样使治疗变得复杂。大多数PCNSL具有免疫活性,但免疫缺陷仍是重要的风险因素。一线治疗和巩固治疗选择的改善,包括使用造血干细胞移植,已转化为改善生存期,但发生复发性或难治性疾病的患者通常预后不佳。
《JCO Oncology Practice》近日发表综述,回顾了 PCNSL 的关键临床、病理和治疗信息,并强调了治疗中可能遇到的具有挑战性的临床情况。

流行病学
原发性 CNS 淋巴瘤 (PCNSL) 主要是一种老年人疾病,免疫功能正常个体的中位年龄为67岁,但也有年轻患者,特别是 HIV 阳性或实体器官移植后。PCNSL 约占所有原发性脑恶性肿瘤的2%-3%,占所有非霍奇金淋巴瘤的6%,美国发病率约为7例/100万人。在免疫功能正常的老年患者中,发病率似乎以每年约1.7%的速度上升。免疫功能正常个体占大多数病例,63%的 PCNSL 病例发生在免疫功能正常个体,21%的病例可能与与 HIV+或实体器官移植后和自身免疫性疾病有关。PCNSL 的风险因素与免疫抑制密切相关,其中 HIV+个体或实体器官移植后需要长期免疫抑制剂治疗的个体的风险更高。在免疫功能低下患者中,与 EB 病毒的相关性更大。PCNSL 在男性中略多于女性。总的来说PCNSL 发生率升高的解释仍不清楚。
病理学
大多数 PCNSL 病例的基础病理学为弥漫性大 B 细胞淋巴瘤,免疫组化显示为非生发中心 B 细胞来源(GCB)。但PCNSL 并不局限于大细胞或 B 细胞组织学,大约10%的病例可能包括惰性 B 细胞淋巴瘤或 T 细胞淋巴瘤。移植后淋巴增生性疾病也可能仅存在于 CNS 中。
组成性激活的 B 细胞受体 (BCR) 信号转导与 PCNSL 的发病机制有关(图1)。BCR 突变和通过 Bruton 酪氨酸激酶 (BTK) 的信号传导,特别是当与 toll 样受体信号传导的突变配对时,激活下游 NF-kB 驱动 PCNSL 的肿瘤发病机制。多项研究已经证明,在 PCNSL 中 MYD88 突变(特别是L265P)的发生率高达70%,提示通过靶向BTK.IL-1受体相关激酶-4(IRAK-4) 激活 NF-kB 的疗法抑制 BCR 信号的潜在治疗活性也可能是癌细胞和肿瘤微环境中的重要机制。最后,经常观察到染色体9p24.1(包含免疫检查点阻断 PD-L1 基因位点)的拷贝数变异。这些基因组紊乱加上 HLA 位点的缺失,突出了免疫逃避在 PCNSL 发病机制中的潜在作用。
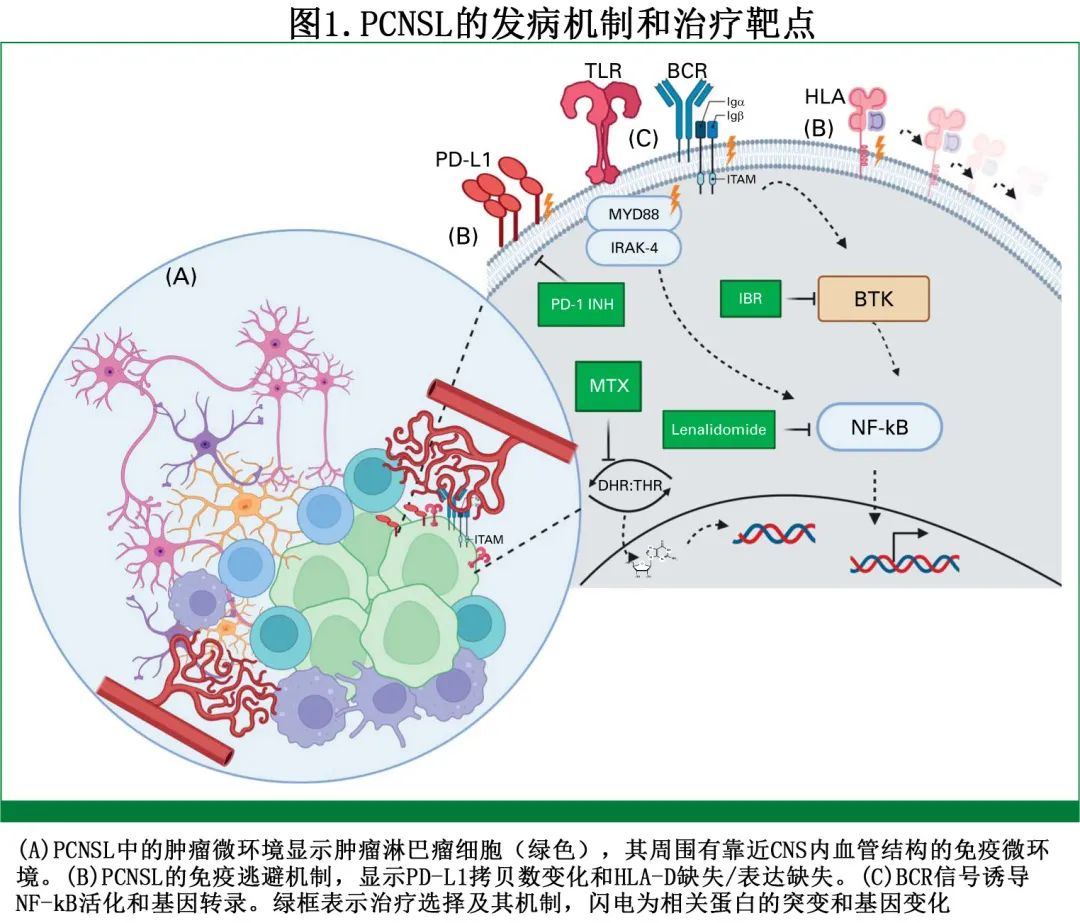
诊断
PCNSL 表现为局灶性和/或整体性神经功能缺损。虽然大多数 PCNSL 病变累及脑实质,但也可出现眼、软脑膜和脊髓的玻璃体视网膜受累。孤立性软脑膜表现不常见 (7%),但在高达42%的病例中观察到继发性受累。高达25%的患者发生玻璃体视网膜受累。症状可能包括整体神经系统表现,包括意识模糊、人格改变、头痛和癫痫发作。局灶性缺陷也很常见,包括感觉运动缺陷、视力改变、复视、构音障碍或共济失调和步态异常。症状评估包括神经影像学检查,其中钆造影剂磁共振成像 (MRI) 是金标准影像学技术;MRI 上提示淋巴瘤的特征性表现包括均匀对比增强的单个占位病变,坏死很少。PCNSL 病变通常位于含有脑脊液的区域边界,可能表现为异质性增强或多灶性 CNS 疾病。18F 标记的氟脱氧葡萄糖PET扫描图像有助于排除全身受累。
组织诊断前皮质类固醇的使用
皮质类固醇可显著改善 PCNSL 患者的症状,但类固醇反应可使活检无诊断价值,报告表明,即使暴露<1周,也会导致33%的患者活检阴性。建议避免类固醇治疗,直至对非紧急表现进行活检。如果已经使用类固醇,理想情况下在活检前5-7天暂停使用,以确保病变仍然适合活检。如果类固醇导致颅内病变明显或完全消退,建议每1-2周通过 MRI 进行密切监测(至少每周检查一次),因为类固醇给药后可能快速发生症状性复发。类固醇反应不能诊断PCNSL,可以在良性疾病(即结节病)中观察到。
基于并发症风险降低和恢复更快且允许更早全身治疗,立体定向脑活检优于手术切除。肿瘤学和神经外科多学科讨论中的选定病例可能从手术切除中获益。建议通过腰椎穿刺 (LP) 进行脑窦液 (CSF) 细胞学和流式细胞术检查以确定脑膜受累,而CSF蛋白水平可告知预后评分。在颅内压升高的情况下不建议进行LP。最后,建议进行眼科会诊以评价玻璃体视网膜组织的眼部受累,以用于分期和有视觉症状表现时。
无法进行组织诊断时
PCNSL可仅出现于深部脑组织或结构中,但较罕见,此时具有重大的诊断困境,由于永久性神经损伤的风险不可接受而可能禁忌活检。如果无法选择手术活检,则必须评价 CSF 中的循环克隆淋巴细胞。在没有组织学和细胞学证实的情况下,Myd88和 IgH 突变的分子检测和 IL-10 的细胞因子分析可能支持 CNS 淋巴瘤的诊断。最终,还存在无法安全进行活检且 CSF 分析无结果的情况,此时将在与放射学、神经外科和肿瘤学的多学科讨论中得出假定诊断,MRI 的特征性放射学结果和对类固醇的明显反应可能是有利于淋巴瘤的诊断线索。另外重要的是,解决方案可能是循环肿瘤 DNA 谱分析的新兴技术,最近发现其在检测血浆和 CSF 样本中的 CNS 淋巴瘤方面具有高度灵敏度。
初始治疗
PCNSL 一线治疗方案的标准治疗是基于大剂量甲氨蝶呤(HD-MTX;图1),作者将 HD-MTX 定义为甲氨蝶呤 (MTX) 剂量≥3.0 g/m2,约每14-21周给药一次,具体取决于 PCNSL 的治疗方案。表1显示了合并 HD-MTX 的常见联合治疗方案。在美国,通常使用甲氨蝶呤联合利妥昔单抗和替莫唑胺 (MT-R) 或丙卡巴肼和长春新碱±利妥昔单抗 (R-MPV)。回顾性报告证实了含 MTX 的 MT-R 和 R-MPV 方案在老年人群中的疗效和耐受性,强调了 MTX 剂量强度与结局改善之间的正相关。基于国际结外淋巴瘤研究组 (IELSG)32 随机试验,甲氨蝶呤、阿糖胞苷、塞替派和利妥昔单抗 (MATRix) 也有强有力的证据支持用作一线治疗(表1)。MATRix 的回顾性数据证实了其在 IELSG32 研究中的疗效,但会增加毒性(包括重度感染)、治疗相关死亡率较高(约6%)以及降低剂量的频率(尤其是不符合 IELSG32 入组标准的患者)。因此MATRix最好用于更年轻、更健康(fit)的患者,这些患者更类似于 IELSG32 中接受治疗的患者人群。
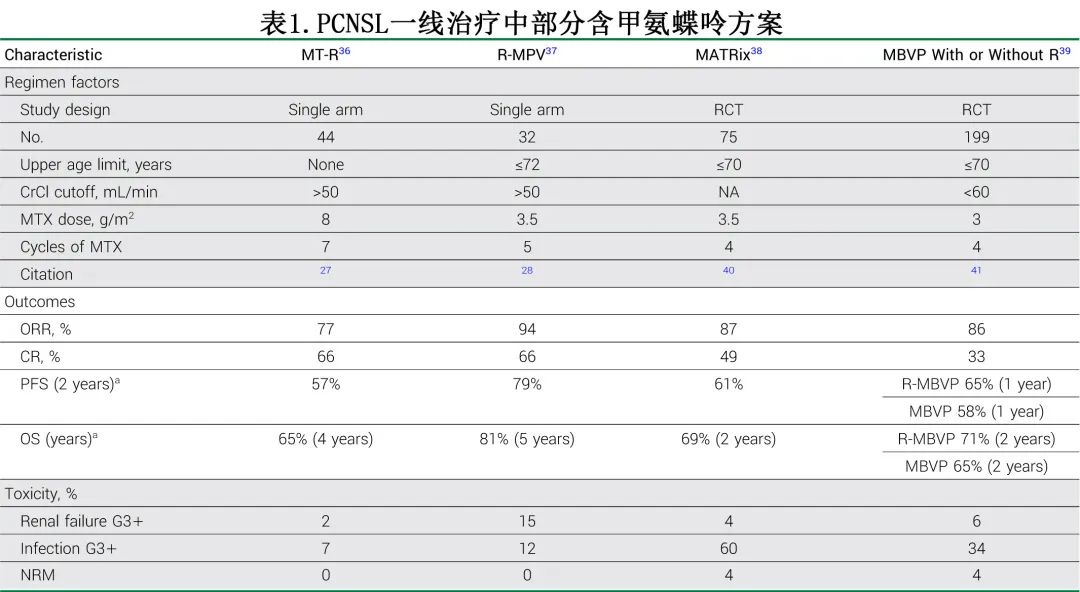
HD-MTX 无年龄上限,可在健康(fit)的高龄患者(≤90岁)中安全给药。对于晚期肾功能不全患者,可调整 MTX 剂量,但并非绝对禁忌。作者将根据肌酐清除率低于100 mL/min,以降低比例调整 HD-MTX 给药(表2)。已经提出并评估了不同的基于体重的给药策略,偶见关于 BMI 升高患者是否应限制剂量的问题。最近在 PCNSL 患者中进行的一项研究观察到,肥胖和非肥胖患者具有相似的 MTX 清除药代动力学特征。PCNSL 中的这一发现支持 ASCO 关于化疗给药的指南,支持肥胖患者基于体重的全剂量给药,尤其是用于治愈目的时。
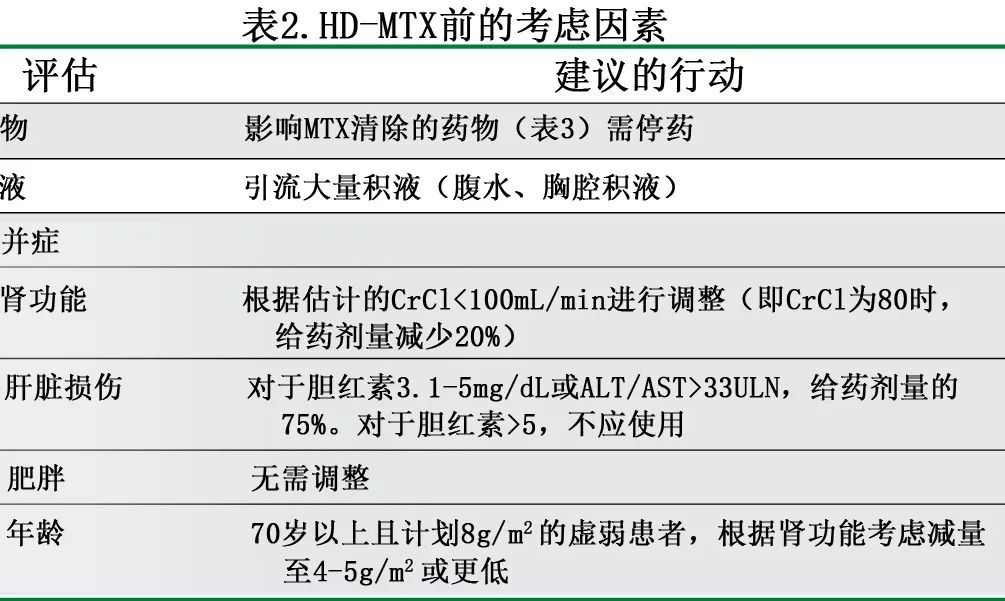
HD-MTX 给药应在住院环境中,由经验丰富的肿瘤学家、药剂师、护士执行且能够快速反馈血液 MTX 水平的实验室。MTX 给药前的建议评价见表2。患者应接受持续水化、尿液碱化(目标pH≥7.0)和根据 MTX 水平调整亚叶酸支持。应进行药房主导的药物核对,并暂停影响 MTX 清除的药物(表3)。HD-MTX 总体耐受性良好,但其毒性包括肾功能不全、粘膜炎、肝转氨酶升高和神经毒性。肾功能不全是一线治疗的即刻输注期间和随时间推移的主要问题,其中肾功能下降是暂停进一步 MTX 治疗的常见指征。对于输注后早期急性肾衰且 MTX 水平高的患者,作者给予单剂量的羧肽酶(50 U/kg体重),根据预期的 MTX 清除率列线图,该酶能够将 MTX 快速代谢为无活性形式,而不适当的高水平可能导致更严重的肾损伤和毒性。使用羧肽酶后,HD-MTX再激发非常罕见。尽管尚无 CNS 成人的已发表数据,但接受肉瘤治疗的儿科患者的数据证明了可行性。
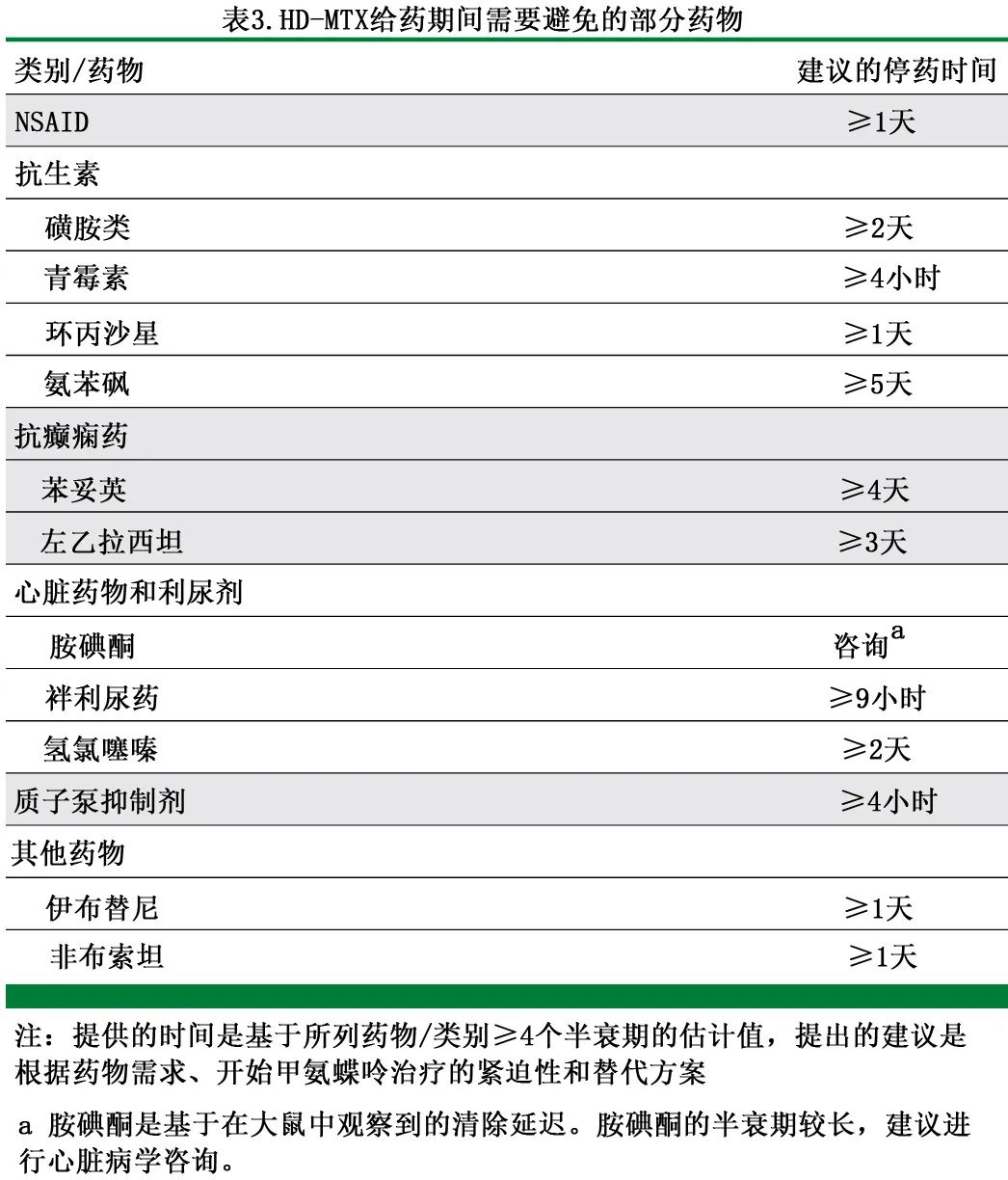
其他MTX为基础的化疗方案在一线治疗中也有效,包括甲氨蝶呤、卡莫司汀、teniposide、泼尼松联合/不联合利妥昔单抗 (MBVP+/-R)。表1显示这些方案具有差异,但需谨慎解释方案之间的结果,因为尚未对其进行直接比较,此外所有研究均纳入了巩固治疗。考虑到 PCNSL 治疗方案中利妥昔单抗的 CNS 穿透力有限,关于利妥昔单抗的作用存在矛盾的数据,但基于多项阳性研究、在破坏的血脑屏障中的穿透力和有限的毒性,作者支持使用利妥昔单抗。正在开展在一线和后线治疗方案中加入活性药物的临床试验,如伊布替尼 (IBR) 联合HD-MTX,以改善一线治疗。
MTX无法给药时的治疗选择
尽管大剂量 MTX 适用于大多数新诊断 PCNSL 患者,但也存在发生非预期 MTX 毒性或禁用 MTX 的情况。在这种情况下,最佳方案的选择尚不清楚,尤其是在接受根治性治疗方案的患者中,因为很少有一线试验不使用HD-MTX。一种选择是阿糖胞苷为基础的化疗,与替莫唑胺、塞替派和利妥昔单抗(不含 MTX 的MATRix)联合治疗,在一线治疗中具有令人鼓舞的缓解。该方案得到了在复发性/难治性疾病患者中使用大剂量阿糖胞苷和依托泊苷的法国数据的支持,但这些研究中使用的大剂量化疗可能限制其在老年或共病患者中的应用。另一个方案为替莫唑胺、依托泊苷、地塞米松、多柔比星脂质体、伊布替尼和利妥昔单抗 (TEDDI-R),适合健康患者,尤其是如果计划将 ASCT 作为巩固策略时。TEDDI-R 是基于 IBR 与烷化剂化疗协同作用的临床前证据开发的,已在复发患者的小型试验中进行了研究,观察到极高的完全缓解率 (86%),支持其作为计划接受移植患者的挽救治疗选择;但研究中观察到显著的感染毒性,包括致死性侵袭性曲霉病病例。作者会使用抗霉菌预防和适当减少 IBR 剂量,以防止使用 TEDDI-R 时发生这些感染。
对于不适合 HD-MTX 或多药化疗的患者,建议在放射肿瘤学、姑息治疗和肿瘤学之间进行多学科管理。作者考虑立体定向放射外科 (SRS) 的作用(尤其是对于<4 cm的较小症状性病变),随后采用替莫唑胺和利妥昔单抗联合治疗。尽管没有可用数据支持该方案,但其依据是基于 SRS 联合/不联合化疗的现有证据、替莫唑胺的单药活性及极小毒性极小和利妥昔单抗的有限毒性。评价 SRS 联合/不联合 MTX 的多项研究支持SRS,并突出了其极佳的局部控制率和极小的神经毒性,尤其是与全脑放射治疗 (WBRT) 相比。已对替莫唑胺单药治疗和联合利妥昔单抗治疗及伴或不伴放疗进行了研究,其毒性特征极佳且缓解率较高,完全缓解 (CR) 范围为29%-73%。
巩固治疗
历史上,PCNSL的治疗策略集中在放疗,但随着时间的推移,考虑到显著影响生活质量的高度神经毒性(尤其是在老年患者中观察到的高发生率),全脑放疗的热情逐渐降低。目前,达到≥PR的合格患者的标准治疗是进行 BCNU-塞替派 (BCNU-TT) 预处理,随后进行自体造血干细胞移植 (ASCT)。该方案得到了回顾性分析和一项前瞻性欧洲研究的支持,与非清髓性化疗相比,使用巩固性 BCNU/TT ASCT 的长期无进展生存期 (PFS) 和总生存期 (OS) 结局分别高达79%和86%,突出了其作为巩固治疗选择的疗效。法国 PRECIS 研究还在随机研究中直接比较了ASCT和WBRT,8年随访的更新结局证实了采用塞替派-白消安-环磷酰胺 (TBC) 预处理的 ASCT 相对于 40 Gy WBRT 的明确优效性,中位8年无事件生存率为67% vs 39% (P=0.03)。该研究还强调了神经毒性的程度和严重程度,表现为平衡能力(52% v 10%;P<0.001;WBRT v ASCT组观察到的下降)和神经认知 (64% v 13%;P=0.001) 的神经功能恶化;但TBC方案与治疗相关死亡率(5/44,11%;5/14,总体死亡的36%)和继发性恶性肿瘤 (4/44,9%) 的高发生率相关,4例中3例为致死性(与治疗相关死亡率数据分开统计)。据报道,TT-BCNU 与 TBC 预处理的OS相似, 但TBC预处理的低复发率被较高的移植相关死亡率所抵消。
如果不适合ASCT,也可以将巩固化疗或 WBRT 作为一种有效的选择,尽管神经毒性仍是限制 WBRT 的重大问题。一项前瞻性非随机研究检验了使用依托泊苷和阿糖胞苷 (EA) 进行一个周期的巩固化疗,从开始 EA 的1年和2年 PFS 率分别为85%和69%;但EA治疗与中性粒细胞减少和血小板减少的高发生率相关(21/26例,共有81%为4级),5/26例 (19%) 发生≥3级感染(1/26例接受 EA 的患者发生致死性脓毒症事件)。这些数据支持对不适合或不适合 ASCT 的患者进行 EA 巩固治疗。
许多情况下患者可能过于虚弱而无法进行 ASCT 或 EA 化疗(例如80岁以上高龄、多器官功能障碍/合并症)。在这些情况下可以考虑使用来那度胺单药维持治疗。该决定是基于一项前瞻性但明显较小的患者研究 (N=14),该研究证实来那度胺安全、有效且耐受性良好。作者的目标是维持来那度胺治疗至少1年,并根据经济毒性、副作用和总体患者满意度讨论继续治疗的风险/获益。
治疗缓解后监测
PCNSL 治疗后监测的不同之处在于包括常规结合 MRI 和门诊访视,这得到了指南的支持。影像学监测得到了法国队列研究的支持,在单变量而非多变量分析中,无症状复发(即仅通过影像学检查检测到)相对于症状性复发不常见,并与 PFS/OS 改善相关。
复发/难治疾病
从历史上看,复发性/难治性 PCNSL 的预后不佳,PFS和 OS 通常以月为单位,反映出除血脑屏障外治疗该疾病的可用选择有限,而结合新型小分子治疗甚至细胞治疗是这些结局可能改善的迹象(图1)。如果患者对一线 HD-MTX 治疗耐药,可考虑使用前文的方案,包括 TEDDI-R 或阿糖胞苷为基础的多药化疗,使用不属于初始或既往治疗一部分的药物,尤其是如果目标是进行BCNU-TT ASCT。对于不适合 ASCT 或 ASCT 后复发的虚弱患者,前瞻性研究证实 CD19 CAR-T 细胞输注治疗是可行、安全的,可有效治疗复发/难治性PCNSL。入组一项 axicabtagene ciloleucel 初步研究 (N=9) 的患者的中位年龄为60岁,既往中位接受2线治疗,不允许接受桥接治疗,中位时间为自末次治疗至入组的57天。尽管患者和研究特征提示选择了侵袭性较低的疾病,但疗效令人印象深刻,可评价 (n=7) 患者的 CR 率为86%,且安全性特征与 axi-cel 治疗系统性大细胞淋巴瘤的结果相似。
对于无法/不适合CAR-T 细胞治疗或需要立即治疗的患者,可重点关注新药,包括 IBR 或来那度胺。伊布替尼的前瞻性和回顾性研究中总体缓解率为58%-77%,中位 PFS 和 OS 范围分别为3-5个月和4.6个月-15个月;部分某些缓解患者可能有持续数年的持久缓解。来那度胺和泊马度胺也可透过血脑屏障,36%的患者观察到缓解,中位 PFS 和 OS 分别为8个月和18个月。PD1 的高表达和染色体 9p 异常导致了人们对 PD-1 抑制剂的热情,早期的病例系列强调了这些方法的疗效。正在探索包括单药治疗和与化疗联合治疗的后续研究。在更大规模的研究中报告的反应有些不佳,但在治疗选择非常有限的患者中仍然令人鼓舞。有综述概述了 PCNSL 免疫治疗的现状。复发患者对化疗的反应较差,毒性较高,表明只有在仔细讨论护理目标并考虑单独姑息治疗或临终关怀治疗后,才能提供此类治疗。
总结和未来方向
PCNSL 是相当一部分患者可治愈的疾病。包括伊布替尼、来那度胺甚至 PD1抑制剂在内的新药的使用在历史上改善了复发性/难治性疾病的不良结局。正在对新型 BTK抑制剂单药治疗和与化疗联合治疗 PCNSL 以及 CD19 CAR-T 治疗进行试验。新策略使得管理这种具有挑战性的疾病越来越乐观和有希望。
参考文献
D'Angelo CR.Diagnostic, Pathologic, and Therapeutic Considerations for Primary CNS Lymphoma.JCO Oncol Pract . 2023 Nov 15:OP2300294. doi: 10.1200/OP.23.00294.


