艾棣维欣生物或赴港上市,新冠病毒DNA疫苗INO-4800引关注
时间:2021-04-26 23:01:39 热度:37.1℃ 作者:网络

4月25日,中国证监会国际部官网披露了北京艾棣维欣生物技术股份有限公司(简称艾棣维欣生物)提交的《境外首次公开发行股份(包括普通股、优先股等各类股票及股票派生的形式)审批》材料。一旦获得受理,这将就意味着开启艾棣维欣生物在港交所递交招股书的绿灯。

北京艾棣维欣生物技术股份公司成立于2009年,是一家新兴的临床阶段免疫治疗公司,针对传染病、癌症和自身免疫性疾病开展新型预防和治疗疫苗的开创性研发。数据显示,艾棣维欣生物经过了6轮融资,在今年3月26日刚完成6600万美元的新一轮融资。本次战投方包括经纬中国、弘毅投资、沃生投资、星空资本等。
艾棣维欣利用创新的抗原技术、佐剂平台以及细胞免疫评估平台,开展范围广泛的疫苗应用研发工作,以实现新型疫苗和免疫治疗候选疫苗的快速开发。经过多年创新性临床前和临床研究,艾棣维欣已成功建立了一个范围广泛候选疫苗组合,包括基于一种新型佐剂的针对老年人和婴儿呼吸道合胞体病毒(RSV)感染的预防性疫苗、一种针对慢性乙型肝炎(CHB)的免疫治疗疫苗,以及一种针对自身免疫性疾病和多种癌症的免疫治疗候选疫苗。依托在疫苗研究方面的深厚专业知识和内部大规模生产能力,艾棣维欣已成功地将多种候选疫苗推进到临床阶段,并准备在不久的将来执行后期临床测试和投入商业生产。
今年一月初,艾棣维欣(苏州)生物制药有限公司与美国Inovio公司签署协议。根据合作及许可协议,艾棣维欣将具有独家授权在大中华区(包括中国大陆、香港、澳门和台湾)开发、生产及商业化新冠病毒DNA疫苗INO-4800。
艾棣维欣将许可INOVIO在生产INO-4800及其他INOVIO产品线的候选产品时使用其质粒生产工艺,同时授予INOVIO的生产伙伴再许可的权利。此外,艾棣维欣将向INOVIO提供临床数据以支持INOVIO履行全球INO-4800监管文件,且INOVIO会向艾棣维欣提供INO-4800的临床数据以在大中华区开展营销。艾棣维欣将向INOVIO预付三百万美元,并将在INO-4800在大中华区达成指定目标及取得销售里程碑后总计支付1.08亿美元。INOVIO将获得一笔专利使用费,等值于大中华区各区域年度销售净值的6%-9%。预计2021年将在中国生产多达1亿剂疫苗。

Inovio近期计划在美国境外开展其新冠疫苗3期试验。其主要从事治疗癌症、传染病的合成疫苗及免疫疗法的研发,公司以DNA为基础的SynCon技术,设计用于提供保护已知及新的病原株,如流感;穿孔DNA传输技术采用可控的电子脉冲以加速细胞的DNA疫苗吸收。
Inovio 公司的临床实验包括HPV引起的前癌与癌症、流感、前列腺癌、乳腺癌、肺癌、胰腺癌、丙型肝炎病毒、乙型肝炎病毒、HIV、疟疾的疫苗,且临床研究季节性、大流行流感疫苗及Zika病毒(译作:寨卡病毒、兹卡病毒、赛卡病毒)、埃博拉病毒疫苗和其他产品。
INO-4800是INOVIO的DNA疫苗候选产品,旨在防止可引起新冠肺炎的新型冠状病毒SARS-CoV-2的感染。INOVIO在研究冠状病毒方面具有丰富的经验,并且是第一家启动INO-4700 2a期试验的公司。INO-4700是针对引起中东呼吸综合征(MERS)的一种相关冠状病毒的DNA候选疫苗。
INO-4800由优化的DNA质粒组成,通过专有技术智能装置直接递送到体内细胞,产生可靠、安全、可耐受的免疫反应。INO-4800在室温下可保持稳定一年以上,在摄氏37度条件下可保持一个月以上,在常规冰箱温度中保质期预计达五年,而且在运输或储存过程中无需行冷冻。它也是满足上述全部要求的唯一的一种核酸疫苗,这对群体大规模接种而言是重要的考量因素。
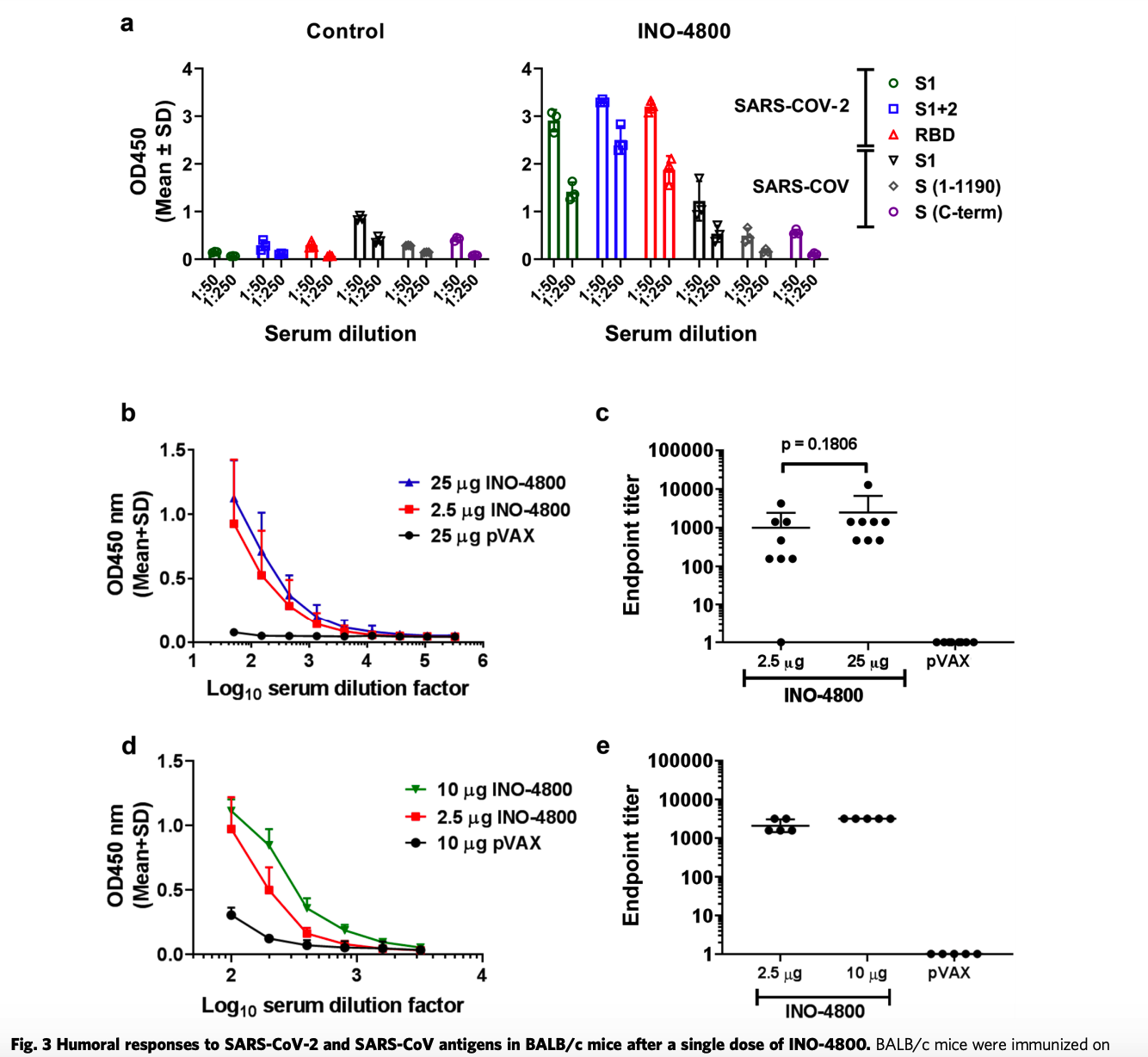
单剂量INO-4800后,BALB / c小鼠对SARS-CoV-2和SARS-CoV抗原的免疫反应,Smith, T.R.F., Patel, A., Ramos, S. et al. Immunogenicity of a DNA vaccine candidate for COVID-19. Nat Commun 11, 2601 (2020). https://doi.org/10.1038/s41467-020-16505-0
此前,艾棣维欣申报了INO-4800作为全球首款新冠 DNA 疫苗进入临床,该疫苗也是全球首个在中美同时开展临床试验的新冠 DNA 疫苗。INO-4800于去年7月获得临床试验批件,或将成为该公司最快上市的产品。据财新援引艾棣维欣战略总监刘晓雁称,INO-4800预计将于今年二季度进入III期临床试验阶段,并于今年年底前获批上市。


目前主要DNA新冠疫苗与mRNA新冠疫苗
DNA疫苗与mRNA疫苗同属于核酸疫苗,核酸疫苗继传统减毒疫苗、灭活疫苗和基因工程亚单位疫苗之后被行业内称为“第三代疫苗技术”。
20 世纪90年代初,美国威斯康星大学的约翰· 沃尔夫( John Wolf) 等意外地发现,在小鼠的肌肉内 注射含有外源基因的外源重组质粒后,质粒能够在体内稳定表达编码的蛋白质至少2个月。DC.Tang 等发现质粒不仅可以表达蛋白质,也可以诱导免疫反应。1993 年,B.Wang发现艾滋病毒DNA疫苗诱导能够产生很好的抗 HIV 感染免疫反应,MLiu 和 H Robinson 等证明 DNA 疫苗诱导的抗流感免疫反应可以保护动物免受病毒攻击。之后,这项 DNA 疫 苗技术逐渐蓬勃发展。
复旦大学金翔综述文章指出,经过十几年的改进,DNA 疫苗递送效率大幅度提升,尤其在应对严重急性呼吸综合征( SARS) 、高致病性流 感、中东呼吸综合征( MERS) 、寨卡热( ZIKA) 、裂谷热等突发性传染病方面,DNA 疫苗在临床中的初步效果得到了验证。DNA 疫苗特点有安全性好、可诱导体液免疫和细胞免疫研发和生产周期短,能快速供应稳定性高,适合战略储备及运送至偏远地区生产成本低。

https://www.who.int/biologicals/DNA_vaccines_R_WHO.BS.2020.2380_12_May_2020.pdf
2020 年8月,WHO更新了DNA 疫苗研发的指导原则 (WHO/BS / 2020.2380) ,充分肯定了 DNA 疫苗的重要性,认为 DNA 疫苗最突出的优点是: ① 制备DNA疫苗只需要进行核酸物质的重组操作,无需和蛋白质等生物分子打交道,所以制备快速和简单,并不需要考虑蛋白质抗原结构、修饰、稳定性及工艺过程带来的变化等因素。② 使用编码的基因片段不复制和不整合,不良反应极少。③ 编码的基因片段在机体 细胞中表达,可以同时激活细胞免疫反应和体液免疫反应。④ 在室温下稳定和易于大规模生产。 ⑤ 对病毒突变位点快速修改后的制备。
然而,DNA 疫苗目前仍然有不少问题需要解决,如大肠杆菌生产 DNA 疫苗中经常使用的抗生素可能会残留到DNA疫苗产品中,尽管通过纯化步骤可以去除绝大部分,但微量的残留仍然是一个风险因素,
目前,中国有三家企业在进行新冠mRNA疫苗的临床试验,新冠DNA疫苗则仅有艾棣维欣一家进入临床。全球目前尚无人用DNA疫苗上市,其安全性、有效性、及伦理风险仍有待观察。
---------
附中国证监会国际部回复
艾棣维欣生物
一、根据申请材料,你公司多名股东为有限合伙企业,部分有限合伙企业已履行私募基金备案程序,请补充说明上述私募基金及其管理人纳入监管情况,是否正常展业,是否存在因涉嫌违法违规被行政机关调查,或者被司法机关立案侦查,尚未结案的情形;是否存在被中国证监会及其派出机构或基金业协会依法采取限制业务活动、责令停业整顿等监管措施,尚未解除的情形。若存在,是否对本次发行构成障碍。请律师核查并出具明确的法律意见。
二、请你公司按照《非上市公众公司监管指引第4号——股东人数超过200人的未上市股份有限公司申请行政许可有关问题的审核指引》(证监会公告〔2013〕54号)要求计算你公司股东人数是否超过200人;如超过,请补充提供有关申请文件并履行有关程序。请律师核查并出具明确的法律意见。
三、请补充说明本次发行完成后你公司实际控制人是否发生变化。请律师核查并出具明确的法律意见。
四、请补充说明你公司与各股东的对赌协议或类似安排情况及对本次发行的影响,对赌协议或类似安排已经终止的,请说明终止的真实性、彻底性。请律师核查并出具明确的法律意见。
五、请补充说明你公司本次拟申请将所持股份转为境外上市外资股的4名股东境外投资人身份认定情况及依据,所持你公司股份是否以外币认购以及认购资金的来源,并说明上述认购资金是否已履行有关程序,是否存在受让其他股东持有的股份的情形,是否符合有关法律法规。请律师核查并出具明确的法律意见。
六、请补充说明你公司股东涉及国有股权管理的有关情况,相关程序是否履行完毕。请律师核查并出具明确的法律意见。
七、请补充说明并披露你公司治理及合规运作情况,包括董事、监事、高管选聘履职等情况。请律师核查并出具明确的法律意见。
参考文献:
Smith, T.R.F., Patel, A., Ramos, S. et al. Immunogenicity of a DNA vaccine candidate for COVID-19. Nat Commun 11, 2601 (2020). https://doi.org/10.1038/s41467-020-16505-0
金翔,俞庆龄,张璐楠,何悦,程鑫,刘晓雁,王宾. 针对新型冠状病毒的DNA疫苗研究进展[J]. 中国新药杂志,2020,21:2425-2433.


