Cell:增强神经元自噬,清除大脑毒蛋白,逆转阿尔兹海默症,还能抗衰老
时间:2021-04-28 11:01:48 热度:37.1℃ 作者:网络
阿尔茨海默症(Alzheimer's disease, AD),俗称“老年痴呆症”,是一种严重的神经退行性疾病,患者通常会出现以记忆力衰退、学习能力减弱为主的症状,并伴有情绪调节障碍以及运动能力丧失,极大地影响个人、家庭乃至社会的发展。
目前,全球约有5000万人罹患阿尔兹海默症。随着人类平均寿命增长,老年化社会加剧,阿尔兹海默症的患病率也在不断上升,预计到2050年,阿尔兹海默症患者将增加至1.5亿以上。
2021年4月22日,美国爱因斯坦医学院的研究人员在 Cell 期刊发表了题为:Chaperone-mediated autophagy prevents collapse of the neuronal metastable proteome 的研究论文。
研究团队开发了一种试验性药物,能够通过激活大脑神经元中分子伴侣介导的自噬(CMA),清除tau蛋白,逆转阿尔兹海默症小鼠模型的关键症状。
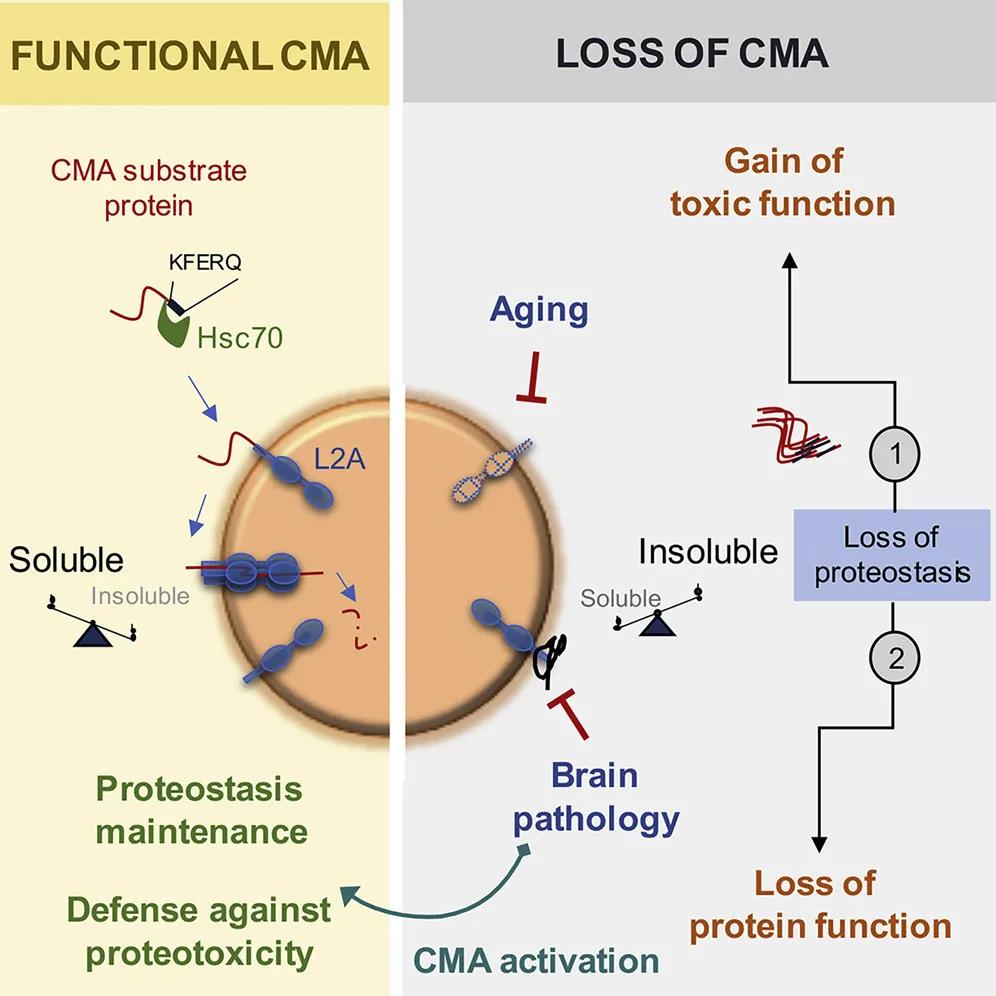
在1990年代,Ana Maria Cuervo 博士发现了细胞中存在一种自我清洁过程,即分子伴侣介导的自噬(CMA),是具有特殊模体的胞质蛋白被分子伴侣识别后,与溶酶体膜上的特殊受体——溶酶体相关膜蛋白Lamp2A结合,进入溶酶体被降解的过程。
随着年龄的增长,分子伴侣介导的自噬(CMA)的效率会降低,从而导致有害蛋白质堆积成不溶性团块,具有损害细胞的风险。
实际上,阿尔茨海默症和所有其他神经退行性疾病的共同特征就是患者大脑中存在有毒性蛋白质的聚集体。
Ana Maria Cuervo 博士领导的这篇 Cell 论文的研究首先揭示了分子伴侣介导的自噬(CMA)与阿尔茨海默症之间的动态相互作用,神经元中CMA受损导致了阿尔茨海默症,反之亦然。这表明,提高CMA的药物可能为治疗神经退行性疾病提供希望。
建立联系
研究团队首先研究了分子伴侣介导的自噬(CMA)受损是否有助于阿尔茨海默症。
为此,研究团队对小鼠进行了基因改造,使其具有缺乏CMA的兴奋性大脑神经元。试验结果表明,脑细胞中缺乏CMA足以引起短期记忆丧失,行走障碍以及在阿尔茨海默症动物模型中经常发现的其他问题。此外,CMA受损会严重破坏蛋白稳态,即细胞调节其所含蛋白质的能力。
Ana Maria Cuervo 博士怀疑反过来也成立,也就是早期阿尔兹海默症也会反过来促进CMA受损。
研究团队研究了早期阿尔茨海默症小鼠模型,在该模型中,小鼠大脑神经元会产生异常tau蛋白,这些tau蛋白异常复制会聚集在一起,又称有助于阿尔茨海默症的神经原纤维缠结。
然后,研究团队专注于观察小鼠模型的海马神经元内的CMA活动,海马神经元对记忆和学习至关重要。结果发现,与对照动物相比,这些神经元中的CMA活性显着降低。
那么早期阿尔兹海默症患者的大脑中发生了什么?是否阻碍了分子伴侣介导的自噬(CMA)?
为了找到这些答案,研究团队对比了阿尔兹海默症患者大脑神经元和健康人大脑神经元的单细胞RNA测序数据,证实了早期阿尔兹海默症患者大脑神经元中CMA活性收到了一定程度的抑制,而到了晚期,大脑中CMA活性受到了更大程度的抑制。
Ana Maria Cuervo 博士表示,人们到七八十岁时,与年轻时相比,分子伴侣介导的自噬(CMA)活性通常下降了约30%,这对于大多数人来说影响不大,但是,如果他们出现了神经退行性疾病,那将是对大脑神经元的正常蛋白质组成产生毁灭性影响。
上述研究表明,分子伴侣介导的自噬(CMA)的活性下降与阿尔茨海默症的病理学相互作用,通过协同作用,大大促进了疾病的发展。
扭转乾坤
在分子伴侣介导的自噬(CMA)中,伴侣蛋白与细胞中受损或有缺陷的蛋白质结合,分子伴侣将其运送至细胞的溶酶体中进行消化并回收废物。为了成功地将其运入溶酶体,伴侣蛋白必须首先将其“停靠”在LAMP2A蛋白质受体上,该受体位于溶酶体表面。
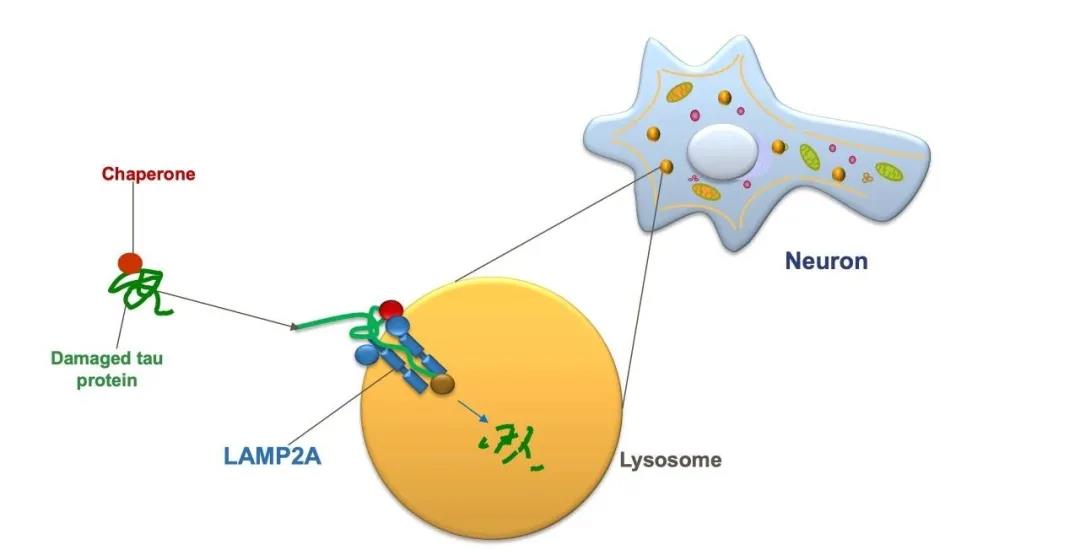
分子伴侣介导的自噬(CMA)能够消化有缺陷的tau蛋白和其他蛋白质,但是阿尔茨海默症和其他神经退行性疾病患者的CMA效率下降,过多的tau蛋白令其不堪重负。
因此,研究团队开发了一种名为CA的新药,能够增加溶酶体上LAMP2A受体的水平。溶酶体上的LAMP2A受体越多,CMA活性水平就越高。
研究团队在阿尔茨海默症小鼠模型中测试了CA药物,发现口服CA超过4至6个月可提高记忆力、改善抑郁和焦虑症状,提高运动能力。且治疗后的阿尔兹海默症小鼠的大脑中tau蛋白和蛋白团块水平显着降低。
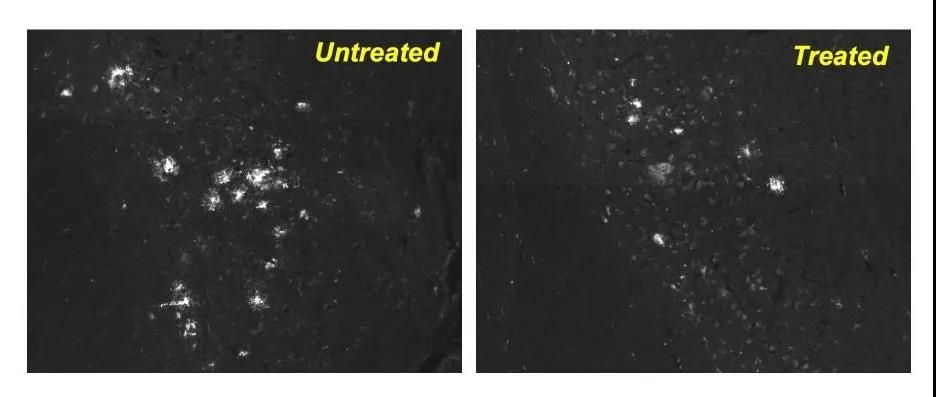
与未接受药物治疗的阿尔兹海默症小鼠(左)相比,接受该药物治疗的小鼠(右)大脑中的毒性蛋白质团块更少
加速商业化
重要的是,这些阿尔兹海默症小鼠已经显示出疾病症状,在给药前,它们的神经元被有毒蛋白团块阻塞。而治疗结果显示,该药物即使在阿尔兹海默症晚期也可以帮助保持和恢复神经元功能,该药物还能显着减少神经胶质变性。且长时间服用,未发现对其他器官的副作用。
2021年1月13日,Ana Maria Cuervo 博士在 Nature 发表论文,发现分子伴侣介导的自噬(CMA)能够维持造血干细胞功能,因此,CMA是衰老或干细胞移植情况下增强造血干细胞功能的有潜力的靶标。
我们都知道,小鼠中有效的药物不一定对人体有效,但是,这项研究发现,导致小鼠阿尔兹海默症的分子伴侣介导的自噬(CMA)效率下降,同样也发生在阿尔兹海默症患者中。这表明,研究团队开发的这款药物很可能对人体有效。

Ana Maria Cuervo 博士
Ana Maria Cuervo 博士、Evripidis Gavathiotis 博士,与 Life Biosciences 公司合作,成立了 Selphagy Therapeutics 公司,该公司目前正在开发论文中的这个名为CA的药物及其相关化合物,用于治疗阿尔茨海默症和其他神经退行性疾病。
原始出处:
Mathieu Bourdenx, et al. Chaperone-mediated autophagy prevents collapse of the neuronal metastable proteome. Cell, April 22, 2021DOI:https://doi.org/10.1016/j.cell.2021.03.048.


