Radiology:人工智能在肺癌影像学筛查上的新进展
时间:2021-05-04 06:01:31 热度:37.1℃ 作者:网络

在CT图像上,肺癌表现为亚实性病变的实性成分的大小与病理评估时的浸润性成分大小非常吻合,这决定了治疗方案的制定并反映了患者的预后,是临床关注的重中之重。
CT图像上的实性成分的大小通常由放射科医生手动测量。然而,由于观察者之间和观察者内部的可变性和主观性的存在,在CT图像上对实性成分的精确且可重复的测量仍具有挑战性。最近,用于肺部病变自动分割的深度学习(DL)算法在结果的准确性及可重复性上比传统方法表现出更强大和更优越的性能,越来越被人们所认识和使用。
近日,发表在Radiology杂志的一项研究评价了商用DL算法用于自动测量经手术证实为肺腺癌的亚实性病变的实性部分的性能,为DL算法在肺癌筛查方面的应用提供了新的理论支持和参考标准。
本研究回顾性分析了2018年1月至2018年12月期间在CT图像上表现为亚实性病变的经手术证实为的肺腺癌的病变。五名放射科医师独立测量了病变实性部分的最大轴位直径。同时使用DL算法自动分割和测量实性部分的最大轴位直径。采用类内相关系数(ICC)和Bland-Altman图比较病理检测时的Reader测量值、软件测量值和浸润性成分大小。
本研究共纳入448例患者(平均年龄63岁±10岁[标准差];264名女性)共448个病灶(浸润性成分大小,3-65 mm)。每个放射科医生和DL算法之间的测量一致性非常好(ICC范围,0.82-0.89)。当用DL算法替换放射科医生时,ICC的范围在0.87到0.90之间,5名放射科医生的ICC为0.90。DL算法与每位放射医师的平均差值在-3.7到1.5 mm之间。DL算法与每个放射科医师之间的最宽95%的一致性极限(-15.7至8.3 mm)比放射科医师的成对比较(-7.7至13.0 mm)更宽。DL算法和病理评估的侵润性成分大小之间的一致性很好,ICC为0.67。DL算法测量(平均差值,-6.0 mm)和放射科医生(平均差值,-7.5到-2.3 mm)均低估了侵润性成分的大小。
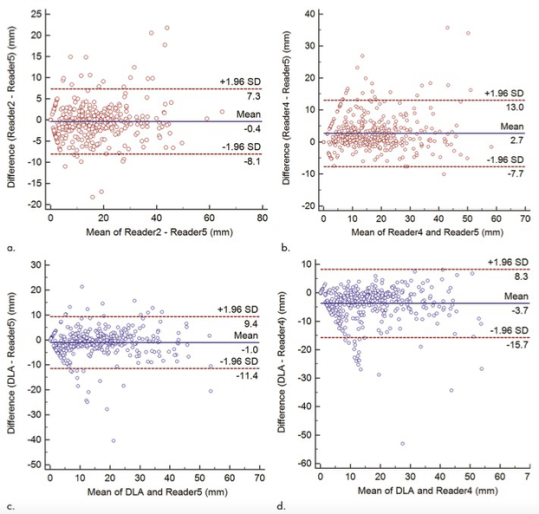
图(a,b)Bland-Altman图显示了两位放射科医师在轴位平面中测量实性成分的差异。 X轴代表两位放射科医生的平均测量值,而y轴代表两位放射科医生的测量值之间的大小差异。 a图显示了两位放射科医师(阅读者2和阅读者5)之间最窄的95%LOA。b图显示了两位放射科医师(阅读者4和阅读者5)之间最大的95%LOA。(c,d)Bland-Altman图显示了基于深度学习(DL)的算法(DLA)和放射科医生在轴位平面中测量实性成分的差异。X轴表示DL算法和每个放射科医生的平均测量值,而Y轴表示DL算法和每个放射科医生的测量值之间的大小差异。 c图显示了DL算法和放射科医师(DL算法和阅读者5)之间最窄的95%LOA,而d图显示了DL算法和放射科医师(DL算法和阅读者4)之间最宽的95%LOA。
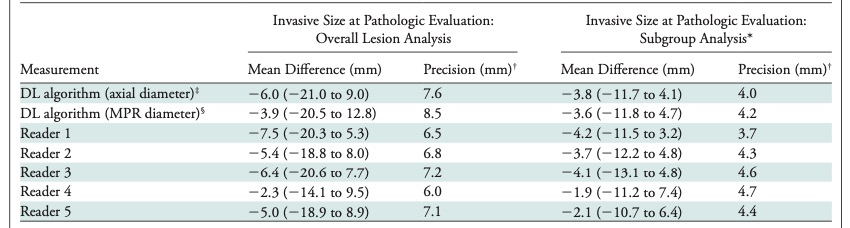
表 Bland-Altman分析DL算法、放射科医师和病理评估的差异结果。
深度学习算法对表现为亚实体病变的肺癌实性成分的自动测量与人工测量结果相当,并与病理评估所显示的浸润性成分大小一致性良好。通过进一步细化及集中训练分割失败的病变,DL算法可以在肺部病变实性成分的测量中具有更广泛的适用性,这为进一步减轻放射科医生负担并提高诊断准确性提供了理论和技术上的支持,为人工智能在肺部病变的应用拓宽了道路。
原文出处:
Yura Ahn,Sang Min Lee,Han Na Noh,et al.Use of a Commercially Available Deep Learning Algorithm to Measure the Solid Portions of Lung Cancer Manifesting as Subsolid Lesions at CT: Comparisons with Radiologists and Invasive Component Size at Pathologic Examination.DOI:10.1148/radiol.2021202803


