Cell Death & Differentiation:孙强/黄红艳/刘良团队合作揭示新冠患者淋巴细胞减少症发生的新机制
时间:2021-05-14 16:01:58 热度:37.1℃ 作者:网络
新型冠状病毒(SARS-CoV-2)导致新冠肺炎(COVID-19),如今仍在全球肆虐。新冠肺炎患者常伴随淋巴细胞减少症的临床表征,外周血淋巴细胞计数的下降程度和持续时间也成为衡量疾病严重程度和死亡风险的预测指标。然而,新冠病毒感染导致的淋巴细胞减少症的发生机制仍不清楚。
近日,北京生物工程研究所孙强研究员与首都医科大学黄红艳教授、华中科技大学同济医学院刘良教授团队合作,在 Cell Death & Differentiation 期刊发表了题为:SARS-CoV-2 spike protein dictates syncytium-mediated lymphocyte elimination 的研究论文。
该研究首次发现在新冠肺炎患者肺组织中普遍存在多核合胞体与淋巴细胞形成的异质性cell-in-cell结构,并证明这种独特的结构是由新冠病毒感染过程中S蛋白介导肺上皮细胞发生融合并内化淋巴细胞形成,该结构的形成能够导致内化淋巴细胞的死亡。同时,候选抗病毒药物可以有效抑制S蛋白介导的细胞融合及合胞体内化淋巴细胞的cell-in-cell结构的形成。
研究人员首先在新冠肺炎病人肺组织样本病理切片中观察到多核合胞体普遍存在,并且与淋巴细胞形成的异质性cell-in-cell结构,通过与病人外周血临床信息进行相关性分析发现多核合胞体的形成及其与淋巴细胞异质性cell-in-cell结构的形成均与外周血淋巴细胞数目负相关。

图a显示新冠病人肺组织样本中多核合胞体与免疫细胞形成的cell-in-cell结构;图b, c显示每个病人肺组织样本中多核合胞体数目及其与免疫细胞形成的cell-in-cell结构的数目;图d显示每个病人外周血淋巴细胞数目临床信息;图e, f显示多核合胞体数目及其与免疫细胞形成的cell-in-cell结构的数目与外周血淋巴细胞数目的相关性。
研究人员利用动态显微成像(time lapse microscopy)发现,S蛋白的表达能够诱导表达ACE2受体的细胞迅速发生融合形成合胞体细胞,并且可大量内化多种免疫细胞形成异质性cell-in-cell结构。异质性cell-in-cell结构的形成会最终导致内化免疫细胞的死亡。进一步分子机制研究证实,S蛋白介导的膜融合是由其S1/S2切割位点中的双精氨酸基序决定的,该序列保守存在于大多数高传染病毒的表面糖蛋白结构中。
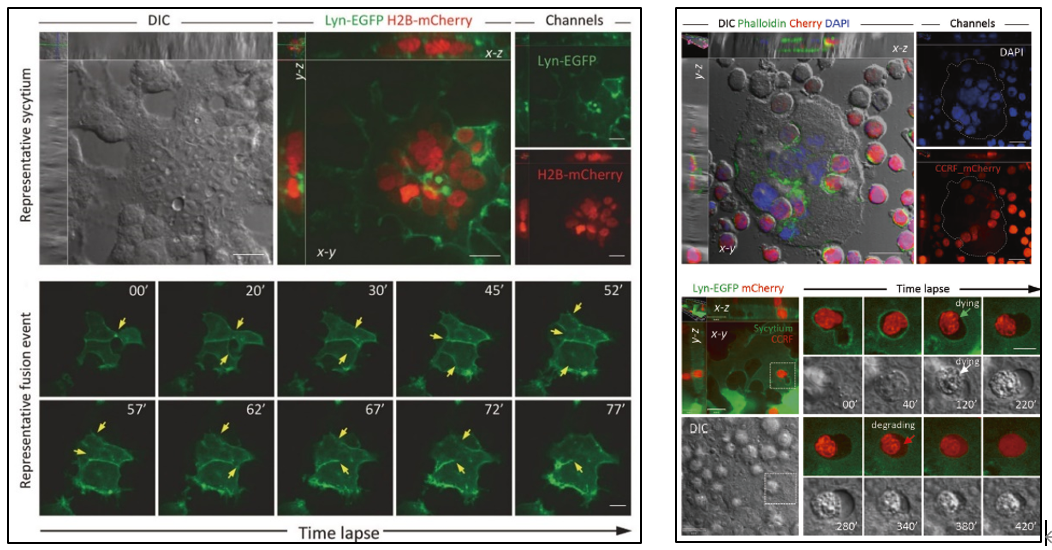
左图显示S蛋白介导的表达ACE2受体细胞形成多核合胞体的过程,右图显示多核合胞体内化免疫细胞并介导免疫细胞死亡的过程。
本研究首次提出新冠病毒S蛋白双精氨酸位点介导的细胞融合能够内化免疫细胞,通过形成异质性cell-in-cell结构“杀死”免疫细胞,从而导致新冠感染病人淋巴细胞减少症的出现。
本研究与4月7日在 Nature 发表的:Drugs that inhibit TMEM16 proteins block SARS-CoV-2 Spike-induced syncytia 的论文[3]相互呼应,均证明了S蛋白诱导的多核合胞体形成可能是新冠肺炎发病机制的基础,并可能成为潜在的治疗靶点。
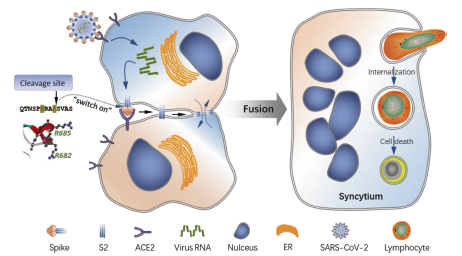
新冠S蛋白双精氨酸位点介导的细胞融合及内化清除免疫细胞过程模式图
该论文第一作者为北京生物工程研究所研究助理张峥嵘,助理研究员郑幽,助理研究员牛祖彪,博士研究生张波,助理研究员王晨曦,陆军军医大学西南医院教授姚小红。北京生物工程研究所孙强研究员、首都医科大学北京世纪坛医院黄红艳教授、华中科技大学同济医学院刘良教授为该论文的共同通讯作者。
该研究特别致谢陆军军医大学西南医院卞修武院士、意大利Lazzaro Spallanzani国家传染病研究所Mauro Piacentini教授、Del Nonno Franca教授、意大利罗马Tor Vergata大学Gerry Melino教授以及第二军医大学赵平教授、彭浩然讲师在新冠病人临床样本收集和新冠病毒活毒感染实验等各个方面提供的大力支持!
原始出处:
Zhang, Z., Zheng, Y., Niu, Z. et al. SARS-CoV-2 spike protein dictates syncytium-mediated lymphocyte elimination. Cell Death Differ (2021). https://doi.org/10.1038/s41418-021-00782-3.


