SARS-CoV-2疫苗混和接种可能更有效
时间:2021-07-27 23:17:44 热度:37.1℃ 作者:网络
异源SARS-CoV-2疫苗具有较强的免疫力
根据据最近的免疫原性研究,异源剂量与基于腺病毒的ChAdOx1(阿斯利康)疫苗以及mRNA疫苗相比,诱导了比同源ChAdOx1疫苗系列更强的免疫反应。
尽管成功开发了多个针对冠状病毒SARS COV-2的疫苗,关注的变种的持续出现和全球范围内的疫苗分布有限继续限制了疫苗的有效性。全球疫苗面临的一个新问题是,与腺病毒疫苗相关的血栓形成和血小板减少综合征等罕见事件的发生。这导致阿斯利康的ChAdOx1-nCoV-19(ChAd)疫苗在许多国家停止销售,同时也引发了人们对疫苗犹豫不决的激增。
在最近的Nature杂志上,Barros Martins等人和Schmidt等人的研究利用了一些欧洲国家停止ChAd疫苗接种后产生的特殊异源prime-boost疫苗,这使得部分接种疫苗的人可以选择用mRNA疫苗(BNT162b2(BNT),来自辉瑞生物科技公司);或mRNA-1273,来自Moderna)。

Barros Martins等人报告,与同源ChAd-ChAd接种获得的结果相比,ChAd-BNT接种策略导致针对SARS-CoV-2棘突蛋白的免疫球蛋白G(IgG)和IgA免疫应答显著增强,并且具有鲁棒性,抗SARS-CoV-2α(B.1.1.7)、β(B.1.351)和γ(P.1)变体的中和抗体滴度增加20倍至60倍以上。这些中和效价大约比BNT-BNT剂量组血清中的效价高三倍(尽管剂量1和剂量2之间的间隔不同),IgG和IgA亚类的效价更高。
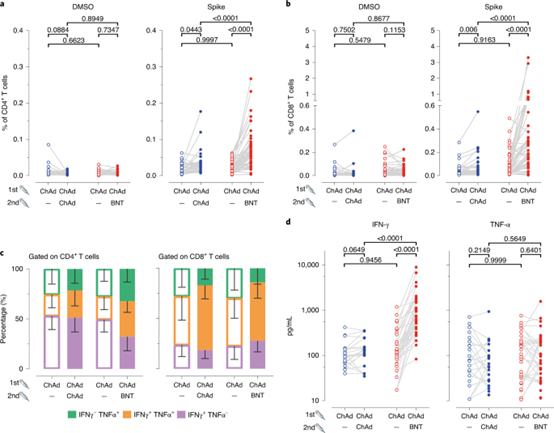
与同源ChAd/ChAd疫苗相比,异源ChAd/BNT疫苗诱导更强的抗SARS-COV-2棘突T细胞应答。
Schmidt等人在ChAd–mRNA(BNT162b2或mRNA-1273)或mRNA–mRNA疫苗接种后,显示针对SARS-CoV-2棘突蛋白和受体结合域的IgG抗体滴度显著高于同源ChAd–ChAd疫苗接种后。此外,与接种ChAd-ChAd的受试者相比,接种ChAd-mRNA的受试者表现出更多的循环棘突蛋白特异性CD4+和CD8+T细胞以及产生细胞因子的T细胞。

Schmidt等人进一步证明,在ChAd-mRNA组中,具有可比性的多功能、棘突蛋白特异性CD4+T细胞反应,但CD8+T细胞反应更强。
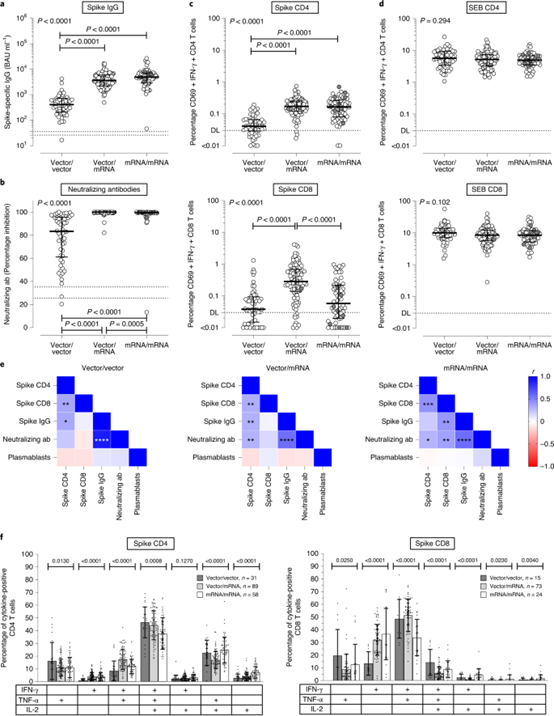
比较接种同源ChAdOx1 nCoV-19载体/载体疫苗(n = 55)、异种ChAdOx1 nCoV-19载体/mRNA疫苗(n = 96)和同源mRNA/mRNA疫苗(n = 62)的个体之间的免疫应答。
最近发表在柳叶刀上的第三项研究提供了额外的证据,证明异源ChAd-mRNA疫苗方法具有良好的耐受性,并能刺激强大的IgG和中和抗体反应。

综合起来,这些研究表明混和接种的免疫原性结果得到改善,并表明这种策略在细胞反应和中和变体方面可能优于同源的prime-boost方案。
正如这些新的研究所表明的那样,验证不同经批准的疫苗的“混合和匹配”剂量的免疫原性和反应原性可能提供一种有助于缓解供应短缺和中断的解决方案。免疫原性结果的改善也表明异源疫苗的方法可以克服单个疫苗平台的局限性。对腺病毒载体疫苗的免疫原性受到预先存在的针对人类接触的常见腺病毒血清型的中和抗体的限制,并可能损害对SARS-CoV-2棘突蛋白的免疫应答能力。广泛的临床前和早期临床研究,特别是针对人类免疫缺陷病毒疫苗的开发,长期以来已经证明了异源prime-boost疫苗策略的潜在免疫优势。中和刺突蛋白特异性抗体能够在动物模型中预防SARS-CoV-2的感染,这些抗体已经作为保护性疫苗反应的标志物,尽管在人类中还没有确切的阈值。虽然血清转化更容易评估,T细胞反应也有助于病毒感染后的清除;这些可能对最近出现的变异产生更强烈的反应,甚至在免疫功能低下的移植受者中没有可检测的抗体反应的情况下也可能产生。结合主要引起体液反应的疫苗(例如,蛋白质基疫苗)和引起强烈细胞反应的疫苗(例如,以病毒载体为基础的疫苗)注入异源的prime-boost平台可能会提高对SARS-CoV-2的免疫广度。动物研究表明,针对SARS-CoV-2的异源疫苗可以改善刺突蛋白特异性1型辅助性T细胞反应,以及刺突蛋白特异性IgA抗体水平。越来越多的证据表明,腺病毒载体的启动子随后在6-12周的时间间隔内增强mRNA是安全的,并且比同源的ChAd-ChAd剂量策略提供更大的体液和细胞免疫应答。在不断出现变异的背景下,这些异源疫苗策略可能进一步增强对SARS-CoV-2疫苗接种的抵抗力。
到目前为止,mRNA疫苗已证明对B.1.1.7变异体具有持续有效性,对B.1.351和P.1循环变异体具有降低但持续有效性。这表明,由mRNA平台诱导的强大的中和抗体反应可能提供克服SARS-CoV-2变异内基因突变所需的体液免疫反应的幅度。这与阿斯利康疫苗的性能形成了对比,阿斯利康疫苗尽管产生了强大的T细胞反应,但对B.1.351变异表现不佳。鉴于当前和未来循环变异的持续威胁,探索替代序列增强策略(例如,核酸平台后的病毒载体)、完成SARS-CoV-2疫苗系列(野生型增强)后的额外疫苗剂量的研究,野生型初级疫苗接种后的增强剂或变异剂量正在进行中或正在研制中。此外,prime和boost之间的间隔可能起着关键作用。这些策略在增强免疫功能低下患者的免疫应答方面可能特别重要。
混合接种策略已经被证明了有利的免疫原性结果,这是通过对原始SARS-CoV-2及其变体的体液反应和细胞反应来衡量的。可能需要这些创新的疫苗剂量计划,以防止疫苗供应中断,并最大限度地提高免疫反应,这反过来将有助于减少新出现的变异的传播,并保护免疫功能低下的人。
原文出处
1.Barros-Martins, J., Hammerschmidt, S.I., Cossmann, A. et al. Immune responses against SARS-CoV-2 variants after heterologous and homologous ChAdOx1 nCoV-19/BNT162b2 vaccination. Nat Med (2021). https://doi.org/10.1038/s41591-021-01449-9
2.Schmidt, T., Klemis, V., Schub, D. et al. Immunogenicity and reactogenicity of heterologous ChAdOx1 nCoV-19/mRNA vaccination. Nat Med (2021). https://doi.org/10.1038/s41591-021-01464-w
3. Immunogenicity and reactogenicity of BNT162b2 booster in ChAdOx1-S-primed participants (CombiVacS): a multicentre, open-label, randomised, controlled, phase 2 trial. https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(21)01420-3/fulltext


