和黄医药与美国Epizyme开展战略合作,将在大中华区进行TAZVERIK的开发与商业化
时间:2021-08-09 11:02:17 热度:37.1℃ 作者:网络

https://www1.hkexnews.hk/listedco/listconews/sehk/2021/0809/2021080900018_c.pdf
8月9日,上午,香港长和旗下的生物医药公司--和黄医药(中国)宣布,将与美国生物制药公司Epizyme开展战略合作,在大中华区进行用于治疗皮样肉瘤和滤泡性淋巴瘤的EZH2甲基转移酶抑制剂TAZVERIK®的研究、开发、生产以及商业化。此外,和黄医药并取得为期四年的认股权证,可认购Epizyme的股份。
根据协议条款,和黄医药将负责TAZVERIK®在大中华区的开发及商业化。Epizyme将收取2,500万美元的首期付款,并合资格额外收取不超过1.1亿美元的开发和监管里程碑付款(涵盖最多八个其他潜在适应症)以及额外收取不超过1.75亿美元的销售里程碑付款。
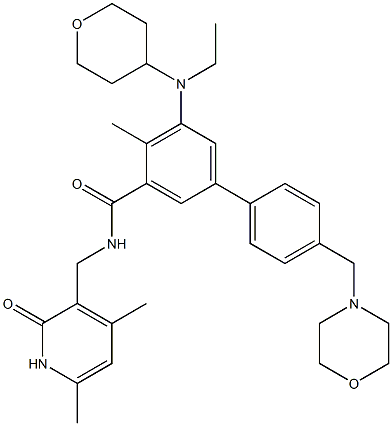
Tazemetostat分子结构式(图片来源:Chemical Book)
TAZVERIK(Tazemetostat)是由Epizyme开发的EZH2甲基转移酶抑制剂,已获美国食品药品监督管理局(“FDA”)批准用于治疗某些上皮样肉瘤(ES)患者和某些滤泡性淋巴瘤(FL)的患者。 Tazemetostat是FDA批准的首个EZH2抑制剂,2019年12月获得了FDA肿瘤药物顾问委员会(ODAC)全票(11-0)通过的支持,也是FDA批准的首个上皮样肉瘤治疗药物。上皮样肉瘤是一种罕见的、生长缓慢的软组织肉瘤型,主要发生在年轻人中,好发于20~40岁青壮年。根据美国《国家综合癌症网络指南》,每年约有13,000名患者被诊断患有软组织肉瘤,相应的死亡人数为5,100。目前,主要的治疗方案有手术切除、化疗或放疗。。据信上皮样肉瘤占所有软组织肉瘤的1%。上皮样肉瘤患者的五年总生存率取决于肿瘤分期,范围为25-60%。研究发现,超过90%的上皮样肉瘤患者具有基因突变,即INI-1功能丧失,使其可以接受新型EZH2抑制剂TAZVERIK的治疗。
此外,Epizyme亦合资格收取根据TAZVERIK®在大中华区的年度净销售额计算介于10%的中位数至20%的低数位之特许权使用费。此外,和黄医药取得为期四年的认股权证,以按每股股份11.50美元的价格购买金额不超过6,500万美元的Epizyme股份。
和黄医药首席执行官贺隽先生(Mr.ChristianHogg)表示:“我们认为TAZVERIK®的活性以及其控制某些基因表达的表观遗传学机制可与我们一系列的创新肿瘤学药物联合用药,具有高度互补性和潜在的协同效益。”“TAZVERIK®潜在的广泛适用范围和更佳的安全性,在用作联合疗法时可进一步抑制肿瘤的生长和转移。是次合作将加快探索EZH2抑制在多种肿瘤类型(包括恶性血液肿瘤和实体瘤)中的临床潜力。我们深信,Epizyme与和黄医药在实现这些机会方面具备独一无二的优势,从而迅速惠及更多的中国境内外的患者。”
和黄医药上周五收报66港元,今日早盘上涨1.5%,过去一个月升17%,较公司6月底上市股价40.1港元高近65%。和黄医药近期公布的中期业绩显示,2021年上半年,总收入增长47%至1.574亿美元;肿瘤/免疫业务综合收入增长161%至4,290万美元。公司的中国肿瘤商业团队规模已扩大至约540名员工(2020年底:约390名),覆盖2,500多家肿瘤医院和逾29,000名肿瘤科医生。


