JNNP:低代谢状态:肌萎缩侧索硬化预后较好的预测因子
时间:2021-08-14 20:02:17 热度:37.1℃ 作者:网络
肌萎缩侧索硬化症(ALS)是一种影响运动神经元并导致包括呼吸肌在内的骨骼肌瘫痪的神经退行性疾病。肌萎缩侧索硬化症的病因仍不清楚,很可能是多因素的。环境和遗传因素也可能影响疾病的自然史。疾病的发病年龄在58-68岁之间,首次出现症状后的平均预期寿命为3-5年。研究表明,营养状况和能量需求是影响生存率和生活质量的关键预后因素,并且需要在诊断时进行早期评估。体重指数(BMI)和血脂水平均与ALS患者的预期寿命相关。疾病期间可能出现的负面预后因素是体重减轻和营养不良,这导致能量摄入和总能量消耗(TEE)之间的不平衡。能量摄入不足可能与多种因素有关,包括吞咽困难、厌食、肌肉缺陷、进食困难、抑郁和认知障碍。能量摄入不足可能加剧疾病进展并加速肌肉分解代谢。

(休息时的能量消耗)REE是在基础条件下保持细胞、组织、器官和系统完整性和功能所需的能量。 REE是TEE最重要的组成部分,此外还包括体力活动和饮食诱导的产热的能量消耗。导致REE变化的因素包括年龄、种族、性别、体重、身高、无脂质量(FFM)(骨骼肌质量和器官质量)、脂肪质量、激素状态和交感神经系统。测量静息能量消耗(mREE)的金标准是间接量热法(IC),但这个工具并不总是可用的。因此,临床医生必须经常使用公式(cREE)估算能量消耗。然而,ALS患者的cREE没有经过验证的公式,一些研究建议该公式应包括游离脂肪质量、性别和年龄,因为它们似乎可以更好地预测能量需求。更具体地说,2017年欧洲学会肠外和肠内营养(ESPEN)指南建议使用哈里斯-本尼迪克特(H-B)公式估算ALS患者和其他疾病患者的静息能量消耗。
ALS患者的mREE和TEE值仍存在广泛争议。尤其是ALS患者的mREE在相关百分比的患者中出现严重改变(高代谢)。这种变异会对疾病的进展速度和持续时间产生临床影响,并且可能已经出现在症状前阶段。大多数研究表明,41%–60%的患者的高代谢与较低水平的运动神经元受累、更快的功能衰退和更短的生存期相关。尽管代谢改变的原因尚不清楚,已经假设了几种机制,包括线粒体功能障碍、肌肉代谢紊乱或氧化应激的存在。文献目前缺乏ALS患者低代谢的存在及其后果的信息。因此,本回顾性研究的目的是在ALS患者转诊队列中评估低代谢状态与正常代谢和高代谢状态的患病率,并将其与临床表型、进化率和生存率相关联。本文发表在《神经病学,神经外科学和精神病学杂志》上(Journal of Neurology, Neurosurgery & Psychiatry)。

这项回顾性研究包括2011年1月至2017年12月期间通过间接量热法对ALS患者进行代谢测定的一组连续患者。患者入院并定期随访。ALS的诊断是根据经修订的El Escorial标准进行的。此外,所有受试者在登记时都进行了甲状腺功能评估。所有纳入研究的患者均同意数据处理。对于每位患者,考虑人口统计学和临床数据、营养和代谢评估以及体重组成。具体而言,发病年龄、性别、发病部位、诊断延迟、肌萎缩侧索硬化症功能评定量表修订版(ALSFRS-R)首次评估总分及其斜率、强迫肺活量、遗传研究、测量体重和身高、计算BMI、测量和估计基础代谢、总身体含水量(TBW),报告了细胞内水(ICW)、细胞外水(ECW)、脂肪量(FM)和FFM、诊断时的血清总胆固醇水平、从发病到胃造口(经皮内镜胃造口术(PEG))放置的时间、机械通气(NIV)和静脉放置的开始时间以及从发病到存活的时间。所有招募的患者在四个中心进行随访。
根据REE,队列的人口统计学和临床特征
测量体重和身高的人体测量参数。用机械秤测量体重。仪器的准确度为100g。使用水平仪(SECA 217)测量身高,患者直立,重量均匀分布在双脚、肩胛骨和臀部。头部与视距仪的水平杆平行。仪器的精度为1毫米。使用间接热量计(Vmax sensormedics或Vyntus CPX Carefusion)测量基础代谢率(mREE)。为了使测量标准化,患者在检查前禁食12小时。建议患者在测量前12小时内不要进行剧烈或轻微的体力活动。除必要的药物外,检查后服用药物。
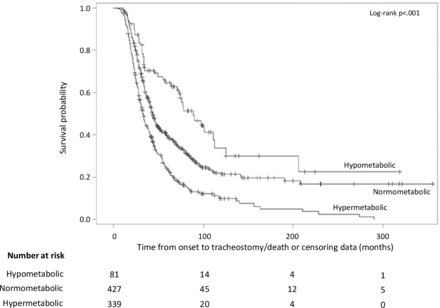
根据代谢状态绘制Kaplan-Meier生存曲线
此外,患者在检查前应避免饮用含咖啡因的饮料或吸烟。开始测量前,要求患者躺在床上,持续10–20分钟,同时等待仪器重新校准。在无外部刺激的情况下,在热中性环境下对患者进行评估。使用标准化气体校准后,将顶篷置于患者头部上方,然后准确测量呼出空气并计算REE。在开始收集数据之前,需要5分钟的冲洗时间。在达到稳定平台20分钟后接受检查。产生的CO2量与消耗的O2量之比。这些数据可以深入了解了受试者在测量过程中使用的能量基质。在7到14小时的禁食期内,预期比值在正常情况下的0.68到0.90之间。值>1可能表示脂肪生成,而值<0.7可能反映糖异生或酮生成。然后将所得结果(mREE)与H-B预测公式(cREE)进行比较,以确定是否存在改变。高代谢定义为[(mREE−cREE)/cREE]×100 ≥10% and hypometabolism as [(mREE−cREE)/cREE]×100 ≥−10%。
这项研究包括847名ALS患者,发病年龄中位数为63.79岁(IQR 55.00–71.17),男女比例为472/375(1.26),延髓/脊柱比例为258/589(0.44)。考虑到意大利和法国队列之间的比较,前者报告发病年龄明显较低,首次评估时功能和呼吸状况明显最差。此外,与法国受试者相比,意大利受试者的BMI显著降低,非体脂FFM显著升高(单位:kg和%),脂肪含量FM显著降低(单位:kg和%)。
考虑到意大利和法国队列之间的比较,前者报告发病年龄明显较低,首次评估时功能和呼吸状况明显最差。此外,与法国受试者相比,意大利受试者的BMI显著降低,FFM显著升高(单位:kg和%),FM显著降低(单位:kg和%)。根据mREE将患者分为三组:10%为低代谢,50%为正常代谢,40%为高代谢。比较各组之间的变量,发现在发病年龄、ALSFRS-R总分、男性/女性比率以及C9ORF72扩张的存在方面存在显著差异。具体而言,高代谢组患者发病年龄明显大于正常代谢组患者,男性患者和C9ORF72扩张患者的比例明显高于正常代谢组患者。此外,与正常代谢和高代谢受试者相比,低代谢组首次评估时ALSFRS-R得分显著降低。发病部位与代谢状态之间无相关性。代谢水平与三组甲状腺激素水平无显著差异。根据代谢状态对身体成分进行的分析表明,各组间FFM百分比和FM百分比存在显著差异。具体而言,低代谢患者报告的FFM百分比最高,FM百分比最低。比较低代谢、正常代谢和高代谢患者从发病到达到标志型临床事件的时间,如进行胃造口术(PEG),发现三组之间存在显著差异。
根据人口学和临床特征,三个代谢组在发病年龄、ALSFRS-R总分、男性/女性比率方面存在显著差异,均高于高代谢组。研究首次表明,携带C9ORF72扩增的ALS患者更常与高代谢表型相关。这种基因改变可能导致高代谢患者的预后恶化。评估了不同代谢表型对ALS预后的影响。具体而言,考虑到经典的ALS标志性临床事件,如从发病到PEG放置的时间以及从发病到NIV或IV开始的时间,低代谢组在比其他两组更长的时间间隔内达到所有不同的终点,显示出令人惊讶的更好的预后。低代谢患者的诊断延迟显著延长也突出了这一结果,这反过来又与更好的预后相关。 目前,ALS的高代谢仍然无法解释。
总之,ALS的低代谢并不少见,与正常代谢和高代谢受试者相比,低代谢与疾病进展较慢和生存率更好相关。
Cattaneo M, Jesus P, Lizio A, et al The hypometabolic state: a good predictor of a better prognosis in amyotrophic lateral sclerosis Journal of Neurology, Neurosurgery & Psychiatry Published Online First: 05 August 2021. doi: 10.1136/jnnp-2021-326184


