珐博进 Pamrevlumab 我国获批临床,治疗胰腺癌、肺纤维化
时间:2021-08-20 11:03:27 热度:37.1℃ 作者:网络
近日,CDE官网显示:FibroGen(珐博进)公司研发的抗体药物 Pamrevlumab 两大适应症进入临床试验默示许可,用于治疗特发性肺纤维化(IPF)以及局部进展期无法切除的胰腺癌(LAPC)患者。
Pamrevlumab是FibroGen公司开发的首创抗体全球首创(first-in-class)CTGF抑制剂,CTGF是纤维化和增殖性疾病中的常见因子,此类疾病的特征是持续和过度的瘢痕形成,可导致器官功能障碍和衰竭。其中许多疾病几乎没有有效的治疗选择,包括特发性肺纤维化(IPF)、胰腺癌、杜氏肌营养不良(DMD)。
FDA已授予Pamrevlumab治疗局部晚期不可切除性胰腺癌(LAPC)、特发性肺纤维化(IPF)、杜氏肌营养不良(DMD)的孤儿药资格。此外,FDA还授予了Pamrevlumab治疗IPF、LAPC的快速通道资格。
根据Clinicaltrials.gov网站,pamrevlumab目前正在开展3项随机、双盲、安慰剂对照的3期临床试验,分别针对特发性肺纤维化、非卧床(non-ambulatory)杜氏肌营养不良症(DMD)和局部晚期不可切除的胰腺癌。Pamrevlumab正在推进治疗 IPF 和胰腺癌的 3 期临床开发,同时正在进行一项治疗杜氏肌营养不良症(Duchenne Muscular Dystrophy,DMD)的 2 期实验。详细:Pamrevlumab治疗局部晚期胰腺癌的III期临床试验正式开始
Pamrevlumab已经获得治疗IPF、胰腺癌和DMD的孤儿药资格认定,还获得了FDA授予治疗IPF和局部晚期不可切除胰腺癌患者的快速通道资格认定。
在所有试验中,迄今为止Pamrevlumab一直表现出良好的安全性和耐受性。
Pamrevlumab国际研究数据
LAPIS是一项多国、随机、双盲、安慰剂对照III期研究,将评估新辅助Pamrevlumab联合吉西他滨和nab-紫杉醇治疗。在这些研究中,接受Pamrevlumab联合治疗的患者中,手术切除率较高,中位生存率具有统计学意义。研究的主要终点是总生存期(OS)。
3期临床试验(NCT03941093)目前正在进行,该试验将随机选择256名患者,在手术前接受Pamrevlumab(结缔组织生长因子(CTGF)活性的一级抑制剂)或安慰剂和化疗双重制剂。双主要终点是总生存率(OS)的改善和达到R0或R1切除的患者比例。
在第3阶段研究中,患者将被随机1:1接受最多6个周期的治疗。在第一个周期的第1天、第8天和第15天,以及随后每个周期的第1天和第15天,静脉注射Pamrevlumab,剂量为35 mg/kg。在每个28天周期的第1天、第8天和第15天,静脉注射nab-紫杉醇和吉西他滨,剂量为标准剂量(分别为125 mg/m2和1000 mg/m2)。
在6个周期的新辅助治疗后,患者将通过探索性手术评估R0或R1切除的可能性。如果符合条件,根据试验方案,手术需要在第6周期后4周到8周之间进行。手术样本将被收集和分析,以寻找生物标志物,试验的次要终点包括无进展生存率(PFS)、生活质量和患者报告的结果。
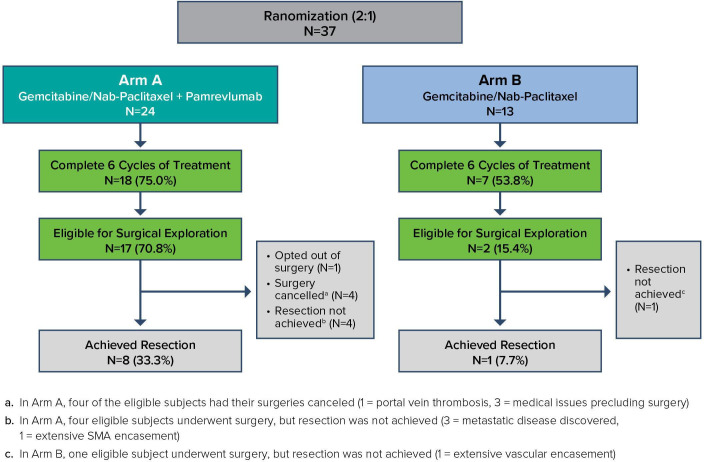
在第3期研究之前,最近在ESMO Open上发表了有趣的第1/2期研究结果。在本研究中,不能切除LAPC的患者被随机分为2:1接受吉西他滨加nab-紫杉醇联合Pamrevlumab(n=24)或不联合Pamrevlumab(n=13)。新辅助治疗方案进行6个周期,然后评估手术合格性。
在本研究中,Pamrevlumab、nab-紫杉醇和吉西他滨联合治疗的PFS为14.1个月(95%可信区间,8.2-18.4),而单独接受化疗的PFS为11.6个月(95%可信区间,3.9-19.0)。在所有患者中,无论是否符合手术条件,Pamrevlumab的1年生存率为75%,而单纯化疗的1年生存率为85%。Pamrevlumab组的中位OS为19.3个月,而无Pamrevlumab组为19.0个月。
当探索那些被淘汰并有资格接受手术的患者时,他们的生存率有明显的差异。总的来说,根据美国国家综合癌症网络标准,16%的患者在放射学上被降级,其中5例在Pamrevlumab组(21%),1例在单纯化疗组(8%)。
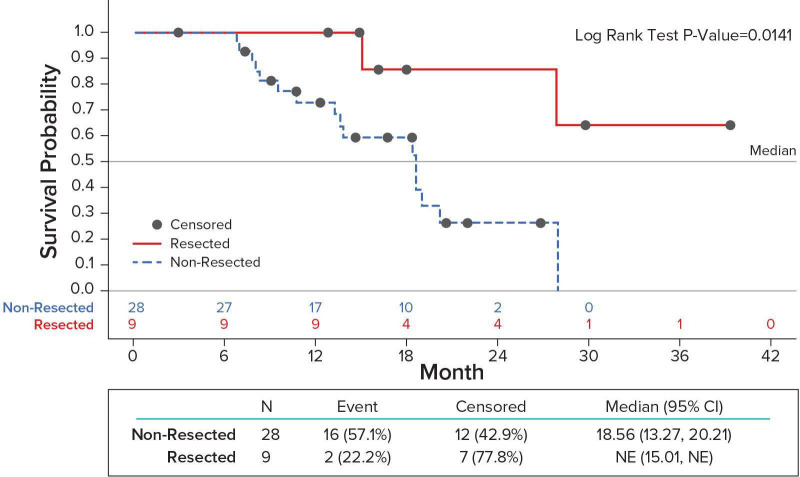
在那些符合手术探查条件的患者中,包括17名接受Pamrevlumab治疗的患者,而仅2名接受单纯化疗的患者,无论最初是否接受治疗,总生存期为27.03个月(95%CI,15名未达到)。在那些没有资格接受探索性手术的患者中,包括7例接受Pamrevlumab治疗和11例单独接受化疗,患者的总生存期为18.4个月(95%CI,10.6-20.2)。
继续接受手术的患者的中位OS没有达到,这突出了LAPC患者达到手术切除的重要性。切除组包括8例接受Pamrevlumab治疗的患者和1例单独接受化疗的患者。不符合手术切除条件的患者(16例用Pamrevlumab治疗,12例单用化疗)的中位生存期为18.56个月(95%可信区间13.2-20.2)。
与单纯化疗相比,Pamrevlumab组完成6个疗程的患者更多(分别为75%和54%)。两组之间的毒性模式相似。总的来说,38%的Pamrevlumab组患者出现严重不良事件,而单独接受化疗的患者出现严重不良事件的比例为46%。这项研究的作者没有注意到加入Pamrevlumab后毒性的增加。
原始出处:
Picozzi V, Alseidi A, Winter J, Pishvaian M, Mody K, Glaspy J, Larson T, Matrana M, Carney M, Porter S, Kouchakji E, Rocha F, Carrier E. Gemcitabine/nab-paclitaxel with pamrevlumab: a novel drug combination and trial design for the treatment of locally advanced pancreatic cancer.ESMO Open. 2020 Aug;5(4):e000668. doi: 10.1136/esmoopen-2019-000668


