科普:抗体的概念与分类、结构
时间:2021-09-19 20:24:09 热度:37.1℃ 作者:网络
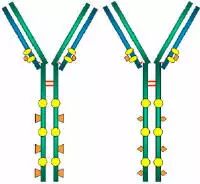
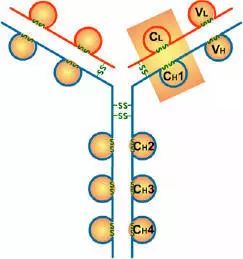
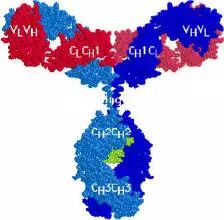
抗体,也叫免疫球蛋白 (Ig),是一种能特异性结合抗原的糖蛋白,而抗原是在易感染动物体内引发抗体产生的物质。在体内,抗体是由于外 源性分子的侵袭而产生的。抗体以一个或者多个 Y 字形单体存在,每个 Y 字形单体由 4 条多肽链组成,包含两条相同的重链和两条相同的轻链。轻链和重链是根据它们的分子量大小来命名的。Y 字形结构的顶端是可变区,为抗原结合部位。
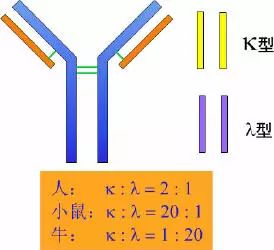
任何一个抗体的轻链都可以分为κ或λ型(基于小分子多肽结构上的差异),每一个抗体的重链则决定了它的类或型。
一、抗体与免疫球蛋白
抗体(antibody,Ab):是由抗原进入机体刺激B细胞分化增殖为浆细胞而合成并分泌的一类能与相应抗原发生特异性结合并产生免疫效应的含有糖基的球蛋白。抗体分布于体液(血液、淋巴液、组织液及粘膜的外分泌液)中,主要存在于血清内。

1964年世界卫生组织召开会议,将具有抗体活性及化学结构与抗体相似的球蛋白统称为免疫球蛋白(immunoglobulin,Ig)。免疫球蛋白除分布于体液中之外,还可存在于B细胞膜上。
现代免疫学认为,抗体与免疫球蛋白是等同的概念;只是抗体侧重于其生物学活性的描述,而免疫球蛋白侧重强调其化学结构。
二、抗体的分类
1、免疫球蛋白可分为两种类型:
(1) 分泌性免疫球蛋白:存在于血清、体液以及分泌液中,具有抗体的各种功能。
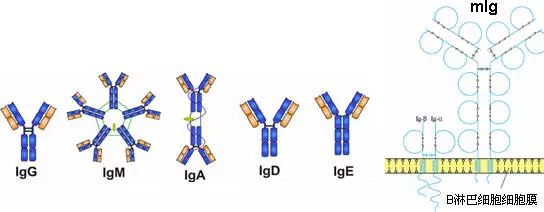
(2) 膜型免疫球蛋白:位于B淋巴细胞的表面,即膜表面免疫球蛋白(mIg),是B淋巴细胞的抗原识别受体(BCR)。
2、根据所对应的抗原分:

3、根据有无抗原刺激分:

4、根据与抗原反应的性质分:

5、根据抗原性分:
三、免疫球蛋白的理化性质
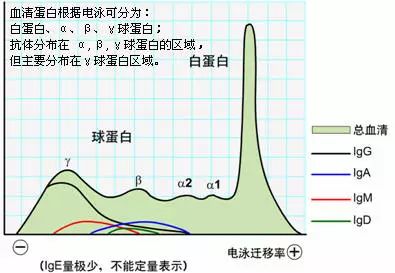
免疫球蛋白是多链糖蛋白,具有蛋白质的通性,对物理及化学因素敏感,不耐热,在60~70℃时即被破坏,能被多种蛋白水解酶裂解破坏,可在乙醇、三氯醋酸或中性盐类中沉淀。因此,通常用50%饱和硫酸铵或硫酸钠从免疫血清中提取抗体。
抗体的结构
一、单体
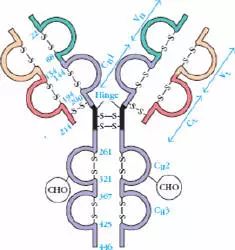
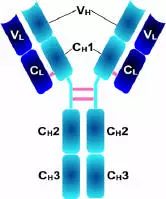
Porter等对血清IgG抗体的研究证明:Ig分子的基本结构是由四肽链组成的。即:由二条相同的分子量较小的肽链(轻链)和二条相同的分子量较大的肽链(重链)组成。
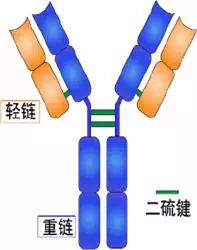
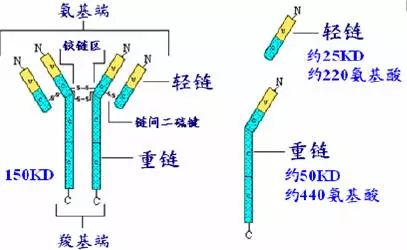
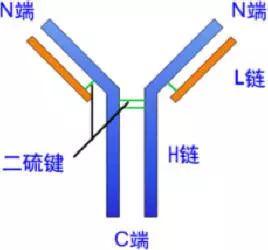
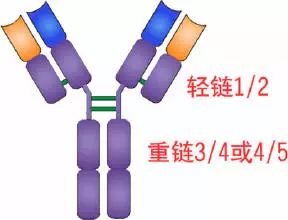
轻链与重链是由二硫键连接形成一个四肽链分子称为Ig分子的单体;单体是构成所有免疫球蛋白分子的基本结构;所有抗体的单体都是四条肽链的对称结构,即:两条糖基化重链(H)和两条非糖基化轻链(L);每条重链和轻链分为氨基端(N端)和羧基端(C端)。
二、轻链和重链
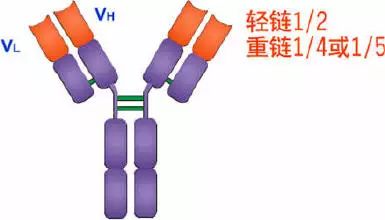
1、轻链(light chain,L链)
由214个氨基酸残基组成,通常不含碳水化合物,分子量为24kD,有两个由链内二硫键组成的环肽,L链可分为:Kappa(κ)与 lambda(λ)2个亚型。
2、重链(heavy chain,H链)
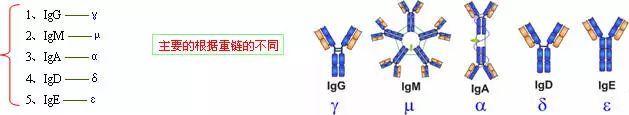
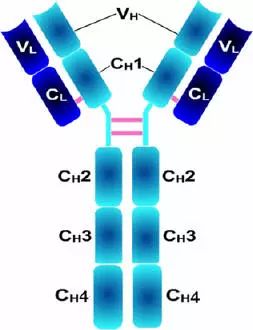
由450-550个氨基酸残基组成,分子量55-75kD,含糖数量不同,4-5个链内二硫键,可分为5类,μ、γ、α、δ、ε链,不同的H链与L链(κ或λ)组成完整的Ig分子。分别称为:IgM,IgG,IgA,IgD和IgE。
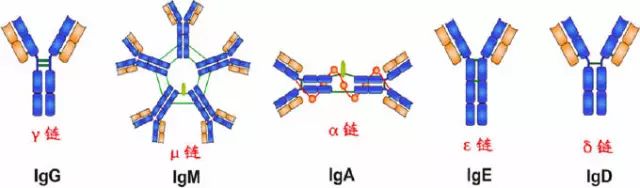
|
三、可变区和恒定区 通过对H链或L链的氨基酸序列比较分析,发现: |
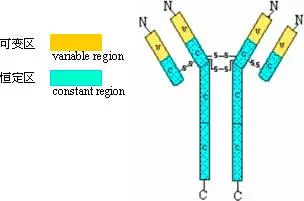 |
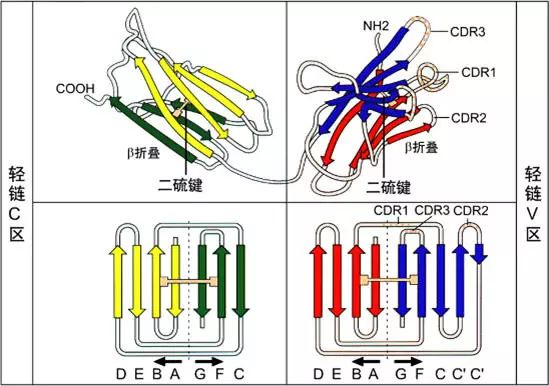
1、可变区(Variable region,V区)
L链N端1/2处(VL)108-111个氨基酸残基,H链N端1/5-1/4处(VH)118个氨基酸残基,V区有一个肽环65-75个氨基酸残基。
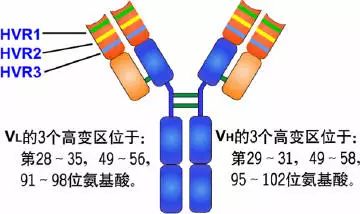
可变区可分为高变区(hypervariable region,HVR)和骨架区(framework region,FR),VL的HVR在24-34,50-56,89-97氨基酸位置。VH的HVR在31-35,50-56,95-102氨基酸位置。分别称为VL和VH的HVR1,HVR2,HVR3。
高变区为抗体与抗原的结合位置,称为决定簇互补区(complementarity-determining region,CDR),VL和VH的HVR1,HVR2,HVR3又分别称为CDR1,CDR2,CDR3,其中CDR3具有更高的高变程度,H链在与抗原结合中起重要的作用。
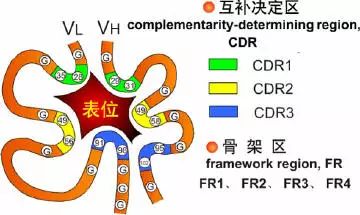
2、恒定区(constant region,C区)
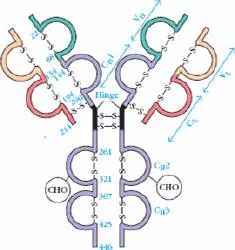
L链C端1/2处,105个氨基酸残基,H链C端3/4-4/5处,331-431个氨基酸残基。
在同一种属动物中是比较恒定的,是制备第二抗体进行标记的重要基础。
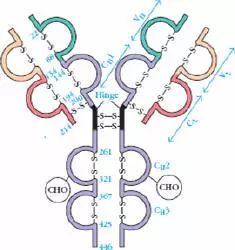
四、功能区
链内二硫键折叠成球形区称为功能区(domain)约由110个氨基酸组成。氨基酸的顺序具有高度的同源性。
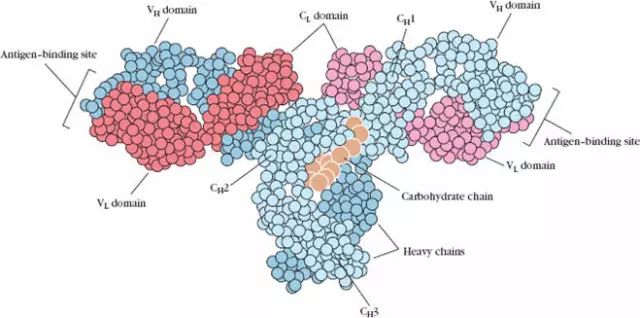
1、L链功能区:2个,(VL,CL各一个)
2、H链功能区:IgG,IgA,IgD,4个(V区1个,C区3个),IgM,IgE,5个(V区1个,C区4个)
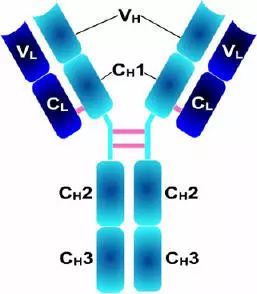
3、功能区的β片层结构:抗体的L链和H链中V区或C区每个功能区的二级结构是反向平行的β片层结构。
4、功能区的作用:
(1)VL和VH是抗原结合的部位。
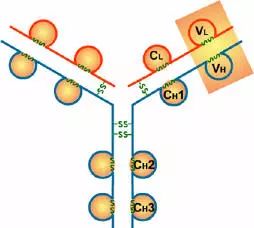
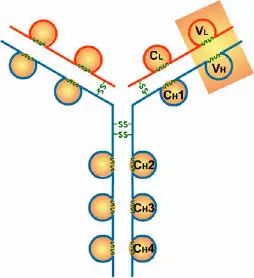
(2)CL和CH1上具有同种异型的遗传标记。
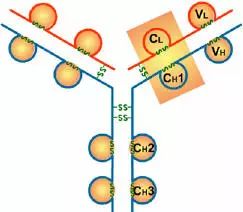
(3)IgG的CH2和IgM的CH3具有补体C1q结合位点;IgG借助CH2部分可通过胎盘
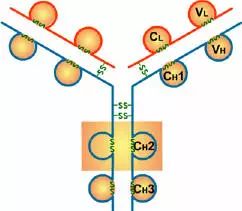
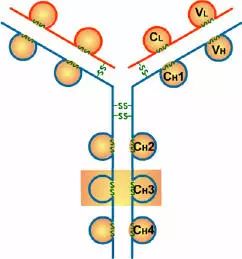
(4)CH3或CH4具有结合单核细胞、巨噬细胞、粒细胞、B细胞、NK细胞Fc段受体的功能,不同的抗体可与不同的细胞结合,产生不同的免疫效应。
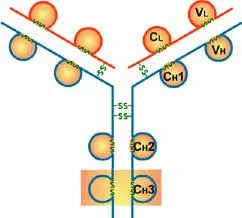
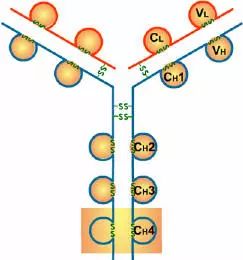
5、铰链区
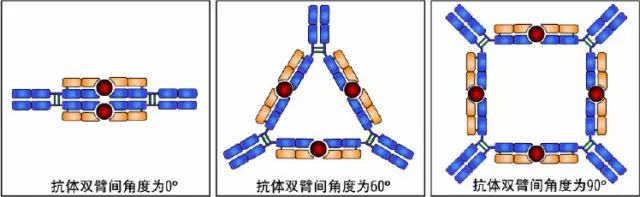
(1)铰链区不是一个独立的功能区,位于CH1与CH2之间;包括H链间二硫键,该区富含脯氨酸,不形成α-螺旋。

(2)当Ab与Ag结合时,铰链区发生扭曲,使Ab的2个抗原结合点更好地与2个抗原决定簇互补。
(3)由于CH2和CH3构型变化,显示出活化补体、结合组织细胞等生物学活性。
(4)含有木瓜蛋白酶、胃蛋白酶的水解位点。
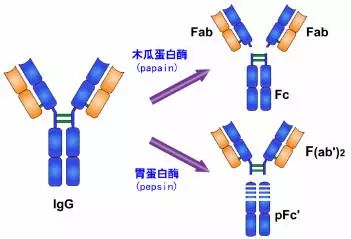
五、酶解片段
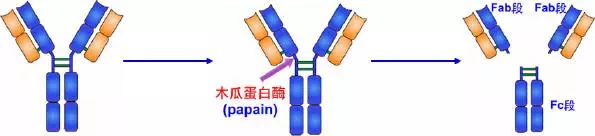
1.木瓜蛋白酶的水解片段
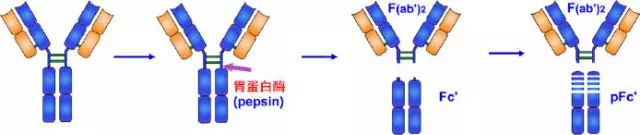
1959年 Porter用木瓜蛋白酶(papain)水解兔IgG分子,将IgG从绞链区二硫键的近N端侧切断,从而将免疫球蛋白裂解为三个片段,即2个相同的Fab段和1个Fc段。每一个Fab段即抗原结合片段(fragment antigen binding,Fab),含有一条完整的L链和H链近N 端侧的1/2。每个Fab段结合抗原是单价的,即只能结合一个抗原决定簇。因此不能连结成较大的抗原抗体复合物,不出现凝集或沉淀现象。Fab中的约1/2 H链部分称为Fd段,约含225个氨基酸残基,包括VH、CH1和部分绞链区。Fc段在低温或低离子强度下可形成结晶,故称为可结晶片段(fragment crystallizable,Fc),Fc段含有两条H链羧基端(C端)的一半,包含CH2和CH3两个功能区,它无抗体活性。Ig在异种间免疫所具有的抗原性主要存在于Fc段,同时Fc段还具有活化补体、亲细胞、通过胎盘和介导与细菌蛋白结合等生物学活性。
2、胃蛋白酶水解片段
1960年Nisonoff等最早用胃蛋白酶水解兔IgG分子,可将IgG从绞链区重链间二硫键近C端切断,将其裂解为大小不等的两个片段。大片段为1个Fab双体,以F(ab')2表示。F(ab')2由一对L链和一对略大于Fd的H链(称为Fd')组成。Fd'约含有235个氨基酸残基,包括VH、CH1和绞链区。
F(ab')2结合抗原为双价,可结合两个抗原决定簇,其结合抗原的亲合力要大于单价的Fab,与抗原结合后可出现凝集或沉淀现象。由于F(ab')2保持了结合相应抗原的生物学活性,又减少或避免了Fc段抗原性可能引起的副作用,因而在生物制品中有实际应用价值。虽然F(ab')2在与抗原结合特性方面同完整的Ig分子一样,但由于缺乏Ig中的Fc部分,故不具备固定补体及与细胞膜表面Fc受体结合的功能。
小片段Fc可被胃蛋白酶继续水解为小分子多肽,以Fc'表示,不再具有任何生物学活性。
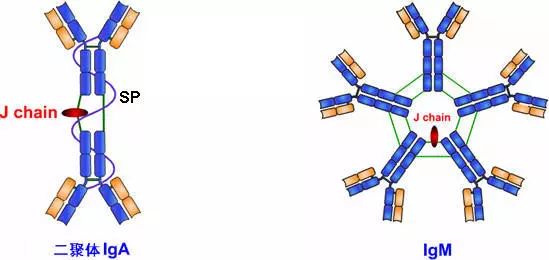
六、J链和分泌成分
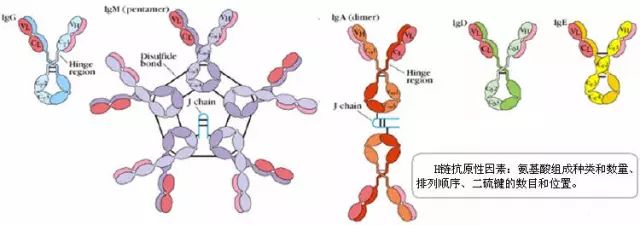
1、J链(joining chain)
(1)存在于二聚体IgA和五聚体IgM中;化学本质为酸性糖蛋白,分子量约15ku,含有8个半胱氨酸残基。
(2)以二硫键连接到μ链或α链的羧基端的半胱氨酸,对抗体二聚体、五聚体的组成及在体内转运具有一定的作用。
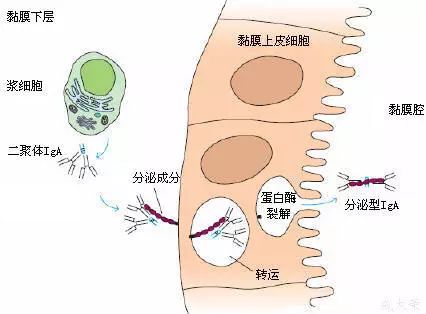
2、分泌成分(secretory component,SC)
(1)是二聚体IgA上的一个辅助成分;
(2)由上皮细胞合成,化学本质为糖蛋白,分子量约为75ku;
(3)以共价形式结合到IgA分子,并一起被分泌到粘膜表面,又称分泌片(secretory piece, SP);
(4)可抵抗外分泌液中的蛋白水解酶对二聚体IgA的降解。

 其N-末端序列变化很大,称此区为可变区(V区);
其N-末端序列变化很大,称此区为可变区(V区); C-末端氨基酸则相对稳定,变化很小,称此区为恒定区(C区)。
C-末端氨基酸则相对稳定,变化很小,称此区为恒定区(C区)。
