Nat Commun: 外泌体递送mRNA,实现对艾滋病病毒的稳定抑制
时间:2021-09-27 10:02:03 热度:37.1℃ 作者:网络
艾滋病(AIDS),全称是获得性免疫缺陷综合征,这是一种由人类免疫缺陷病毒(HIV)引起的、危害性极大的传染病。HIV病毒可以攻击并严重破坏人体免疫系统,因此艾滋病患者常常因免疫能力不足而发生二次感染或罹患肿瘤,这也使得艾滋病患者的死亡率极高。
据联合国艾滋病规划署数据,全球范围内HIV携带者和艾滋病患者人数从2013年末的3430万人增至2018年末的3800万人,且数量仍在快速增长。
虽然,抗逆转录病毒疗法(ART)的不断进步使得艾滋病患者的寿命和预后大大延长,但也会带来严重的副作用,以及出现耐药性。
5'LTR的靶向DNA甲基化为抑制HIV策略提供了一条有希望的途径。特别是为了丰富DNA甲基化,将DNA甲基转移酶与锌指蛋白ZFP-362b融合。然而,理想的药物不仅需要具有HIV-1特异性,还需要具有短期的药代动力学和全身递送能力。
2021年9月20日,贝克曼研究所基因治疗中心的研究团队在 Nature 子刊 Nature Communications 上发表了题为:Exosome-mediated stable epigenetic repression of HIV-1 的研究论文。
该研究开发出了一种靶向 HIV-1 启动子的锌指蛋白(ZFP-362),该蛋白与 DNA 甲基转移酶 3A 的活性结构域融合,以诱导长期稳定的 HIV-1 表观遗传抑制。通过外泌体递送这种抑制性蛋白的mRNA,能够在体内抑制小鼠骨髓、脾脏和大脑中的 HIV 水平,并阻止其复制。
这项研究为外泌体介导的治疗性药物系统递送平台以表观遗传方式抑制 HIV-1 感染铺平了道路。

为了实现对 HIV-1 的稳定转录抑制,研究团队开发了一种表达重组融合蛋白 ZFP 362b-DNMT3A(ZD3A)的载体,它可以借助嵌入的核定位信号(NLS)定位到细胞核。该 ZFP 能够与 HIV-1 的 LTR 启动子内的 NF-kB 双联结合位点结合,并与 DNA 甲基转移酶 3 结构域(3A)融合以生成(ZD3A)。长期感染 HIV-1 的 Jurkat 细胞(CHI-Ju)在转染了 ZD3A 后 HIV-1 转录物表达显着降低,并且一直被稳定抑制。
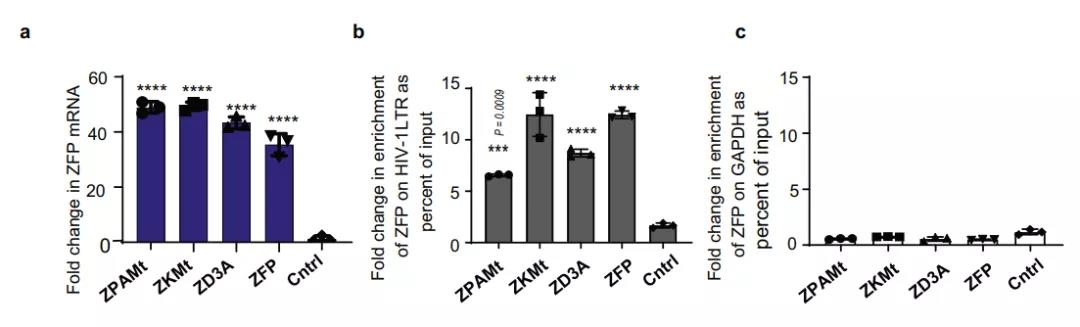
接下来,研究团队构建了几个具有各种阻遏结构域的 ZFP362 融合构建体:与PWWP、ADD 和甲基转移酶的活性域融合成为的 ZPAMt ,以及与 KRAB 和甲基转移酶结构域融合的 ZPAMt。 ZPAMt 和 ZPAMt 有效地抑制了病毒表达。
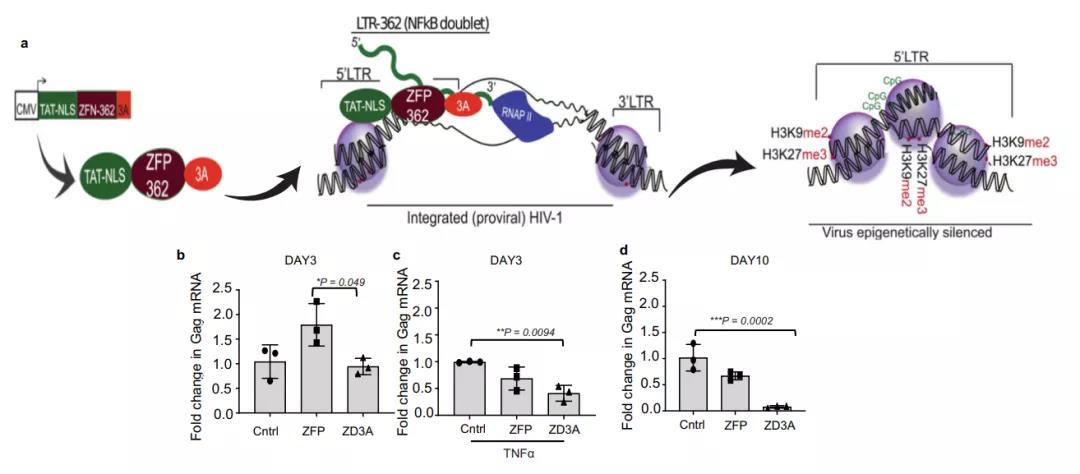
为了确定观察到的沉默所涉及的作用机制,研究团队用 ZPAMt 和 ZKMt 转染细胞并行免疫沉淀,证实了ZFP-362与 HIV-1 启动子的结合。在转染的 CHI-Ju 细胞中,研究团队观察到Gag RNA 的有效抑制,并通过甲基 DNA 免疫沉淀测定法检测到相对于对照增加 HIV-1 LTR 区域 CpG 甲基化的靶向富集。这些数据证实观察到的抑制是ZPAMt 和 ZKMt 将 DNA 甲基化定向到 HIV-1 LTR 的结果。
最后,为了确定 ZPAMt 的抗病毒功效,研究团队将 HIV-1 感染的外周血单个核细胞(PBMC)植入到人源化免疫缺陷小鼠,然后对其进行两周的cART治疗以及ZPAMt注射。结果显示, ZPAMt 显显着稳定抑制了 HIV-1 表达,机制在于5'LTR的显着甲基化。最重要的是,ZPAMt 没有产生任何长期毒性。
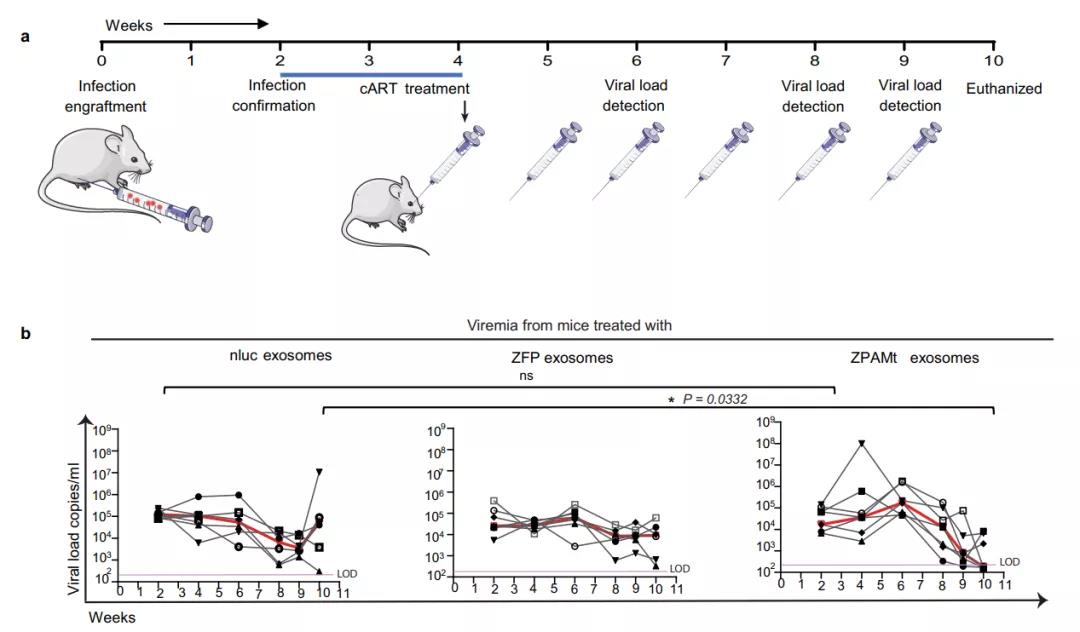
综上所述,这项工作证明了通过外泌体递送重组ZPAMt可以靶向HIV-1,使之表观遗传沉默,并在病毒感染的细胞中诱导抑制表型。该递送系统为未来开发抑制HIV的疗法铺平了道路。
原始出处:
Shrivastava, S., Ray, R.M., Holguin, L. et al. Exosome-mediated stable epigenetic repression of HIV-1. Nat Commun 12, 5541 (2021). https://doi.org/10.1038/s41467-021-25839-2.


