肺动脉高压的全身血管的表现是什么?
时间:2021-10-25 12:01:48 热度:37.1℃ 作者:网络

肺动脉高压(PAH)是一种以肺动脉进行性丧失和重塑为特征的疾病,可导致右心衰竭和死亡。直到最近,PAH 还被视为一种仅限于肺循环的疾病。然而,越来越多的证据表明 PAH 患者也表现出全身血管功能障碍,如肱动脉血流介导的扩张受损、脑血流异常、骨骼肌病和内在肾脏疾病等证据。虽然其中一些异常部分是由于右心室功能不全,但最近的数据支持与 PAH 发病机制背后的遗传和分子事件的机制联系。
PAH患者全身循环中的血管功能障碍
内皮是细胞单层,覆盖整个循环系统的内层。 通过其在血管壁中的位置,内皮通过产生一些能影响血管张力、屏障通透性和循环细胞募集的信号来响应来自血氧和营养成分的变化。 有证据发现很多因素可以影响到PAH 中的内皮功能障碍,如血管生成功能受损、代谢变化和炎症级联反应。实际上,PAH 中内皮功能障碍的一个已知标志是能使血管扩张的物质,如,一氧化氮的产生减少。 大多数研究都集中在肺循环中的内皮功能障碍上,而没有过多关注是否会在循环系统的其余部分中发现类似的异常。
首先,PAH患者的心血管疾病发展。
实际上,与正常人相比,PAH 患者患冠心病(CAD)的风险增加了四倍,冠心病是目前发达国家的主要死因之一。 2001 年至 2012 年间的住院显示,患有 CAD 的 PAH 患者增加(从 15.6% 增加到 22.3%),这与糖尿病、肥胖、全身性高血压和高脂血症等 CAD 危险因素的存在相关。与 PAH 一样,CAD 的血管病理包括血管壁功能失调的重塑、血管反应性受损、管腔阻塞和器官因灌注不足引起的缺血。
最近的一项研究发现,BRD4(溴结构域蛋白 4)是一种转录调节蛋白,通过激活 RUNX2(Runt 相关转录因子 2)和炎性细胞因子与肺动脉肌肉化和钙化相关,参与促进 PAH 患者的 CAD的发生。鉴于其在调节炎症和 DNA 修复中的核心作用,已知有两个过程有助于 PAH 的发病机制,Meloche 及其同事推测异常 BRD4 活性可能是 PAH 中整体血管功能障碍的标志。 BRD4 抑制的治疗价值在临床前研究中得到验证,并且 apabetalone(一种 BRD4 抑制剂)的初步临床研究正在进行中。
其次,PAH患者的脑血管病变情况。
与肺循环一样,脑循环是一个复杂且高度动态的系统,其中内皮细胞对血氧和葡萄糖含量、酸碱状态和血管内容量的变化做出快速反应,以保持脑血流量 (CBF)。 CBF 降低是 2 型糖尿病和心力衰竭的常见发现,并且与认知功能障碍、神经解剖学变化和运动不耐受有关。PAH 患者在休息和运动时的 CBF 较低,这可以通过测量大脑中动脉的平均流速来证明。事实上,运动与全身和大脑血氧含量的下降有关,进一步加剧了 CBF 降低的影响。关于脑血管张力降低背后的机制,PAH患者表现出对血液 Pco2 的脑血管反应性降低,Pco2 通过细胞外 pH 的变化和触发血管活性化合物(如 NO)的内皮生成间接调节血管平滑肌细胞的收缩性。除了降低脑血管对 Pco2 的反应性之外,PAH 患者表现出中枢化学感受器敏感性增加,这进一步减弱了运动引起的 CBF 增加。在一项针对 25 名临床稳定的 PAH 患者的研究中,与健康对照受试者相比,68% 的参与者在从低碳酸血症过渡到高碳酸血症的过程中,微血管 CBF 没有增加。尽管研究都关注 Pco2 的作用,但研究人员推测,脑内皮细胞产生的 NO 减少也可能导致血管张力反应减弱,因为有证据表明西地那非在用于治疗 PAH 的剂量下可以改善脑血管反应性。总之,这些发现强调脑循环中的内在血管功能障碍可能导致认知障碍,并可能导致呼吸困难和睡眠呼吸障碍的感知,这两种情况在 PAH 中很常见。
第三,PAH患者的肾功能情况。
肾功能障碍是原发性高血压、心力衰竭和糖尿病等代谢疾病的常见并发症。心肺-肾相互作用 (CPRI) 描述了一个由适应不良神经激素激活、氧化应激、异常免疫信号和细胞损伤组成的复杂相互网络,其中心脏、肺或肾脏的急性或慢性功能障碍可导致具有临床意义的病理变化在所有三个器官中。CPRI 的互惠性质体现在 PAH 患者的慢性肾脏病患病率高 (4–46%) 和慢性肾脏病患者的 PAH 患病率高 (16%) 。有趣的是,在调整了相关的人口统计学、功能、实验室和血流动力学参数后,发现 PAH 患者的肾功能是预后不良的独立预测因子。这表明 PAH 患者的肾功能障碍具有强大的预后潜力,这不仅归因于 CPRI,而且可能代表 PAH 本身的全身表现。这其中的原因是什么呢?
在低血流量的情况下,肾内皮细胞在通过产生血管活性分子和作为防止白蛋白损失的屏障来保持肾小球血流方面发挥关键作用。微量白蛋白尿的出现是全身内皮功能障碍的早期标志,与多种心血管疾病和代谢紊乱有关。然而,最近有一项研究发现,15-23% 没有肾脏疾病和传统心血管危险因素的 PAH 患者中表现出显着的白蛋白排泄。有趣的是,在两个独立的 PAH 患者队列中,低度白蛋白尿与不良的临床结果相关,与血流动力学的严重程度无关。与年龄和性别匹配的健康对照受试者相比,BMPR2 突变携带者的尿白蛋白排泄量增加,这表明 BMPR2 通路可能对 PAH 患者的白蛋白尿有影响。总之,这些发现强化了密切监测 PAH 肾功能的必要性,即使是临床轻度疾病的患者,但微量白蛋白尿的常规筛查是否具有预测价值或有助于风险分层仍有待确定。
最后,PAH患者的眼睛血管的变化情况。
眼睛是一个高度血管化的器官,对氧气和血流的全身变化很敏感。事实上,在全身代谢疾病中,视网膜血管化异常经常与心脏、肾脏和脑血管的改变一样。在具有 BMPR2 突变的家族性 PAH 患者中已经记录了异常巩膜外血管的存在(图 A)。此外,在 PAH 发展之前,未受影响的携带者中也发现了异常扩张的巩膜外血管。在最近的一项研究中,与男性相比,磁共振成像显示较高的右心室质量和体积与女性视网膜血管直径较宽相关,与体型、糖尿病、胆固醇、年龄和酒精使用无关。虽然这项研究没有涉及 PAH 患者,但它确实允许推测应该进一步探索的视网膜和心肺系统之间的生理交流。
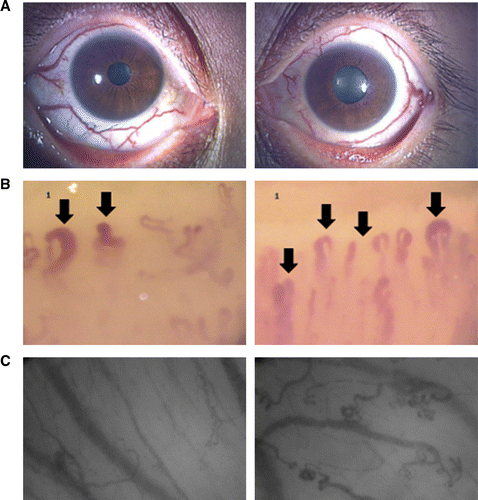
需要指出的是,目前没有数据将眼睛、甲襞和舌下脉管系统的形态变化与迄今为止描述的血管功能障碍机制联系起来。然而,有理由推测这些病变可能表现出功能失调的 EC 和异常的壁结构,这可能代表潜在的全身血管病理。需要进行专门的病理学和分子学研究来确认这些可能性。
参考文献:
Shimony A, Eisenberg MJ, Rudski LG, Schlesinger R, Afilalo J, Joyal D, et al. Prevalence and impact of coronary artery disease in patients with pulmonary arterial hypertension. Am J Cardiol 2011;108:460–464. Malenfant S, Brassard P, Paquette M, Le Blanc O, Chouinard A, Nadeau V, et al. Compromised cerebrovascular regulation and cerebral oxygenation in pulmonary arterial hypertension. J Am Heart Assoc 2017;6:e006126. Said S, Hernandez GT. The link between chronic kidney disease and cardiovascular disease. J Nephropathol 2014;3:99–104. Ho H, Cheung CY, Sabanayagam C, Yip W, Ikram MK, Ong PG, et al. Retinopathy signs improved prediction and reclassification of cardiovascular disease risk in diabetes: a prospective cohort study. Sci Rep 2017;7:41492. Nickel NP, Yuan K, Dorfmuller P, Provencher S, Lai YC, Bonnet S, Austin ED, Koch CD, Morris A, Perros F, Montani D, Zamanian RT, de Jesus Perez VA. Beyond the Lungs: Systemic Manifestations of Pulmonary Arterial Hypertension. Am J Respir Crit Care Med. 2020 Jan 15;201(2):148-157. doi: 10.1164/rccm.201903-0656CI. PMID: 31513751; PMCID: PMC6961748.


