Lancet Neurol:基因替代疗法治疗婴儿症状性脊髓性肌萎缩症1型的有效性与安全性?
时间:2021-10-25 12:02:07 热度:37.1℃ 作者:网络
脊髓性肌萎缩症是一种罕见的常染色体隐性神经性疾病,由存活运动神经元1(SMN1)基因双等位基因功能丧失突变引起,导致运动神经元功能障碍和变性。尽管类似的SMN2基因在脊髓性肌萎缩症中被保留,但1个SMN2单独产生的全长SMN蛋白是不够的。
在SMN靶向治疗出现之前,1型脊髓性肌萎缩症(最严重的出生后表型)患者通常在6个月大时发病,随后运动功能迅速进行性下降,导致死亡或2岁时需要永久通气。脊肌运动功能可以使用费城儿童医院婴儿神经肌肉疾病测试(CHOP INTENT)量表来评估1型萎缩,范围从0-64,得分较低表示运动功能下降。
SMN靶向治疗的有效性显著改善了患者的预后。Nusinesen于2016年12月获得美国食品和药物管理局(FDA)的批准,并于2017年6月获得欧洲药品管理局(European Medicines Agency)的批准,是一种鞘内注射的SMN2外显子7剪接的反义寡核苷酸调节剂。Risplam是一种口服SMN2剪接调节剂,于2020年8月获得FDA的批准,并于3月获得欧洲药品管理局的批准,Nusinesen和risdiam都需要终身治疗。
Onasemnogene abeparvovec(前身为A VXS-101)10于2019年5月获得FDA批准,并于2020年5月获得有条件的EMA批准,是一种旨在针对脊髓性肌萎缩症遗传原因的基因替代疗法。只需一次静脉输注,onasemnogene abeparvovec就可以通过自身互补的腺相关病毒血清9型(AA V9)载体传递人SMN,该载体由混合巨细胞病毒增强子-鸡β-肌动蛋白启动子驱动快速、持续地表达SMN。在第1阶段START研究中,首次评估了onasemnogene abeparvovec的安全性和有效性。15名8个月以下患有1型脊髓性肌萎缩症的婴儿中有13名,并与自然病史队列进行了比较。这些结果在对22名6个月以下的患者进行的第3阶段STR1VE-US研究14(以前称为STR1VE)中得到了证实。在这两项研究中,与儿科神经肌肉临床研究网络(PNCR)的自然病史队列相比,患者存活率有所提高。START13和STR1VE-US14中的一些患者也保持独立于通气支持,并实现了运动里程碑,包括无需协助下自行坐着。其常见治疗-紧急不良事件包括上呼吸道感染、发热和便秘,以及肝氨基转移酶升高、血小板减少和心脏不良事件。近日,有研究人员使用比STR1VE-US使用的更广泛的资格标准来评估onasemnogene abeparvovec基因替代疗法在1型脊髓性肌萎缩症婴儿中的安全性和有效性。

STR1VE-EU是一项多中心、单臂、单剂量、开放标签的3期试验,在意大利(n=4)、英国(n=2)、比利时(n=2)和法国(n=1)的9个地点(医院和大学)进行。研究招募了小于6个月(180天)的1型脊髓性肌萎缩症患者和常见的双等位致病性SMN1外显子7-8缺失或点突变,以及SMN2的一个或两个副本。2例患者一次性静脉滴注抑癌基因阿贝帕罗韦克(1.1×10~(-1)⁴载体基因组[VG]/kg)。门诊随访包括每周评估一次,从输液后第7天开始,持续4周,然后每月评估一次,直到研究结束(18个月或提前终止)。根据世界卫生组织多中心生长参考研究的定义,主要结果是在18个月以内的任何一次访问中,按照意向治疗人群的衡量,独立坐着至少10秒。疗效与儿科神经肌肉临床研究(PNCR)自然病史队列进行比较。本试验已在ClinicalTrials.gov注册,NCT03461289(已完成)。
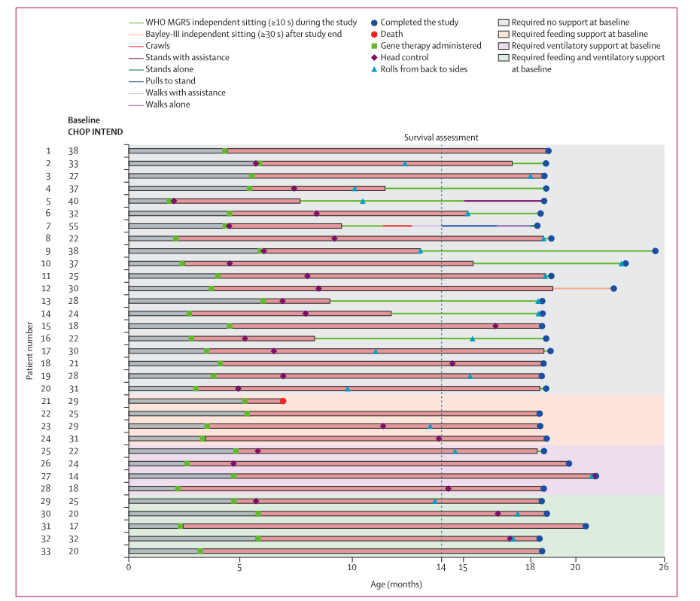

STR1VE-EU显示了onasemnogene abeparvovec对1型症状性脊髓性肌萎缩症婴儿的疗效。没有发现新的安全信号,但需要进一步的研究来证明长期安全性。Onasemnogene abeparvovec的益处-风险分布似乎对这些患者群体有利,包括那些在基线水平上患有严重疾病的患者。
文献来源:Mercuri E, Muntoni F, Baranello G, et al. Onasemnogene abeparvovec gene therapy for symptomatic infantile-onset spinal muscular atrophy type 1 (STR1VE-EU): an open-label, single-arm, multicentre, phase 3 trial. Lancet Neurol. 2021;20(10):832-841. doi:10.1016/S1474-4422(21)00251-9


