Shp2,可谓是近几年一个新兴的明星抗癌药靶点,它是由Ptpn11基因编码的细胞质蛋白酪氨酸磷酸酶(PTP),参与细胞增殖、分化和存活,直接作用于受体酪氨酸激酶 (RTK) 和细胞因子受体的下游,被认为是 PTP家族中第一个被证实的原癌蛋白。如今,经过充分验证, Shp2可以促进多种癌症的生长和存活,也因此正在成为治疗癌症的重要靶标。
虽然科学家们认为抑制Shp2的药物能够以不同于其他疗法的方式攻击癌细胞,为癌症患者提供新的希望。但是,最近加州大学圣地亚哥分校研究团队的一项研究表明,以Shp2为治疗靶向也会促使疾病恶化,这引起了人们对于研发靶向Shp2抗癌药物的担忧。该项研究以“Single-cell transcriptomics reveals opposing roles of Shp2 inMyc-driven liver tumor cells and microenvironment”为题发表在了《Cell Reports》上.

https://doi.org/10.1016/j.celrep.2021.109974
研究人员在该项研究中主要探究了Shp2在Myc驱动的肝细胞癌(hepatocellular carcinoma,HCC)中的主要作用机制。肝细胞癌是最常见的原发性肝癌类型,也是世界上第六大最常见的癌症类型,其致命性不可小觑,生存总体预后也非常严峻,
五年相对生存率仅为18.4%。HCC的病因和病情进展很复杂,且具有对化疗耐药的特征,通常在晚期被诊断出来,治疗选择有限。而c-Myc (Myc)的异常表达与约50%的人类癌症以及动物模型中各种实验诱导的肿瘤有关。更值得注意的是,科研学者们曾在预后较差的侵袭性HCC和肝母细胞瘤中检测到 Myc过表达。
那么,Shp2、Myc究竟会对肝细胞癌产生怎样的影响呢?研究人员通过创建基因工程小鼠模型并进行单细胞 RNA 测序,深入探究了 Shp2 究竟能否成为癌症治疗新靶点的可能性。
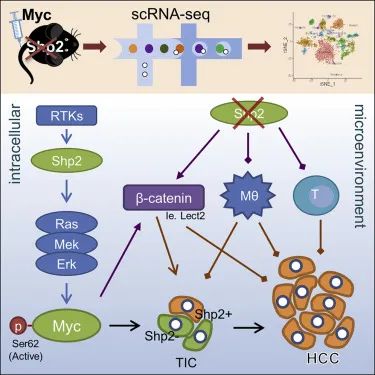
试验原理图
在这项研究中,科研学者们将人Myc(hMyc)和睡美人(SB)转座酶转染到野生型(WT)和肝细胞特异性Shp2基因敲除小鼠(SKO)体内,在SKO小鼠模型中,超过90%肝细胞中的Shp2被删除,试验结果显示,单独的Myc不能有效诱导WT小鼠的肝脏肿瘤,然而SKO小鼠肝脏中的Myc转染仅在 4 周内就诱导了严重的肿瘤发展,这种肿瘤最后被鉴定为肝细胞癌(HCC)。这项结果表明,
即使以往研究结论表明Shp2的缺失会抑制肿瘤的发展,但是Myc驱动的致癌作用在Shp2缺陷型肝脏中同样会导致肿瘤的急剧恶化,这显示了Shp2在癌症中的矛盾作用。
那么,Shp2究竟是如何促进Myc诱导的肝细胞癌恶化的呢?研究人员以单细胞分辨率剖析侵袭性HCC表型的潜在机制,建立了独特的肝组织处理方案,并使用 scRNA-seq 对干细胞类型进行分析。他们发现,Shp2和Myc的共同注射不能有效地诱导WT小鼠的肿瘤发展,这一现象表明Shp2过表达在WT肝脏中没有肿瘤促进作用。然而,当Myc和Shp2共转染到SKO小鼠肝脏中时,则诱发了更快和更严重的肿瘤生长,这一现象表明,
Myc诱导的HCC严重肿瘤表型需要Shp2的细胞自主表达,但同时,它也需要大多数肝细胞中Shp2缺失诱导的肝脏微环境。
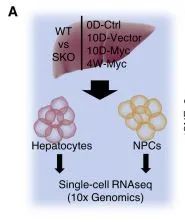
scRNA-seq试验设计
有了新发现后,研究人员提出了更深入的疑问,为什么Myc驱动的HCC严格需要Shp2?研究显示,Shp2对Ras-Erk-Myc信号通路具有激活作用,这导致Myc驱动的肿瘤中Shp2基因的细胞自主需求被与Myc共转染的致癌 Ras突变体所覆盖,要知道,RAS是肿瘤患者中最常见的致癌基因之一,这也就促进了肝癌的进一步发生。随后,研究人员有了更重要的发现,
抑制Shp2会在肝脏中诱导一种意想不到的复杂免疫抑制环境,这会在疾病早期干扰肿瘤起始细胞的清除,并在后期加剧肿瘤进展。
总体来说,
该项研究发现,肿瘤细胞需要Shp2来加速HCC的发展,这验证并强化了Shp2是癌症治疗的新理想靶点的理论,但同时,在肝细胞中去除Shp2同样可使Myc致癌基因显着加速HCC的生长,这将让Shp2在从“不可成药”到理想靶点的道路上面临更严峻的挑战。
面对这一矛盾的研究成果,研究团队成员之一Feng教授指出:“这些意料之外的结果可能有助于理解肿瘤复发,这也是大多数癌症患者死亡的主要原因。人们普遍认为,肿瘤复发是由于对抗癌药物产生耐药性所导致的,在某些情况下确实如此,但这项研究表明,复发的原因也有可能是治疗本身,即使它精确地针对癌细胞,也会触发导致肿瘤复发的致瘤基因。”Feng教授认为,这些发现挑战了目前流行的精准医学疗法:“我们需要既能治疗原发肿瘤又能解决复发问题的策略。只有这样,我们才能战胜癌症这种最复杂、最恶性的疾病。”
从不可成药到明星靶点 众多企业已布局抢跑
Cell Reports的这项研究让我们看到了Shp2靶点的矛盾性,也为药企对于SHP2抑制剂的研发敲响了警钟,但是其潜在的优越抗癌特性,依然驱动着众多药企进行这一赛道的布局。
在国外药企中,
诺华、赛诺菲、罗氏、BMS、默沙东、艾伯维等企业已抢先布局。其中,
诺华的TNO155是首款进入临床阶段的SHP2抑制剂。在早期试验中,它与MiratiTherapeutics公司的KRAS抑制剂MRTX849联用,在治疗携带KRAS G12C 突变的癌症患者上彰显了潜力,目前,该在研药物处于2期临床阶段。
而赛诺菲、罗氏、BMS则选择了研发合作的方式抢占SHP2赛道。2018年,
赛诺菲从创新药企
Revolution Medicines引进了
RMC-4630,RMC-4630是一种有效敏感的口服SHP2别构抑制剂,对于SHP2依赖型RAS信号突变(如KRASG12C、NF1、BRAF、KRAS扩增等)有抑制作用,双方正在合作研发这一新药,该药已进入II期临床阶段。2020年,医药巨头罗氏促成了旗下子公司
Genentech与癌症精准疗法研发公司
Relay Therapeutics的合作,共同开发Relay的SHP2变构抑制剂
RLY-1971,作为一种SHP2强效小分子抑制剂,RLY-1971在临床前研究中表现出显著抗肿瘤活性,有潜力克服或延迟耐药性的发生,目前该药已进入I期临床阶段。
BMS迎头赶上,在2021年也入局了这一赛道,BMS与罕见病巨头药企
BridgeBio Pharma的合作于今年7月份正式拉开序幕,双方达成一项非排他性、共同出资的临床合作,以评估其 SHP2 抑制剂
BBP-398与 PD-1 抑制剂 Opdivo(通用名:nivolumab)的联合疗法,用于治疗携带 KRAS 突变的晚期实体瘤患者。
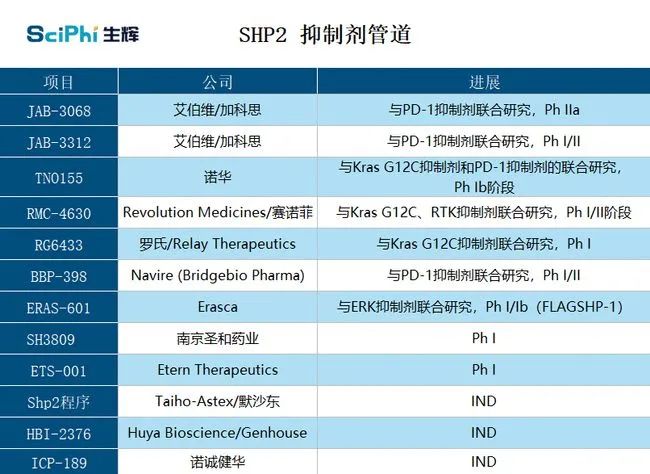
部分 SHP2 抑制剂管线(图片来源:生辉根据公开资料整理)
而在国内,
诺诚健华、奕拓医药、加科思、贝达药业、圣和医药、勤浩医药等药企已率先起跑。
诺诚健华的ICP-189是其自主研发的一种高选择性的口服SHP2变构抑制剂,对其他磷酸酶具有很好的选择性,旨在为肺癌、头颈癌及消化道肿瘤等实体瘤提供新的临床治疗方法,目前已获批开展临床试验,同时也于近日获得了美国FDA批准开展临床研究。此外,由
奕拓医药开发的SHP2变构抑制剂ET0038也获FDA的临床试验许可,并于今年7月在国内获得两项临床默示许可。同时,也在今年,
圣和药业自主研发的SHP2抑制剂SH3809片获得国家药品监督管理局临床试验许可,拟用于治疗实体瘤患者。此前,该药已于2020年获得美国FDA临床试验许可。
加科思药业目前拥有两款在研SHP2靶向小分子抑制剂,分别为
JAB-3068和JAB-3312。它们可以同时与SHP2的三个结构域相互作用,将其锁定在封闭的非活性构象中,具备对SHP2的高效选择性。在美国,它们均已获得FDA授予用于食道癌(包括食管鳞状细胞癌)治疗的孤儿药资格。更值得注意的是,2020年6月,加科思药业和艾伯维(AbbVie)宣布达成全球战略合作,根据协议约定,艾伯维将获得前者SHP2项目的独家许可权。
由目前的临床动态可以看出,国内外药企关于SHP2抑制剂的研发均处于临床阶段,同时对于该药的研发也更倾向于联手合作共同开发,作为向来被认为“难以成药”的靶点,SHP2正因其潜在的肿瘤抑制效果而备受青睐,针对这一靶点的赛道也将有更多的入局者参与进来,究竟谁能在这一领域拔得头筹,让我们拭目以待。
参考资料:
[1]https://www.cell.com/cell-reports/fulltext/S2211-1247(21)01453-4#
[2]https://www.eurekalert.org/news-releases/934342
[3]https://www.163.com/dy/article/GMK32GRB05349C3I.html#
[4]https://www.163.com/dy/article/GG5BS4TQ05119734.html
[5]https://www.163.com/dy/article/GO1P7CT10552N1YQ.html
[6]https://weibo.com/ttarticle/p/show?id=2309404656617819078826
[7]https://www.163.com/dy/article/GG5BS4TQ05119734.html#






