Cell Reports:纳米颗粒助力,首次实现对血管内皮的CRISPR基因编辑
时间:2022-01-06 15:13:23 热度:37.1℃ 作者:网络
血管内皮是衬在血管腔表面的单层内皮细胞,血管内皮在血管稳态和组织液平衡中起着至关重要的作用。内皮功能障碍是许多疾病的根源,例如冠状动脉疾病、中风、支气管肺发育不良和肺动脉高压等等,此外,在内皮细胞中进行基因组编辑还可以通过切断肿瘤的血液供应或阻止癌症转移来治疗癌症。
CRISPR-Cas9是一种强大的基因组编辑工具,在基础研究和临床应用中都取得了令人瞩目的成绩。腺相关病毒(AAV)是体内基因编辑最主要的递送载体,但AAV也存在着一些问题,例如会诱发免疫反应而难以二次给药,载体容纳空间较小而难以递送超过4.7kb的基因序列,病毒载体还可能存在诱导DNA损伤的潜在风险。近年来,以脂质纳米颗粒(LNP)为代表的的非病毒载体引起了广泛关注,而且在肝脏中进行了高效基因编辑,但对于肝脏以外的器官仍然难以突破。
迄今为止,由于缺少靶向肝脏和眼睛以外的血管内皮的递送系统,导致难以对血管内皮进行高效的基因编辑。
2022年1月4日,美国西北大学芬伯格医学院的 You-Yang Zhao 团队在 Cell 子刊 Cell Reports 上发表了题为:Robust genome editing in adult vascular endothelium by nanoparticle delivery of CRISPR-Cas9 plasmid DNA 的研究论文。
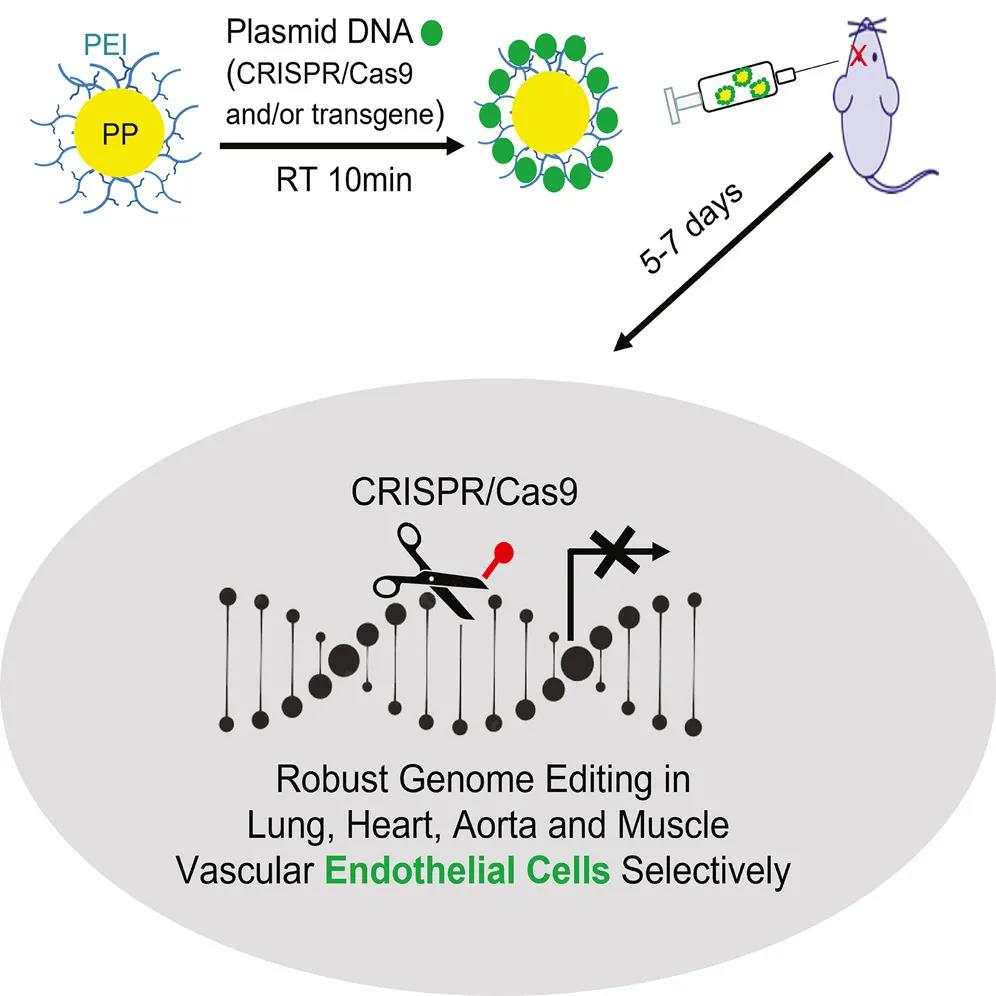
研究团队开发了一种新型纳米颗粒 PEG-b-PLGA,将CRISPR-Cas9基因编辑系统地送到血管内皮细胞,并成功进行了基因编辑,这也是首次在体内编辑血管内皮细胞。

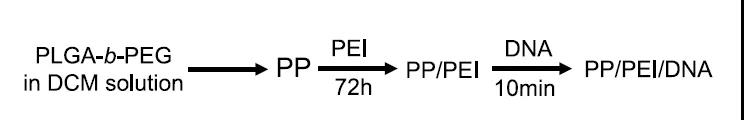
研究团队开发了由聚乙烯亚胺(PEI)配置的 PEG-b-PLGA 纳米颗粒。这种纳米颗粒具有优异的血管递送生物分布,且没有特定的肝脏聚集。
研究团队将携带CRISPR-Cas9基因编辑质粒的这种纳米颗粒通过静脉注射到成年小鼠体内。该递送系统在成年小鼠脉管系统(包括肺、心脏、主动脉和外周血管)的内皮细胞中诱导了高效的基因编辑,检测结果显示,编辑后的血管内皮细胞PI3KCG基因表达的蛋白质下降了约80%,且产生的表型与基因敲除小鼠相似。
此外,该纳米颗粒递送系统递送的基因编辑质粒可以同时诱导至少两个基因的编辑,还可以在在血管内皮细胞中导入外源基因。
该研究的负责人赵教授表示,团队开发的这种纳米颗粒是一种强大的新型血管内皮细胞基因组编辑递送系统,可用于治疗包括COVID-19在内的多种疾病。通过这种纳米颗粒递送系统,可以导入外源基因来抑制血管损伤和/或促进血管修复,也可以递送基因编辑系统来纠正基因突变、打开或关闭特定基因。而且该递送系统还可以同时编辑多个基因。
赵教授表示,该研究开发的纳米颗粒,通过递送质粒,快速改变血管内皮细胞中的基因表达。是治疗由内皮功能障碍引起的疾病的重要突破,也是心血管研究领域的重要突破。
原始出处:
Xianming Zhang, et al. Robust genome editing in adult vascular endothelium by nanoparticle delivery of CRISPR-Cas9 plasmid DNA. Cell Reports, 2022.


