CMI:下呼吸道感染的危险因素
时间:2022-01-26 12:05:28 热度:37.1℃ 作者:网络

目的:下呼吸道感染(LRTI)是各年龄段死亡的第六大原因,全球每年有238万人死亡。宿主对LRTI的反应存在显著差异,即使是低风险的个体中,这表明发病机制和预后中存在遗传因素。以往的遗传学研究主要集中在肺炎、儿童肺炎和病毒性肺炎引起的败血症。关于成人宿主对细菌性LRTI易感性的全基因组关联研究(GWASs)较少。虽然引起LRTIs的病原体多种多样,但大多数来源于细菌。鉴于吸烟与LRTI存在因果关系,估计与LRTI风险相关的遗传变异的影响是否由吸烟行为调节是相关的。可以进行吸烟行为和基因变异之间的相互作用分析,以评估不同的风险估计如何适用于不同的遗传易感性。因此本研究的目的是调查LRTI的遗传易感性和潜在危险因素。
方法:我们使用来自英国生物公司(UK Biobank)、Trøndelag健康研究(HUNT)和FinnGen的数据进行了一项全基因组关联研究(GWAS)。病例为LRTI住院患者,对照组为非LRTI住院患者。我们进行了分层和交互作用分析,以评估LRTI的遗传效应是否因性别或吸烟而不同。采用孟德尔随机化(MR)分析来确定心脏代谢危险因素与LRTI之间的非混淆关系。
结果:共纳入25 320例为病例组和575 294例为对照组。在Meta分析中,15q25.1位点具有全基因组意义(rs10519203: OR 0.94, p 3.87e-11)。rs10519203效应等位基因在吸烟者中具有保护作用(OR 0.90, 95%CI 0.87e0.92, p 1.38e-15),而在不吸烟者中不存在(OR 1.01, 95%CI 0.97e1.06, p 5.20e-01)。在MR分析中,我们发现增加体重指数(OR 1.31, 95%CI 1.24e1.40, p 3.78e-18)、终生吸烟(OR 2.83, 95%CI 2.34e3.42, p 6.56e-27)和收缩压显著增加了LRTIs的风险(OR 1.1, 95%CI 1.02, p 1.48e-02)。

图1 下呼吸道感染(LRTI)原发性或继发性诊断荟萃分析结果的曼哈顿图。曼哈顿图显示了LRTI原发或继发诊断的固定效应荟萃分析结果。x轴表示基因组位置(染色体1e23), y轴表示变异p值的负对数(以10为基数)。蓝线表示全基因组暗示关联(p值<1e-06),红线表示全基因组显著关联(p值<5e-08)。全基因组提示位点(±500 kb的先导变异)用绿色高亮显示。
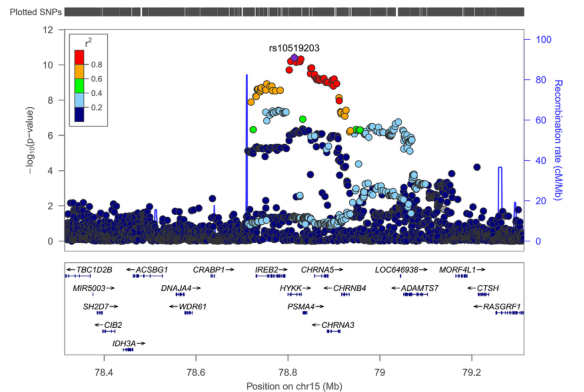
图2 来自荟萃分析的15号染色体位点(rs10519203)的区域关联图。基因座放大图显示了chr15q25.1区分LRTI原发或继发诊断的固定效应meta分析结果。y轴表示变异p值的负对数(以10为基数),x轴表示15号染色体上的位置,底部显示基因的名称和位置以及最近的基因。该地区p值最低的变种rs10519203用紫色钻石标记。
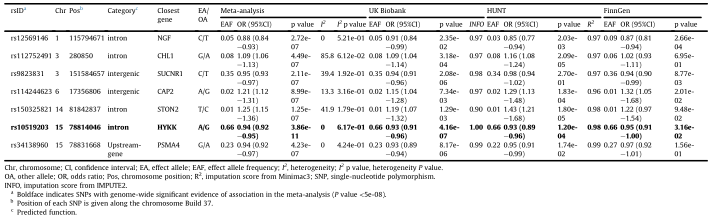
表1 在原发性或继发性下呼吸道感染的固定效应meta分析中,p值<1e-06的遗传变异
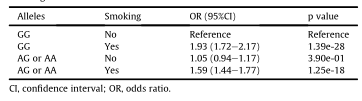
表2 英国生物库rs10519203与吸烟状况的交互作用分析
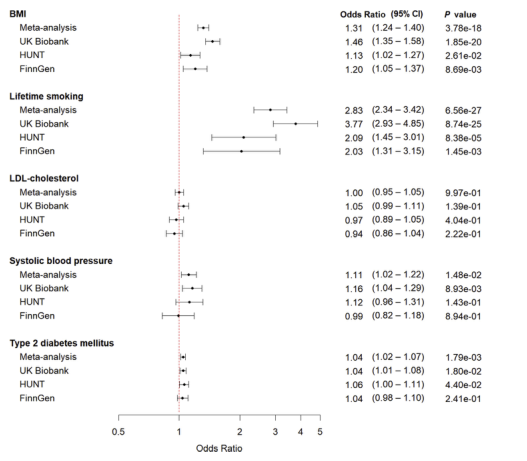
图3 心脏代谢危险因素对下呼吸道感染风险的孟德尔随机化分析二样本反方差加权孟德尔随机化分析确定为与LRTIs遗传相关的心脏代谢危险因素的森林图。对每个危险因素分别进行meta分析、UK Biobank、HUNT、FinnGen以及相应的危险因素评估。x轴表示的结果表示为连续性状(身体质量指数(BMI),终生吸烟,低密度脂蛋白(LDL)胆固醇,收缩压)和每单位遗传性2型糖尿病的对数优势比的增加。
结论:15q25.1的一个区域与LRTI易感性密切相关。吸烟、超重、肥胖和高血压患病率的降低会减轻下呼吸道感染的疾病负担。
原文出处:Flatby HM, Rasheed H, Ravi A,et al.Risk of lower respiratory tract infections: A genome-wide association study with Mendelian randomization analysis in three independent European populations.Clin Microbiol Infect 2021 Nov 08


