这种不起眼的食用油,竟然可逆转肝纤维化!
时间:2022-02-05 21:07:32 热度:37.1℃ 作者:网络
肝纤维化是重复性肝损伤的动态过程,最终导致肝硬化和器官衰竭。在发展中国家,肝纤维化的主要致病因素是丙型肝炎病毒和/或寄生虫感染,而在发达国家,常见原因是乙型肝炎病毒和过量饮酒。已知许多刺激会引起慢性肝脏炎症和肝纤维化,包括但不限于自身免疫性疾病,代谢紊乱,药物或毒素诱导的疾病,慢性胆汁淤积性疾病和遗传性疾病。进行性肝纤维化是发生肝脏相关并发症和死亡的重要危险因素。
肝星状细胞(HSC)的显着特征之一是在细胞质基质中保留了维生素A脂质。反复肝损伤后,静止的HSC被激活并分化成肌成纤维细胞样细胞;他们失去了储存的维生素A和脂质;表达α平滑肌肌肌动蛋白(α-SMA),并产生大量的细胞外基质(ECM)蛋白。因此,许多与HSC激活和随后的纤维化有关的细胞和分子机制,包括细胞因子和活性氧,因此提供了可能的治疗靶点。局灶性粘附激酶(FAK)信号通路是参与纤维生成过程的多种信号通路之一,是局灶性粘附激酶(FAK)信号通路。
局灶性粘附激酶(FAK)是一种细胞质酪氨酸激酶,通过HSC的激活和分化,刺激肌成纤维细胞增殖和对细胞凋亡的抵抗,在肝纤维化中起关键作用。此外,药物抑制FAK信号传导可能是预防肝纤维化的潜在靶点。在这种情况下,来自植物材料,特别是植物产品的天然生物活性成分可能会有所帮助。同时,来自这些植物来源的RBO是一个有希望的候选者。
米糠油在全球范围内的使用越来越广泛。它是大米加工工业的副产品。谷维素,生育三烯酚,曲辛,植物甾醇,多廿山酚,角鲨烯,生育酚和阿魏酸只是RBO中发现的一些生物活性成分。RBO具有多种健康优势,特别是降低胆固醇,抗炎和抗氧化活性。潜在的机制可以通过它们抑制细胞增殖,诱导细胞凋亡和改变癌细胞中的细胞周期进展的能力来介导。此外,米糠生物活性成分可以通过自由基清除活性和阻断慢性炎症反应来防止组织损伤。
RBO是饱和脂肪酸(SFA:20%棕榈酸),单不饱和脂肪酸(MUFA:42%油酸)和多不饱和脂肪酸(PUFA:32%亚油酸)的平衡来源,平均比例分别为0.6:1.1:1.0。此外,它比其他食用油具有更好的氧化稳定性,具有232°C的高烟点和350°C的点火点,使其适用于高温烹饪过程。有趣的是,米糠及其油富含曲辛,这是一种具有抗炎特性的天然类黄酮,通过抑制NF-κβ信号传导并因此减少促炎细胞因子的释放而显示出多种生物作用。此外,曲辛通过抑制FAK蛋白水平及其下游信号表现出抗癌作用。
本研究旨在探索RBO对TAA诱导的大鼠肝纤维化的潜在抗纤维化作用,并研究所选油是否可以减轻这种失调并抑制炎症介质和氧化应激。此外,迄今为止,没有数据可以将TGF-β1 / FAK / α - SMA途径的调节与米糠油对TAA诱导的肝纤维化的抗纤维化值联系起来。因此,本研究旨在研究RBO对大鼠TAA诱导的肝纤维化的潜在抗纤维化作用以及TGF-β1 / FAK / α-SMA途径对TAA诱导的肝纤维化的参与。

将大鼠随机分为5组:阴性对照组,硫代乙酰胺(TAA)组(硫代乙酰胺100mg / kg,每周三次,连续两周,ip),RBO 0.2和0.4组(RBO 0.2mL和0.4 mL /大鼠/天,po)和标准组(水飞蓟素100mg / kg /天,po)注射TAA后连续2周。收集血液和肝脏组织样本进行生化,分子和组织学分析。评估肝功能,氧化应激,炎症,肝纤维化标志物。
1、肝转氨酶
腹膜内注射TAA(100mg / kg),每周三次,持续两周,明显增加(p≤0.05)肝转氨酶(ALT;29.9±0.98 U / L和AST;47.1±2.22 U / L),与阴性对照组(ALT;24.4±1.4 U / L和AST;39.5±1.21 U / L)相比,显示出升高的百分比(分别为22.5%和19.24%)。在诱导肝纤维化后用RBO(0.2和0.4ml /大鼠)治疗2周的组,显示肝酶(ALT;17.7±1.15和15.7±1.26 U / L和AST;38.4±1.167和36.9±0.53 U / L)显着降低(P≤0.05),显示ALT的减少百分比分别为40.8%和47.5%,AST为18.47%和21.65,。值得注意的是,RBO对肝酶水平有相应的改善作用,效果优于对照药水飞蓟素。与阳性对照组相比,水飞蓟素没有显着变化(p≤0.05)(ALT;(27.4±1.33)U/L、AST;44.0±1.33 U/L)。数据如图2所示。

2、血清总蛋白、白蛋白和 A/G 比值
腹膜内注射TAA(100 mg /kg)每周三次,持续两周,与阴性对照组(6.8±0.23,3.6±0.27 g/dL)相比,血清总蛋白(4.5±0.19 g/dL)、白蛋白浓度(1.7±0.16 g/dL)明显下降(p≤0.05),分别降低33.82%和52.78%;A/G比(0.65±0.08)同样低于阴性对照组(1.13±0.12)。与阳性对照组相比,在两个测试剂量水平(0.2和0.4 mL /大鼠)下用RBO治疗两周的大鼠组显示血清总蛋白水平分别为1.23±0.23g / dL和1.19±0.08,血清白蛋白(3.1±0.2g / dl和3.2±0.23g / dL)显着增加。同样,与阴性对照组相比,用RBO(0.2和0.4mL /大鼠)和水飞蓟素(100mg / dL)处理的组显示出正常的A / G比值,分别为1.23±0.17,1.19±0.08和1.21±0.11。数据如图2所示。
3、对肝组织中氧化应激指标的影响
如图3所示,TAA可使肝脏GSH含量显著下降45.49%(p≤0.05),而给药RBO或水飞蓟素可使GSH含量恢复。与TAA组相比,RBO组(0.4 mL/大鼠)GSH显著升高58.67%。数据显示与阴性对照组相比,阳性对照组的MDA水平飙升了119.04%。RBO处理组(0.4 mL/大鼠)MDA水平较TAA处理组显著降低59.46%。

4、促炎细胞因子(TNF-α和IL-1β)和促炎细胞因子调节因子(NF-κβ)
腹膜内注射 TAA (100 mg/kg),持续 2 周,每周三次,与阴性对照组相比(TNF-α; 274.3±5 ng/mL, IL-1β; 269.4±17.11 pg/mL 和 NF-κβ; 3626.0±259.61 pg/mL),显著增加肝组织均质化物中的 TNF-α、IL-1β 和 NF-κβ (分别为817.5±54.mL、770.0±43.32 pg/mL 和 25890.0±1896.66 pg/mL)(p≤0.05),升高率分别为198.0%,185.8%和85.99%。诱导肝纤维化后2周,两组均给予RPO(0.2和0.4 ml/大鼠)显著(P≤0.05)降低TNF-α(422.6±35.71和372.7±25.93 ng/L),降低率分别为48.31%和54.41%;显著降低IL-1β水平(301.9±23.22和292.4±11.12 pg / ml),并显示减少百分比(60.79%和62.02%);显著降低NF-κβ水平(4869.4±490.68和4278.8±293.41 pg / mL) ,与对照阳性组相比的减少百分比分别为81.2%和83.47%。RBO处理组(0.2 mL/大鼠和0.4 mL/大鼠)与水飞蓟素处理组相比,所有炎症参数(TNF-α;335.9±19.48 ng / mL, il - 1β;375.1±35.51 pg/mL, NF-κβ;4370.0±221.75 pg/mL)无显著差异,降低率分别为TNF-α;58.92%, il - 1β;51.28%和NF -κβ;83.12%。数据如表3所示。
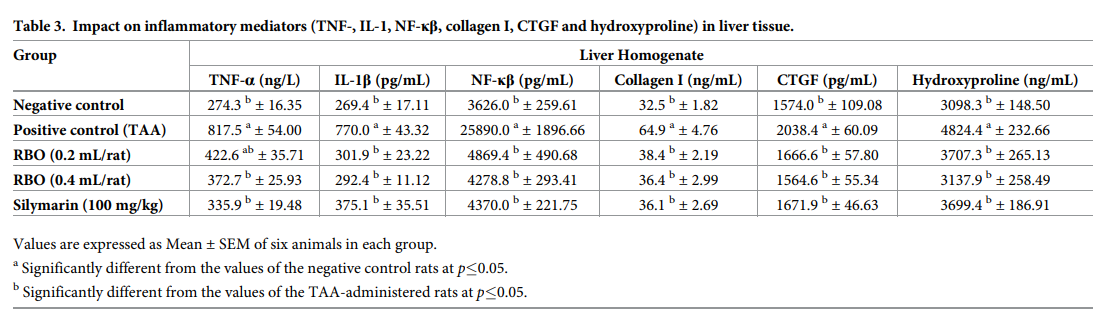
5、肝纤维化生物标志物(羟脯氨酸、I型胶原和CTGF)
TAA注射液处理(100 mg/kg, ip)每周3次连续2周,与阴性对照组(3098.3±148.50 ng/mL, 32.5±1.82 ng/mL, 1574.0±109.08 pg/mL)相比,组织匀浆中羟脯氨酸、I型胶原和CTGF(分别为4824.4±232.66 ng/mL, 64.9±4.76 ng/mL和2038.4±60.09 pg/mL)明显升高(p≤0.05),升高率分别为35.78%、49.92%、22.78%。与对照阳性组相比,用RBO(0.2-0.4 mL /大鼠)治疗肝纤维化2周后的组显示肝羟脯氨酸(3707.3±265.13和3137.9±258.49 ng / mL),I型胶原(38.4±2.19和36.4±2.99 ng / mL)和CTGF(1666.6±57.80和1564.6±55.34 pg / mL)显着降低(p≤0.05),并显示羟脯氨酸减少百分比分别为23.15%和34.96%, 胶原蛋白I下降分别为40.83%和43.91%,和CTGF下降分别为18.24%和23.24%。用RBO(0.4 mL /大鼠)处理的组与用水飞蓟素处理组未见显著区别,羟脯氨酸,胶原蛋白I和CTGF的减少百分比分别为23.31%,44.38%和44.38%。数据如表3所示。
6、TGF-β1 /FAK/α-SMA通路
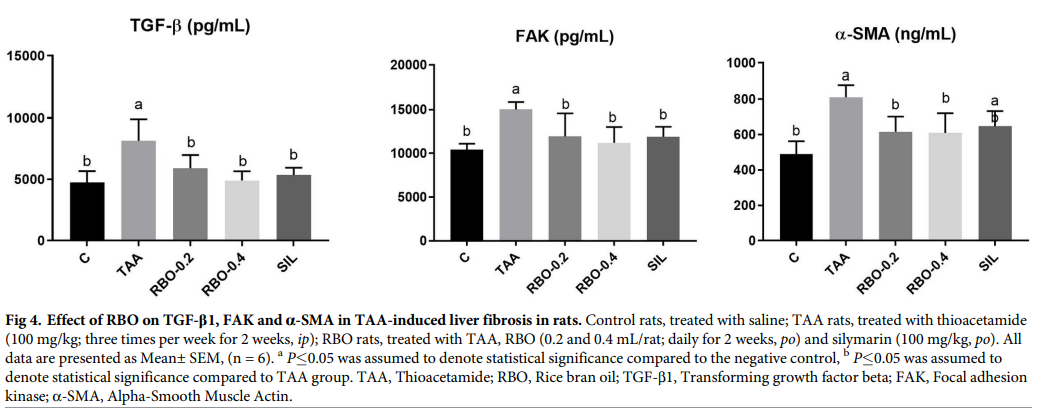
TAA注射液(100 mg / kg,ip)每周三次,持续2周,与阴性对照组(分别为4743.8±376.56 pg / mL,10402.9±±±286.35 pg / mL和489.5±30.07 ng / mL)相比,组织匀浆中TGF-β1,FAK和α-SMA(4743.8±376.56 pg / mL, 15022.3±345.60 pg / mL和811.5±27.91 ng / mL)显着增加(p≤0.05 ), 升高百分比分别为 41.73%、30.75% 和 39.68%。RBO组(0.2和0.4 mL/大鼠)诱导肝纤维化2周后,肝TGF-β1(5902.0±440.72和4905.7±305.98 pg/mL)、FAK(11935.1±1079.75和11204.8±734.83 pg/mL)、TGF-β1(5902.0±440.72和4905.7±305.98 pg/mL)和α-SMA(616.4±34.81和11204.8±734.83 pg/mL)显著降低(p≤0.05),下降百分比分别为TGF-β(27.5%和39.74%)、FAK(20.55%和25.41%)和α-SMA(24.04%和24.86%)。RBO (0.4 mL/大鼠)处理组TGF-β1和FAK(5351.6±240.28和11889.6±471.32 pg/mL)与水飞蓟素处理组相比无明显变化,TGF-β1和FAK的降低率分别为34.26%和20.85%。然而,与对照阳性组相比,用RBO(0.4 mL /大鼠)治疗的组显示出比水飞蓟素更好的结果,水飞蓟素仍然显示与阴性对照组相比显着的升高(647.2±34.93 ng / mL),与阳性对照组相比,下降百分比为20.24%。数据如图4所示。
7、组织病理学检查
对照组大鼠肝脏的门静脉、中央静脉和肝实质细胞的组织学结构正常(图5A),给予TAA的大鼠肝脏显示明显的纤维增生,开始于门静脉三联征,伴有胆管上皮增生、血管充血、单核炎症细胞浸润(图5B),周围呈纤维带状向实质延伸,可见明显的实质假分叶(图5C)。假小叶内的肝细胞呈空泡变性,核偏心性坏死(图5D)。纤维间隔可见细胞凋亡及炎症浸润。
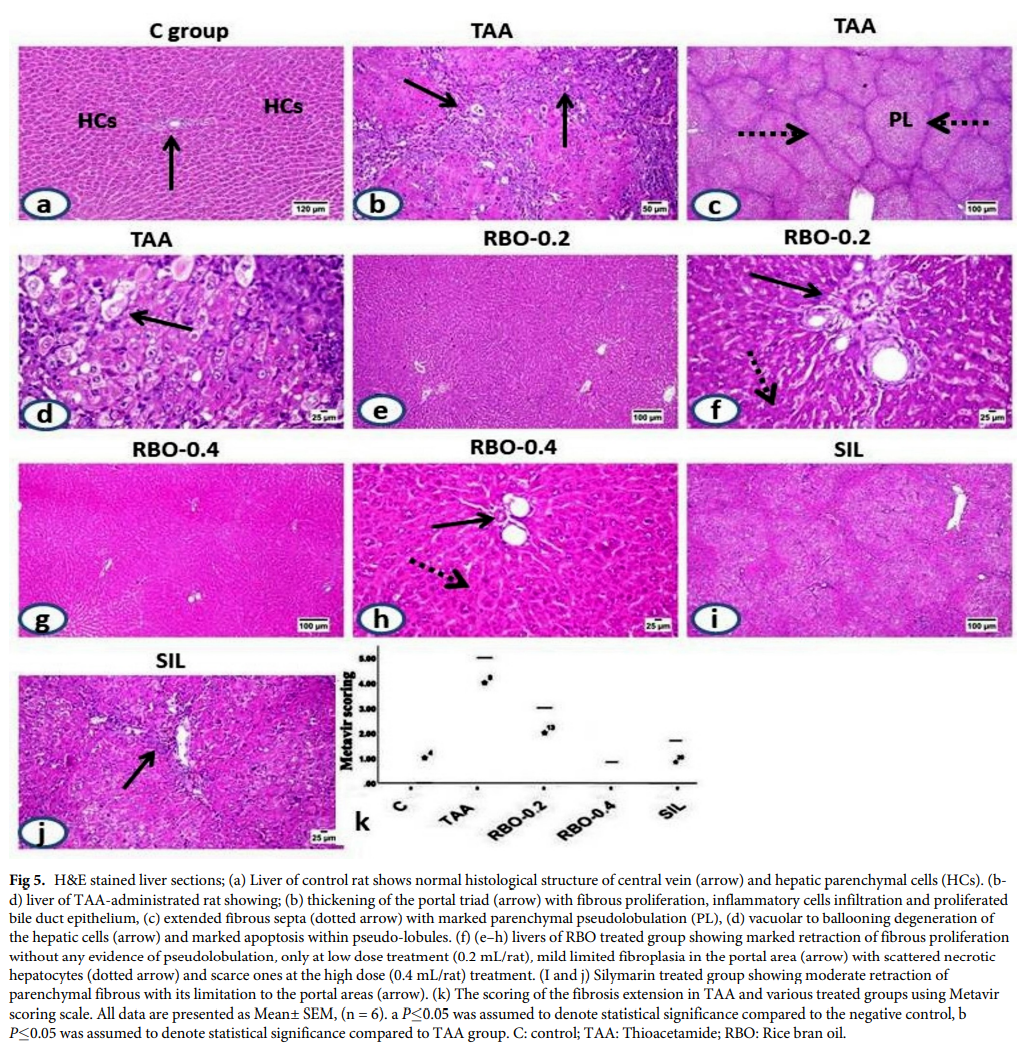
各处理组肝脏纤维增生均有不同程度的收缩,RBO高剂量组(0.4 ml/大鼠)收缩效果最好。低剂量RBO处理(0.2 ml/大鼠)组肝脏(图5E和5F)显示门脉区轻度纤维增生,胆管上皮细胞增生,少量炎症细胞浸润。可见中度肝细胞变性、散在坏死和凋亡。高剂量(0.4 ml/只大鼠)RBO处理的大鼠肝脏(图5G和5H)显示门静脉区很少出现纤维增生,变化很小,肝细胞恢复良好。
水飞蓟素治疗的大鼠肝脏(图5I和5J)表现为门静脉区中度纤维增生,周围扩张不完全间隔,少量炎症细胞浸润,胆管增生。可见中度肝细胞变性和坏死改变。使用Metavir评分系统(F0 =无纤维化到F4 =肝硬化)对所有实验组的纤维增生延长程度进行评分(图5K)。
Masson的三色染色体不同组的肝脏切片显示,与其他组相比,TAA组肝脏切片纤维增生面积百分比较其他组明显增加。与TAA和水飞蓟素给药组相比,低剂量和高剂量的RBO给药均导致与剂量相关的纤维组织增殖显著减少,其局限于门静脉区域。与TAA组相比,后一组纤维组织增殖也显著下降(图6)。

8、免疫组化检查
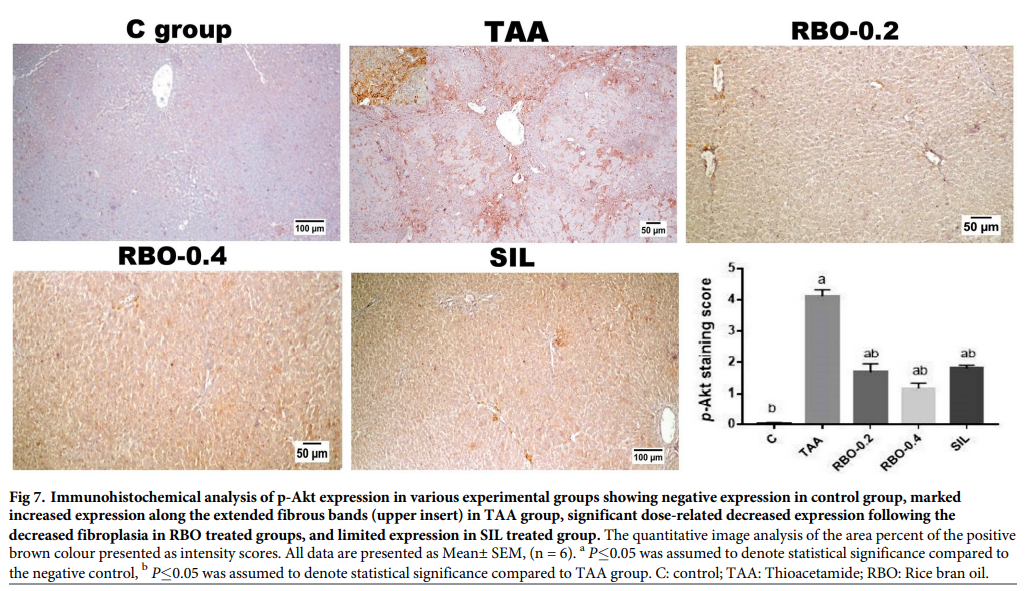
如图(图7和图8)所示,与对照组相比,模型纤维化(TAA诱导)组肝脏中p-Akt(图7)和PDGF-BB(图8)均有显著表达。而RBO治疗组(0.2和0.4 mL/大鼠)肝纤维化诱导两周后,p-Akt和PDGF-BB的免疫表达显著降低,尤其是高剂量治疗组,与TAA高剂量组和水飞蓟素治疗组相比。水飞蓟素处理组两种标志物的表达均下降。定量分析p- akt和PDGF-BB的棕色阳性表达,以染色评分表示,TAA处理组与其他处理组相比,均呈阳性过表达(p≤0.05)。

9、RBO对TAA诱导的NF-κβ和COX-2活化的影响
本研究采用qRT-PCR方法分析NF-κβ和COX-2炎症介质在肝脏中的表达水平。与阴性对照组相比,TAA中毒NF-κβ mRNA含量显著升高(3.67倍)(图9)。与TAA组相比,用水飞蓟素,RBO(0.4mL /大鼠)和(0.2mL /大鼠)治疗TAA中毒的大鼠显着下调肝NF-κβ表达(1.26,1.61和2.07倍)。同样,与阴性对照值相比,TAA中毒导致肝COX-2大幅增加至2.43倍。补充水飞蓟素、RBO (0.4 mL/大鼠)和(0.2 mL/大鼠)显著将COX-2的表达恢复到0.94、1.74和1.92倍(图9)。

总的来说,RBO表现出对TAA诱导的肝纤维化的有益保护性治疗。RBO通过降低脂质过氧化和升高GSH来修正氧化诱导的损伤。此外,RBO通过调节TNF-α,IL-6,NF-κβ,COX2,pAKT,PDGF大大减少了炎症,这有助于TGF-β1途径的下调。最重要的是,RBO抑制了TGF-β1 / FAK信号通路,从而减少了HSC的生长和分裂。最后,RBO通过抑制TGF-β1,α-SMA,I型胶原,CTGF和PDGF的纤维化因子表达来抑制ECM沉积和纤维化进展。需要更多的研究来了解RBO与TGF-β1 / FAK途径在预防肝纤维化方面的联系,以及介导RBO抗纤维化活性的其他途径,RBO或能作为TAA模型中一种有前途的抗纤维化剂。
原文来源:
Rehab F. Abdel-Rahman, et al. The involvement of TGF-β1 /FAK/α-SMA pathway in the antifibrotic impact of rice bran oil on thioacetamide-induced liver fibrosis in rats.
PLOS ONE | https://doi.org/10.1371/journal.pone.0260130 December 29, 2021


