Cell Research:舒易来等开发CRISPR/Cas9-HMEJ基因修复体系治疗隐性遗传性聋
时间:2022-03-01 06:23:04 热度:37.1℃ 作者:网络
据世界卫生组织 (WHO) 官网报道,超过全球人口的5%,即4.66亿人患有致残性听力障碍,其中3400万是儿童。尽管研究发现超过120个基因与非综合征型或综合征型耳聋相关(http://hereditary hearing loss.org/),但临床上对于遗传性感音神经性聋的治疗除了佩戴助听器和植入人工耳蜗等,尚无任何有效的药物治疗手段。在非综合征型遗传性耳聋中,常染色体隐性遗传性耳聋占80% (Korver et al., 2017)。
对于隐性遗传性耳聋,最佳的治疗方法是对基因突变位点进行精准地修复,进而长久地恢复听力。CRISPR/Cas9基因编辑系统是近年来兴起的新型基因编辑工具,已在疾病的治疗中表现出了巨大的应用潜力。该系统主要由sgRNA和Cas9两部分组成,二者形成复合体, sgRNA与靶位点反向互补实现定位后,同时识别PAM序列,Cas9核酸酶切割DNA,导致DNA发生断裂。细胞内主要有两种DNA损伤修复机制,非同源末端连接(Non-homologous end-joining,NHEJ)和同源重组修复(Homologous recombination,HR)。当有外源性DNA模板存在时,利用HR可以实现序列的任意精确变换或者定点插入,但其效率不高,尤其在非分裂细胞中,HR的效率更低,这极大限制了HR在基因治疗领域的应用。
研究团队在先前的研究中通过在同源模板两侧引入sgRNA的靶位点,开发了一种以同源臂介导的末端接合(Homology-Mediated End Joining,HMEJ)为基础的基因敲入策略 (Yao et al., 2017),在体内、体外均实现了高效而精确的整合(图1)。HMEJ介导的基因敲入方法为包括基因编辑动物模型的建立和遗传性疾病的精准靶向基因治疗等提供了广阔的前景。目前,尚无基于CRISPR/Cas9介导的HR策略进行耳聋基因治疗的体内研究。
2022年2月24日,复旦大学附属眼耳鼻喉科医院舒易来研究员、李华伟教授与中国农业科学院(深圳)农业基因组研究所左二伟研究员等团队合作在Cell Research期刊上发表了研究论文Treatment of autosomal recessive hearing loss via in vivo CRISPR/Cas9-mediated optimized homology-directed repair in mice。该研究以AAV作为基因治疗的递送载体,利用HMEJ基因敲入方法精准纠正了Klhl18lowf隐性遗传性耳聋小鼠听觉毛细胞中的点突变,恢复了内毛细胞静纤毛形态,并显著改善小鼠的听觉功能长达治疗后6个月。这是首个基于CRISPR/Cas9-HMEJ技术治疗隐性遗传性感音神经性聋成功的研究,为遗传性耳聋的精准治疗以及潜在的临床转化提供了强有力的科学证据。

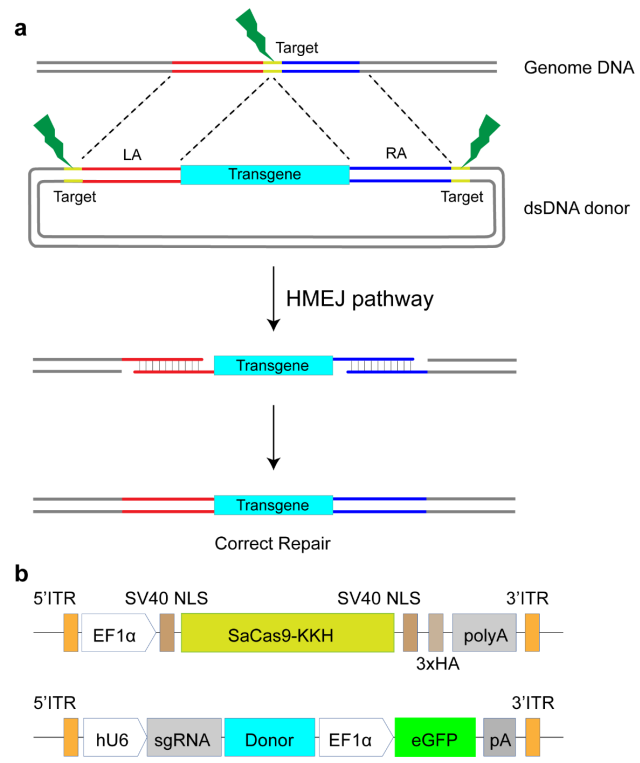
图1 设计HMEJ同源重组治疗方案。a 针对筛选的sgRNA,设计HMEJ同源臂。b 基于AAV作为体内递送载体的双AAV治疗体系,其中一个AAV递送用于表达Cas9的载体,另外一个递送表达sgRNA以及携带同源臂的载体。
Klhl18lowf小鼠模型是指Klhl18 p.V55F发生错义点突变(Chr9:110455454 C>A),其纯合子小鼠表现为第4周开始出现以低频为主的渐进性听力下降,随着年龄增长,听力下降逐渐累及其它频率,最后发展为全频型严重耳聋,而杂合子小鼠听力正常,表现为隐性遗传。Klhl18lowf隐性遗传性耳聋小鼠模型在形态学方面表现为耳蜗内毛细胞纤毛的形态异常 (Ingham et al., 2021)。
该研究首先针对基因Klhl18lowf突变位点设计、筛选和构建了HMEJ治疗体系。在新生小鼠皮肤成纤维细胞中进行体外sgRNA筛选,发现sgRNA2的效率较高。将表达Cas9的质粒与携带HMEJ同源模板和表达sgRNA2的质粒共同转染至带有Klhl18lowf突变的成纤维细胞中,发现突变位点明显得到了的纠正,且sgRNA2不产生明显的脱靶编辑。
体外实验证实设计的HMEJ系统可以精确纠正Klhl18lowf点突变后,该研究进一步在体内探索该系统的疗效。用双AAV包装CRISPR/Cas9-HMEJ基因修复体系,即AAV9-SaCas9-KKH和AAV-PHP.eB-sgRNA-donor,将其在Klhl18lowf新生鼠出生后1天(P1)显微注射至小鼠的内耳。在小鼠P14和10周龄时,体内编辑效率检测结果表明,双AAV治疗系统在体成功纠正了Klhl18基因C>A点突变,随着编辑时间的延长,10周龄的修复效率提高了约3倍,而在未注射耳中,没有观察到明显的碱基插入、缺失或突变碱基的纠正。通过扫描电镜技术,与野生型小鼠相比,发现8周龄的未治疗纯合突变小鼠的内毛细胞最高一排静纤毛表现为更长、更细且顶端成尖细的锥形,而治疗后的小鼠有部分内毛细胞的静纤毛恢复正常的形态,表现为最高一排静纤毛大部分呈柱形且更短。在治疗后小鼠耳蜗的顶圈和中圈,平均约16%的内毛细胞具有正常或接近正常的纤毛束形态。听性脑干反应(auditory brainstem response, ABR)测试结果显示注射AAV-CRISPR/Cas9-HMEJ治疗体系后8周,注射耳的ABR阈值在8、16、24和32 kHz均比未注射耳明显下降,且治疗效果持续至小鼠24周龄(实验观察期)。电生理检测结果显示,在较长时间(200 ms)的去极化脉冲刺激条件下,未注射耳的内毛细胞膜电容与野生型相比明显下降,而AAV-CRISPR/Cas9-HMEJ治疗体系能将注射耳内毛细胞膜电容恢复至野生型水平,即治疗体系修复了内毛细胞持续囊泡释放功能。
综上所述,基于CRISPR/Cas9-HMEJ策略可对体内内耳毛细胞中的基因突变位点进行精准的纠正,恢复了耳蜗部分内毛细胞静纤毛形态、修复了内毛细胞持续囊泡释放功能并持久改善了Klhl18lowf隐性遗传性耳聋小鼠的听觉功能,为最终在人类隐性遗传性耳聋及其它器官系统隐性遗传性疾病中实现安全、持久的基因治疗提供了科学依据和参考。
复旦大学附属眼耳鼻喉科医院舒易来研究员、李华伟教授和中国农业科学院(深圳)农业基因组研究所左二伟研究员为共同通讯作者,顾晰博士后、胡新德博士后(中国科学院神经科学研究所)和王大奇博士后为共同第一作者。
复旦大学附属眼耳鼻喉科医院李华伟教授团队、舒易来研究员团队招聘全职博士后和科研助理
原文链接:
https://www.nature.com/articles/s41422-022-00624-y
1. Ingham, N.J., Banafshe, N., Panganiban, C., Crunden, J.L., Chen, J., Lewis, M.A., and Steel, K.P. (2021). Inner hair cell dysfunction in Klhl18 mutant mice leads to low frequency progressive hearing loss. PloS one 16, e0258158.
2. Korver, A.M., Smith, R.J., Van Camp, G., Schleiss, M.R., Bitner-Glindzicz, M.A., Lustig, L.R., Usami, S.I., and Boudewyns, A.N. (2017). Congenital hearing loss. Nat Rev Dis Primers 3, 16094.
3. Yao, X., Wang, X., Hu, X., Liu, Z., Liu, J., Zhou, H., Shen, X., Wei, Y., Huang, Z., Ying, W., et al. (2017). Homology-mediated end joining-based targeted integration using CRISPR/Cas9. Cell Res 27, 801-814.


