Cell子刊:油酸能抑制铁死亡,有望治疗铁过载相关疾病
时间:2023-11-18 21:37:20 热度:37.1℃ 作者:网络
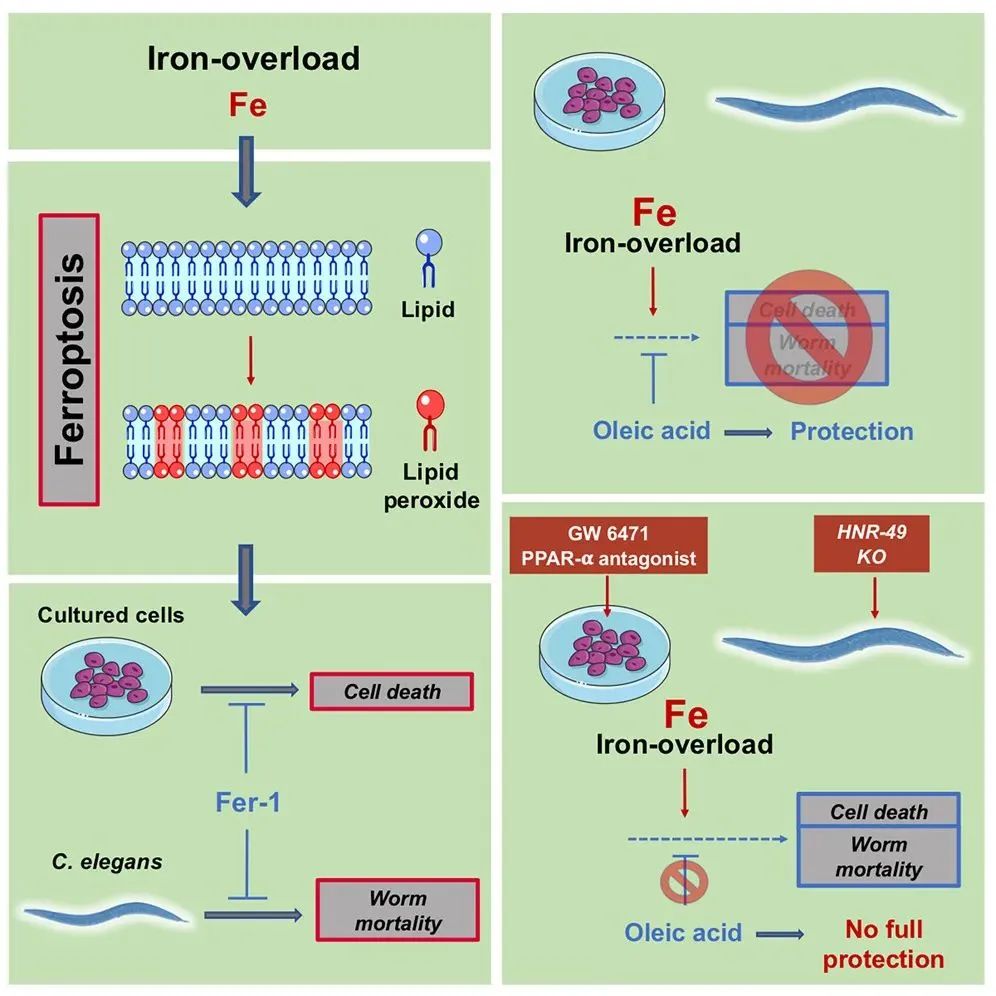
铁死亡是2012年由哥伦比亚大学 Brent Stockwell 实验室发现的一种铁依赖性的新型细胞程序性死亡方式,由过度堆积的过氧化脂质(peroxidized lipids)诱导发生,其形态特征,作用方式以及分子机制与其他程序性死亡方式截然不同。同时,细胞中也有多个对抗铁死亡的防御途径,其中最主要的一个是由谷胱甘肽过氧化物酶4(GPX4)所介导的,通过谷胱甘肽(GSH)特异性催化过氧化脂质来抑制铁死亡的发生。铁死亡是一种铁依赖性的,区别于细胞凋亡、细胞坏死、细胞自噬的新型的细胞程序性死亡方式,与多种生物学情况密切相关。 2023年11月8日,Brent Stockwell 团队在 Cell 子刊 Cell Chemical Biology 上发表了题为:Ferroptosis inhibition by oleic acid mitigates iron-overload-induced injury 的研究论文。 该研究在体外细胞实验和体内动物模型中发现,铁死亡是铁过载介导的损伤的驱动事件。而外源添加的油酸通过抑制铁死亡来保护细胞和组织免受铁过载介导的损伤。 这些结果表明,通过抑制铁死亡的治疗和营养策略来减少铁过载介导的损伤时可行的,在饮食中加入油酸可能代表了一种治疗铁过载疾病的新方法。 铁过载是一种重要的疾病类型,以组织中铁的积累为特征,诱导多器官毒性,导致肾脏、肝脏和神经细胞系的铁死亡,但我们对其机制尚未完全了解。遗传性血色素沉着病是一种铁过载疾病,它是由调节铁代谢基因的遗传突变引起的。最近的一份研究说明,喂食高铁饮食的小鼠和具有遗传性血色素沉着症相关突变的小鼠会出现带有铁死亡标志的肝损伤,而这种情况可以通过施加 ferrostatin-1 抑制铁死亡逆转;此外,即使在遗传性血色素沉着病模型的小鼠中,低铁饮食也能够逆转铁死亡标志物的产生。这些发现再次强调了饮食变化会影响组织细胞对铁死亡的敏感性。脑损伤也和铁过载有关。可以通过注射 FeCl3 到大鼠的躯体感觉皮质,这会导致癫痫发作和认知功能降低,来模拟脑损伤。Ferrostatin-1 挽救了这些由铁过载导致的影响,表明这种脑损伤模型涉及到过度的脂质过氧化和可能的铁死亡。 在这项最新研究中,研究团队通过使用细胞系、秀丽隐杆线虫以及小鼠模型,发现铁死亡发生在铁过载介导的损伤背景下。而外源性油酸(oleic acid)通过抑制铁死亡来保护体外培养细胞和线虫免受铁过载带来的毒性。而在小鼠中,油酸可以保护其肝脏免受铁过载诱导的肝脏脂质过氧化和损伤。 油酸改变了细胞脂质组成,其特征是多不饱和脂肪酸酰基磷脂水平降低,醚连接磷脂水平降低。油酸在细胞中的保护作用被GW6471(PPAR-α拮抗剂)以及缺乏核激素受体NHR-49(PPAR-α功能同源物)的线虫所减弱。 这些结果强调了铁死亡是铁过载介导损伤的驱动因素,而铁过载介导的损伤能够被油酸所抑制。油酸这种单不饱和脂肪酸代表了一种潜在治疗方法,有望用于减轻铁过载患者的器官损伤。 随着疾病科普的日渐发达,公众对于白血病等常见血液疾病或多或少有些了解,但对于各种原因贫血造成的输血依赖性疾病却不甚了解。有专家指出,很多贫血患者需要长期输血治疗,因此会引发铁过载(IOL)这一非常严重的并发症。铁过载发病率高、危害大,但往往容易被医患所忽略,导致就诊和治疗的贻误。” 长期输血治疗,三类人群需警惕“铁过载”。铁过载又称铁负荷过多,是指铁的供给超过铁的需要,使其广泛沉积于人体一些器官和组织的实质细胞,常伴有纤维组织显著增生,导致多脏器功能损害。按发病原因的不同,铁过载分为原发性和继发性。其中,继发性较为多见,主要由长期输血所导致。 正常人每日吸收并消耗1-2mg铁,约为正常饮食中铁含量的10-15%。而有些贫血患者铁的吸收量是正常人的两倍,每日3-4mg,约为正常饮食中铁含量的20%。此外,地中海贫血(TDT)、再生障碍性贫血(AA)、骨髓增生异常综合征(MDS)等血液科常见的输血依懒性疾病患者,还会在长期输血治疗中额外吸收铁。 “每1国际单位红细胞中包含大约200-250mg的铁,由于人体缺乏有效的排除铁机制,经输血进入人体的铁无法被清除,便会沉积于体内。10-20次输血后,铁摄入量即可达到4-5g,患者便会发生铁过载。[2]”付蓉教授提醒,铁过载的表现很隐蔽,通常在发生器官损伤时才会出现症状。因此,TDT、AA、MDS等输血依懒性疾病患者应重视和警惕铁过载风险。” 铁过载危害大,规范祛铁治疗不可或缺。临床中,血清铁蛋白水平(SF)是诊断铁过载的首选方法。正常情况下人体血清铁蛋白值:男性为10~220微克/升,女性为10~85微克/升。根据2011年《铁过载的诊断治疗中国专家共识》建议,当患者接受20国际单位红细胞输注或血清铁蛋白(SF)>1000微克/升即可判断为铁过载。 付蓉教授介绍,当铁在人体中的含量超过自身转铁蛋白的结合能力时,多余的铁将首先累积在肝脏,随后进入内分泌器官如甲状腺及垂体,最后沉积在心脏,不仅导致原发病加速恶化,同时也会对这些器官的组织细胞造成损害,引发心律失常、心力衰竭、肝纤维化、肝硬化、糖尿病,以及造血功能抑制、感染风险增高、造血干细胞移植(HSCT)的结局不良和MDS的白血病转化加速等疾病及并发症,甚至影响患者生存。 “国际指南及国内共识均推荐对于TDT、AA、MDS等反复输血患者,进行血清铁蛋白检测,必要时对心脏、肝脏进行核磁共振成像(MRI)监测,一旦发生铁过载,患者需要进行及时规范的祛铁治疗,以降低体内铁负荷,改善重要脏器功能,延长生存。”付蓉教授强调。 实现患者获益最大化,祛铁治疗依从性是关键。目前临床中,铁过载治疗仍以药物治疗为主,其中铁螯合剂是主要方式之一。其能选择性地结合多余的铁,形成化合物并促进排泄。就像是用吸铁石一样,把体内“有毒性”的铁给吸出来,然后排出体外,从而降低患者的铁负荷。 注射用去铁胺和口服地拉罗司是目前临床中常见且被指南推荐用于成人铁过载治疗的两种铁螯合剂。但依从性是影响祛铁治疗效果的重要因素,治疗依从性越好,患者的生存率越高,反之则越低。相较于注射去铁胺的繁琐且不良反应较多,一天一次创新口服铁螯合剂使用更为方便,能持续有效的降低机体铁水平,而且目前已被纳入2019新版国家医保目录,可及性大大提升,为贫血患者带来改善铁过载治疗依从性、延缓原发病进展及延长生存等多重获益。” 来源:生物世界、美通社 论文链接: https://www.cell.com/cell-chemical-biology/fulltext/S2451-9456(23)00373-2