Nat Rev Clin Oncol综述:深入解析癌症的空间组学景观——机遇与挑战并存
时间:2024-08-21 15:00:25 热度:37.1℃ 作者:网络
导 读
空间生物学的概念由来已久,几十年来,科研人员利用显微镜获取肿瘤的空间信息,依靠基于靶向蛋白质的技术对肿瘤进行表征,如免疫组织化学(IHC)和免疫荧光等,揭示了具有预测和/或预后价值的组织学模式。但这些技术需预先选择靶分子、分辨率有限并存在因样本选择导致的偏差问题。此外,基因组学的进步在提高癌症诊断和预测的准确性以及指导新治疗方法方面显示出越来越大的效用,但许多基因组学方法未能完全捕获样本的潜在细胞异质性。
在过去十年中,单细胞基因组学方法(单细胞RNA测序,scRNA-seq)的进步为肿瘤复杂的细胞和分子景观提供了广泛的见解,但其缺乏空间背景,无法获取组织结构和细胞相互作用的基本信息。目前,人们已开发了一系列空间分析技术来表征基因组、转录组和蛋白质组;特别地,空间转录组学技术的出现在一定程度上弥补了上述缺陷,其提供了空间分辨转录组学(SRT)数据,在探索肿瘤空间结构和肿瘤微环境(TME)中发挥着重要作用。已有研究表明,空间转录组学技术可在亚细胞空间分辨率上解析基因表达,揭示具有临床意义的生物学新发现。
近日,澳大利亚加文医学研究所、新南威尔士大学和瑞典皇家理工学院的研究人员合作在Nature Reviews Clinical Oncology发表了题为“Spatial landscapes of cancers: insights and opportunities”的综述文章。在这篇综述中,研究团队总结了以空间转录组学为重点的空间分析技术的现状,概述了空间分析技术在癌症研究应用中的主要发现,并讨论了将这些发现整合到临床实践中的机遇和挑战。

文章发表在Nature Reviews Clinical Oncology
空间技术概述
空间转录组技术
20年来,批量RNA-seq被广泛用于比较研究和大型图谱项目中,以对生物样本进行分类和表征,并由此产生了大量数据,这是生物学和临床研究的宝贵资源。2009年,一种名为scRNA-seq的新技术出现,其能够识别细胞间基因表达的差异,并对已知和新型细胞进行转录组分类和表征。scRNA-seq迅速成为生物学研究的宝贵工具,并于2013年被Nature Methods评选为年度方法。
自scRNA-seq诞生以来,一些能够对组织切片进行基因表达图谱分析的新方法也被相继开发出来,这些技术被称为空间解析转录组学技术(SRT)或空间转录组学技术,即通过将生物学现象置于其物理背景中来补充scRNA-seq方法。SRT技术通过在原位分析基因表达水平,克服了scRNA-seq的诸多局限性。近年来,SRT技术在研究神经科学、发育生物学、免疫学、癌症等领域的关键科学问题层面显示出巨大的应用潜力,并被Nature Methods选为2020年的年度方法。
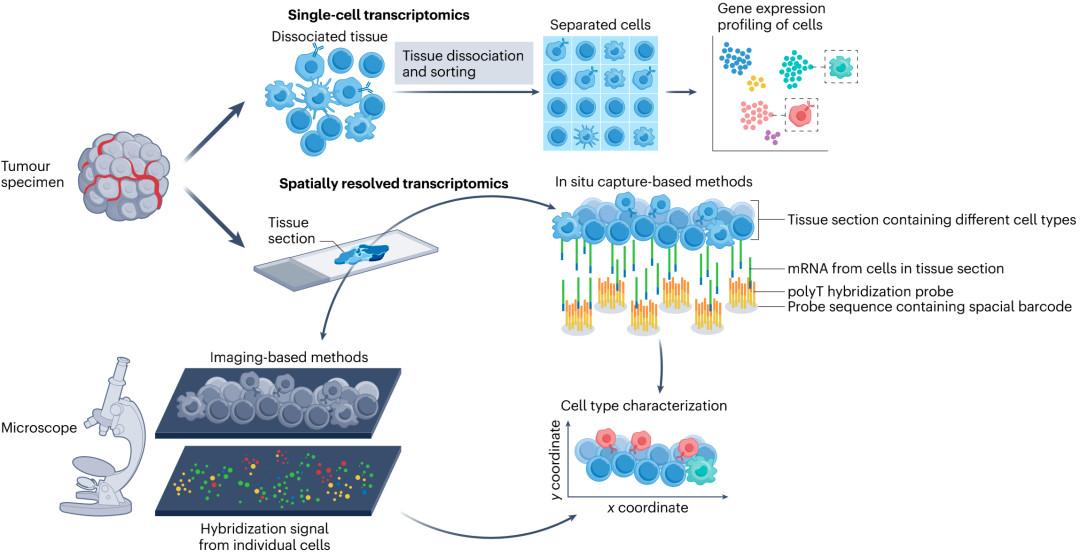
图1. 单细胞和空间转录组学技术总结
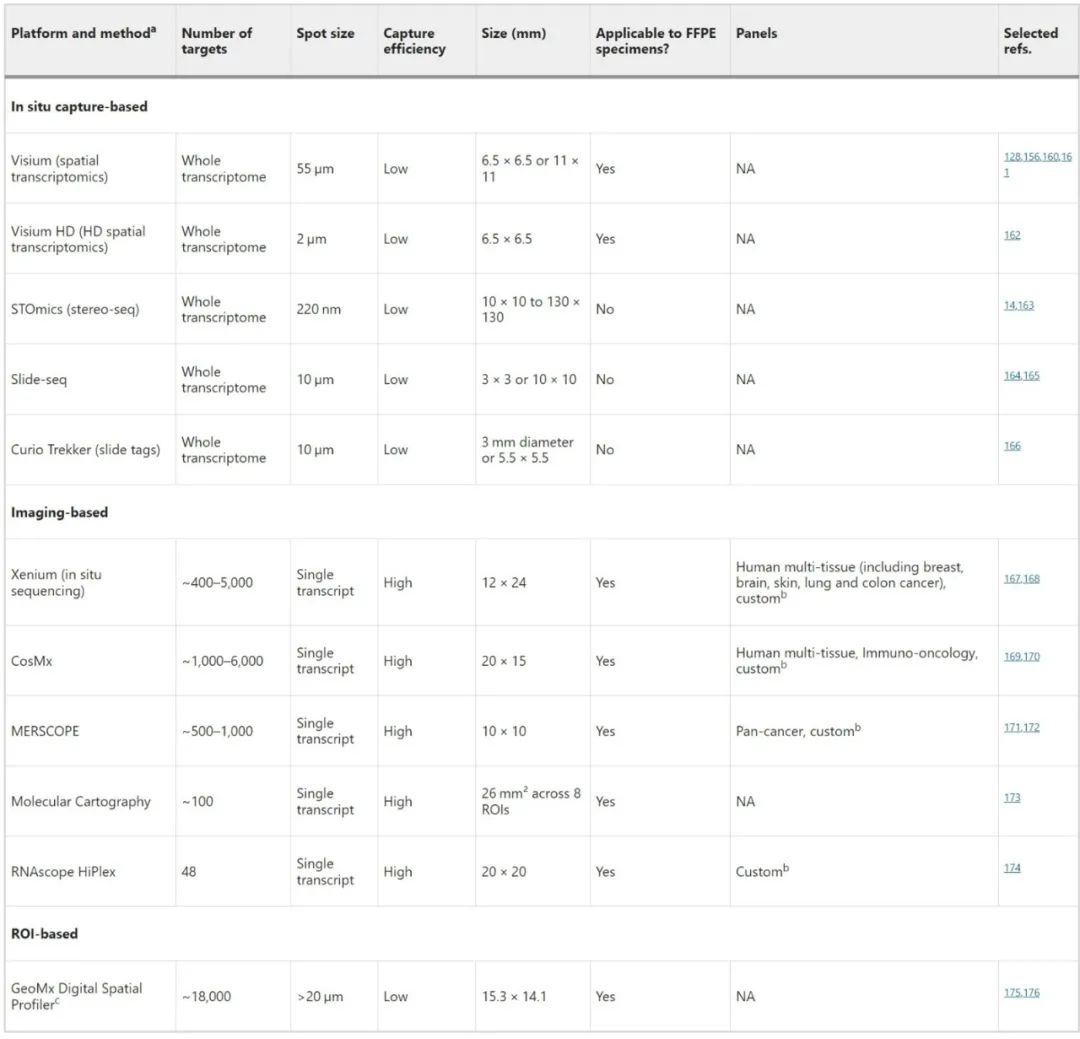
目前,SRT技术可大致分为基于成像的方法和基于原位捕获的方法。基于成像的SRT技术提供了较高的空间分辨率,可揭示组织切片中单个RNA分子的精确位置;该方法的主要局限之一是多路复用能力较低,由于成像过程中的光学限制,通常仅限于几百个靶点。但在过去几年中,仪器制造商开发出了包含数千个基因的panel,如Xenium和MERSCOPE。基于原位捕获的SRT技术是基于成像技术的非靶向替代技术,可对整个蛋白质编码转录组进行测序,进而能够更全面的了解细胞机制;但该技术的捕获效率较低。
表1. 不同空间转录组技术的比较
SRT技术生成的数据为全面探索组织景观提供了新机会,目前已开发了几种计算工具,利用scRNA-seq的细胞特征来解析SRT数据,从而促进组织切片中细胞组成的映射和探索。scRNA-seq和SRT数据的有意义整合则开启了多种可能性,使科研人员能够利用广泛的单细胞数据库,简化对组织中细胞类型组成的理解;这种整合还有助于发现共定位模式,并提供对复杂的细胞间通信事件的见解,制定治疗策略、预测治疗反应等。但这些大型数据集需要细致的处理和分析,通常使用专门的软件包和库,其中许多是用R或Python编程语言编写的。目前Seurat和Scanpy是最广泛使用的两个框架。
空间蛋白质组学技术
除空间转录组层面的进展,在过去的几年里,空间蛋白质组学技术的发展重点集中在使用多重蛋白质组学检测为肿瘤和TME提供更全面的信息,这些平台大多使用荧光团或金属标签。基于荧光团的方法(如多重IHC、CODEX等)通常使用迭代成像采集技术,这涉及到基于抗体的连续几轮检测,以增加蛋白质靶点的数量;该方法能提供高分辨率的空间信息,但可复用的荧光团数量受到光谱重叠以及自身荧光的限制,灵敏度较低。基于金属的成像细胞术和多重离子束成像可利用质谱检测金属同位素标记的抗体,能够克服上述问题,从而实现无干扰的蛋白质检测。此外,质谱成像的最新进展还使人们能够以越来越精细的分辨率对来自完整组织的各种生物分子进行无偏倚评估。
肿瘤微环境的解析及其临床相关性
目前,影响癌症治疗效果的主要因素包括TME的异质性,其由肿瘤内在调节和外部刺激(包括抗癌药物)的重编程协调。肿瘤的功能异质性可通过治疗前后样本的纵向分析以及对治疗有反应和无反应患者的比较来进行评估,这两种方法均可揭示与治疗敏感性或耐药性相关的潜在靶向途径,以及发现用于指导临床管理的预测性生物标志物。例如,对HER2+乳腺癌患者接受新辅助HER2靶向治疗前后样本的空间分析结果显示,治疗可导致HER2依赖性信号的激活降低、免疫浸润增加,而CD45在治疗时的表达增加更能高度准确预测患者是否存在病理学完全缓释(pCR)。此外,随着免疫检查点抑制剂(ICIs)在多种癌症类型中的广泛应用,比较序列转录谱分析可揭示T细胞对这些药物治疗反应的激活和扩增,以及与应答或耐药相关的免疫和/或基质细胞的特定亚群。
与此同时,将单细胞空间数据与大型临床试验队列的临床结果相结合,可以探索空间定义的TME成分作为治疗反应、疾病进展和生存的预测因子。多项研究表明,与整合细胞表型比例或临床分类数据相比,整合空间信息可改善结果预测,这也突出了TME中空间组织的临床相关性。TME的空间特征还可预测多种癌症类型的预后和治疗反应。例如,肿瘤相关巨噬细胞亚群的共定位与肾细胞癌患者的无进展生存相关;Treg细胞和功能失调T细胞的共定位预示着雌激素受体阳性乳腺癌患者的不良预后等。
三级淋巴结构(TLS)是在类似次级淋巴器官的炎症组织中发现的特殊显微解剖结构,具有复杂的组成和结构化组织,特别适合于空间研究;其与患者生存相关并可作为免疫治疗反应的预后和预测性生物标志物。研究表明,TLS有潜力超越目前在临床中使用的ICIs反应的生物标志物。为深入了解TLS在抗肿瘤免疫中的作用,科研人员已使用单细胞空间方法更详细地表征TLS的组成部分及其在TME背景下的精确功能。例如,空间分析的应用揭示了转移性黑色素瘤中TLS的独特特征。目前,TLS的精确功能和组织结构有待进一步研究。
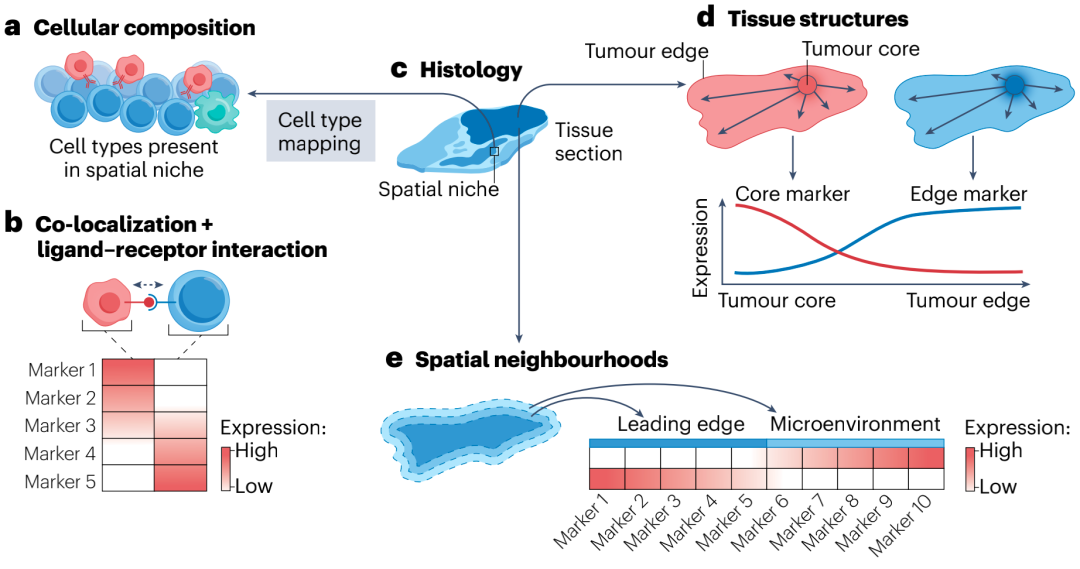
图2. 基于空间剖面提取不同维度的信息
临床应用前景
在过去的几年里,空间分析技术的发展已经显示出捕捉肿瘤细胞结构复杂性的潜力,这些信息的加入有可能提高癌症诊断和治疗的准确性。通过揭示与特定肿瘤亚型、分子特征或治疗反应模式相关的空间基因表达模式,并将其与临床结果相结合,可指导发现新的预后生物标志物,用于预测治疗反应和患者分层,为个性化治疗提供补充信息。此外,利用空间分析来探讨肿瘤内和TME异质性,科研人员还可以确定更有效的预测性生物标志物和与新治疗靶点相关的耐药机制,未来研究的关键是将这些有用的发现转化为临床相关应用。
空间分析技术也可能为精准病理学铺平道路,使用机器学习或深度学习算法,可将空间基因表达谱与病理切片相结合;临床环境中的多重空间分析也是可行的,越来越多的研究将这些空间分析技术纳入大型临床队列。因此,随着新的细胞标志物和抗体的发现,以及计算分析的自动化和成熟化,结合空间分析技术的病理方法可以产生更高分辨率的输出,从而提高肿瘤分类的准确性。
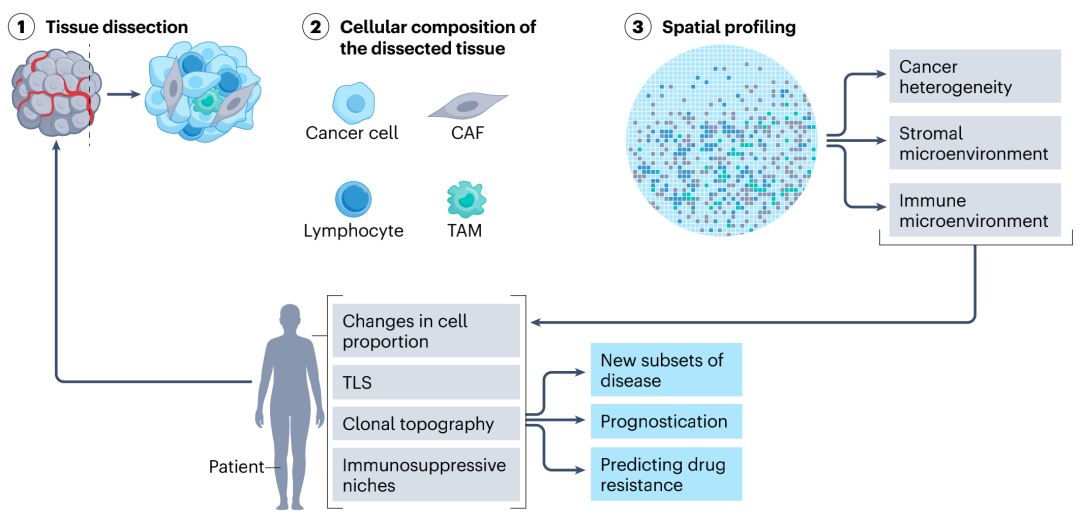
图3. 空间分析在癌症研究中的应用
挑战与未来发展方向
尽管新的空间技术有很大的发展潜力,但在将这些工具纳入常规临床实践之前,仍有许多挑战需要解决。截至目前,大多数使用空间分析技术进行的研究本质上是探索性的,纳入的样本量或患者较少,有些在组织选择方面也存在潜在偏差。因此,未来需要更大规模的研究来获得有临床意义的结果,以克服肿瘤内和肿瘤间异质性的挑战。
目前,空间方法检测的是从较大组织样本中提取的薄组织切片上的分子(如转录本或蛋白质)丰度,在二维空间表征组织的分子解剖特征。但组织解剖学本质上是三维(3D)的,如果不考虑组织的总体积,就会丢失有价值的信息。人工智能(AI)有望解决这些难题,通过提供下一代改进的数据整合和归因方法,以经济高效的方式重建完整3D分子组织解剖结构。相关AI研究已经显示出仅从组织学图像推断分子数据的可能性,但为进行3D重建,还应考虑来自同一组织切片的其他组学信息。因此,多模态生成式AI模型可用于强大的标准化和批次校正、空间推断和跨模态数据整合。
综上,技术挑战和高昂的成本是扩大涉及空间分析临床研究规模的主要障碍。相信随着时间的推移,技术、方法和其他领域的共同进步会进一步降低成本,从而加速将空间技术纳入临床的步伐。
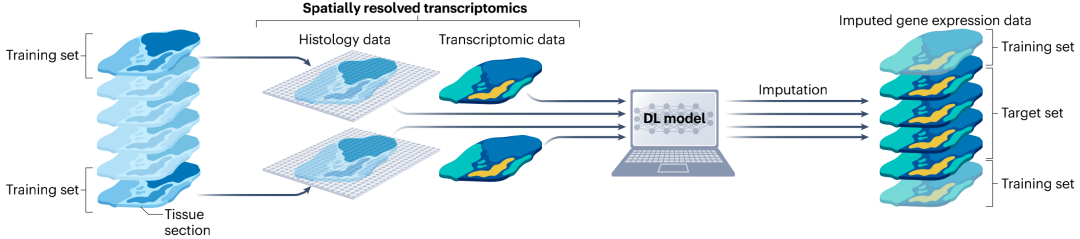
图4. 基于深度学习生成活检样本的3D视图
结语
截至目前空间分析领域经历了变革性的发展,从用于同时表征少数转录本或蛋白质到无偏颇地提供整个器官的空间分辨率图谱。虽然空间解析分析方法仍处于发展的早期阶段,但其彻底改变了人们研究细胞相互作用以及癌细胞与TME之间结构关系的方式,正确认识这些相互作用对于解析肿瘤生物学和改善患者预后方面具有关键作用。癌症研究领域的临床需求将为充分利用现有多模态空间和计算工具组合奠定基础,从而提供诊断和治疗癌症的新方法。
论文原文:
Chen, J., Larsson, L., Swarbrick, A. et al. Spatial landscapes of cancers: insights and opportunities. Nat Rev Clin Oncol (2024).
https://doi.org/10.1038/s41571-024-00926-7.


