Biomaterials:西安交通大学周琦团队制备多功能纳米颗粒,重塑肿瘤微环境实现甲状腺癌的声动力/化学联合治疗
时间:2024-09-03 18:00:48 热度:37.1℃ 作者:网络
甲状腺癌在全球范围内呈上升趋势,其中甲状腺未分化癌(ATC)是最具侵袭性的类型,预后较差。目前甲状腺癌的临床治疗面临多种挑战,如侵入性、必须终身服药。此外,很大一部分ATC患者会出现癌症复发和转移。
2024年8月29日,西安交通大学周琦、张明真、Zhang Yujie共同通讯在Biomaterials上在线发表题为“ A versatile nanoplatform carrying cascade Pt nanozymes remodeling tumor microenvironment for amplified sonodynamic/chemo therapy of thyroid cancer”的研究论文。该研究通过在中空聚多巴胺纳米颗粒(HP)中掺入二氢卟吩e6(Ce6)和乐伐替尼(Len),开发了一种pH响应性仿生纳米载体(CLP@HP-A),随后用铂纳米Pt修饰,实现协同化疗和声动力治疗。
CLP@HP-A能够与半乳糖凝集素-3受体的特异性结合,通过受体介导的内吞作用促进其内吞,实现靶向药物递送。超声(US)照射后,Ce6迅速产生活性氧(ROS),诱导强烈的氧化应激反应并触发肿瘤细胞凋亡。此外,Pt不仅通过催化H2O2转化为氧(O2)来缓解肿瘤缺氧,而且还通过产生羟基自由基(•OH)来增加细胞内ROS水平,提高声动力学治疗效果。此外,Len通过诱导细胞凋亡,表现出对甲状腺癌细胞的细胞毒性作用。转录组学分析进一步证实CLP@HP-A有效触发癌细胞凋亡。总的来说,声动力学/化疗联合疗法与靶向药物递送系统的整合为恶性肿瘤的治疗提供了一种新方法。

甲状腺癌是最常见的内分泌系统恶性肿瘤,近年来全球发病率迅速上升。甲状腺未分化癌(ATC)是一种高度侵袭的恶性肿瘤,在疾病初期表现出广泛的局部浸润和远端转移,使得早期发现和诊断变得尤为困难。据报道,ATC占美国甲状腺癌相关死亡人数的40-50%。.目前,甲状腺癌的主要治疗方法是手术,辅以放射性碘(RAI)治疗和化疗,但现有疗法对ATC患者的影响有限,尤其是那些伴有邻近组织浸润和转移的患者。ATC患者的预后较差,中位生存期为5个月,1年生存率仅为20%,疾病复发率约为30%。因此,迫切需要为ATC患者开发改善预后和延长无症状生存期的新疗法。
Lenvatinib(Len)是一种口服多靶点酪氨酸激酶抑制剂(TKI),特异性结合血管内皮生长因子受体1-3(VEGFR1-3)、成纤维细胞生长因子受体(FGFR)等。许多研究表明,VEGF/VEGFR可以促进肿瘤微血管和淋巴管再生,是介导癌症复发和淋巴结转移的重要机制。临床III期试验(SELECT)结果表明,接受Len治疗的甲状腺癌患者中位无进展生存期(PFS)为18.3个月,比安慰剂组长3.6个月。此外,Len治疗晚期RAI难治性TC患者的缓解率(RR)高达50%,PFS组为12.6个月。目前,Len已被FDA批准用于甲状腺癌临床治疗。然而,由于口服和高剂量的药物治疗,超过50%的患者会出现高血压、腹泻、疲劳等明显副作用。

图1 空心聚多巴胺负载Pt的纳米酶用于甲状腺癌声动力治疗/化疗示意图(摘自Biomaterials)
声动力疗法(SDT)是一种非侵入性治疗方式,超声照射下可产生大量ROS杀死肿瘤细胞。由于SDT在组织穿透深度和聚焦性能方面具有突出优势,近年来在实体瘤研究中得到了广泛应用。然而,SDT在缓解肿瘤微环境缺氧和提高肿瘤部位致敏剂富集方面仍存在挑战,极大地阻碍了SDT的疗效。令人欣慰的是,靶向药物递送系统为解决上述问题提供了一个完美的平台。靶向药物递送系统可以通过主动或被动靶向将药物运送到特定部位以发挥药理活性,除靶点特异性外,还具备多药物负载能力和肿瘤微环境响应性药物释放等优点。
半乳糖凝集素-3(Gal-3)是一种β-半乳糖苷结合蛋白,在许多人类癌症和包括甲状腺癌在内的转移性淋巴结中高表达,为实现癌症的精确药物递送提供了重要靶点。柑橘果胶二醛(CPDA)是柑橘果胶(CP)的低分子量二醛低聚物,可通过β-半乳糖苷键与Gal-3特异性偶联。CPDA在血液浓度、吸收和降解方面优势更为明显,同时保留了CP的Gal-3结合特性。Gal-3靶向药物递送可以使药物精确到特定肿瘤部位并提高致敏剂富集。此外,据报道Pt纳米颗粒具备类过氧化氢酶(CAT)活性,可以通过分解内源性H2O2来产生O2。Pt还具有类SOD活性,催化O2•− 转化为H2O2,随后Pt的类似POD活性进一步催化H2O2为·OH。因此,Pt纳米颗粒不仅可以缓解肿瘤微环境的缺氧,还可以增加肿瘤组织ROS的产生,是提高SDT疗效的有效方法。
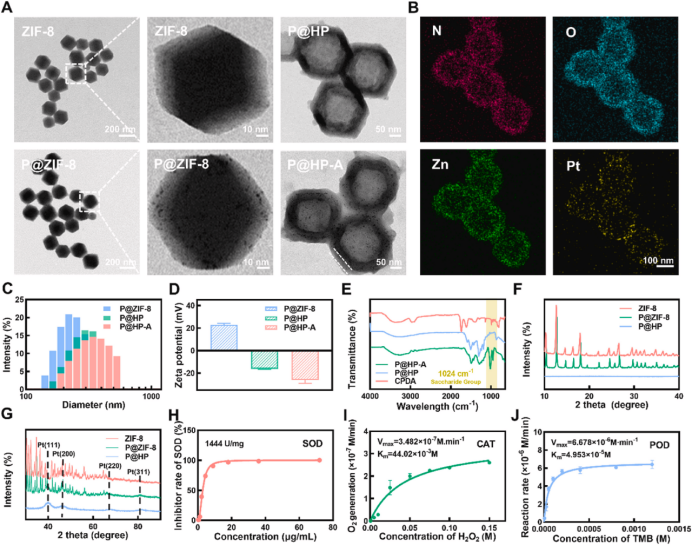
图2 P@HP-A的表征图(摘自Biomaterials)
该研究开发了一种中空聚多巴胺载体,并掺入Pt纳米颗粒,随后用柑橘果胶二醛(CPDA)(一种半乳糖凝集素-3靶向分子)进行修饰,负载声敏剂/Ce6和Len,得到纳米反应器CLP@HP-A。CLP@HP-A与甲状腺肿瘤细胞表面过表达的Gal-3特异性相互作用,然后通过受体介导的内吞作用递送到细胞内。根据聚多巴胺的pH响应特性,CLP@HP-A在酸性溶酶体中分解并释放负载药物,包括Ce6、Len和Pt。超声照射下,激活Ce6产生足够的ROS,引起线粒体氧化应激,诱导肿瘤细胞死亡。同时,释放的Pt通过类CAT活性产生大量O2以缓解肿瘤缺氧,并在内源性H2O2存在下产生细胞毒性·OH,进一步升高细胞内ROS水平以增强细胞内氧化应激。此外,释放的Len通过诱导细胞凋亡发挥更强的抗肿瘤作用,同时降低了不良事件的发生率。总之,CLP@HP-A纳米反应器为甲状腺癌的靶向药物(Ce6/Len)递送和超声照射下高效产生ROS,以实现甲状腺肿瘤的SDT和化疗联合提供了新视角。
参考消息:
https://www.sciencedirect.com/science/article/pii/S0142961224003120?via%3Dihub


