【每日一例】Cronkhite-Canada综合征伴膜性肾病一例
时间:2022-10-13 15:52:54 热度:37.1℃ 作者:网络
图1胃镜结果 1a 胃及十二指肠多发息肉,大小不等(0.2~2.0 cm),分叶状,表面充血糜烂,基底较宽并融合1b 胃底胃体黏膜多发色素沉着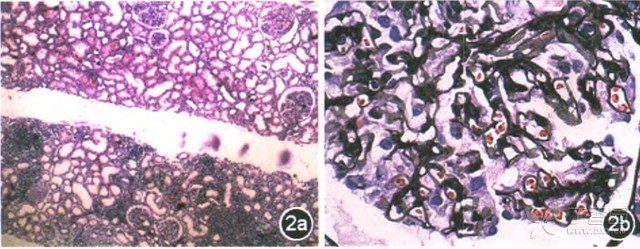
图2光镜观察31个肾小球4个硬化,偶见节段性系膜细胞增生和基质增多;基底膜弥漫性增厚,较多钉突;肾小管上皮细胞颗粒变性,管腔内少量蛋白管型;灶性至片状分布的肾小管基底膜增厚和肾小管萎缩:间质灶性乃至片状纤维化.伴大量密集的淋巴细胞、浆细胞、单核细胞及散在嗜酸性粒细胞浸润 2a HE×200 2b PASM×100
患者男,64岁。因"反复腹胀、腹泻、水肿4年"来我院就诊。患者4年前出现腹胀、间断腹泻、食欲下降、指甲萎缩、体重下降约15 kg。3年前内镜示消化道多发息肉,病理示十二指肠降部灶性管状腺瘤I级,胃大弯增生性息肉,降乙交界、降结肠化生性息肉,横结肠、降结肠幼年性息肉,伴轻中度异型性.外院共行息肉切除术6次。4年前患者同时出现双下肢水肿,夜尿增多;尿潜血阴性,尿蛋白+~++,肌酐(Cr)95-122μmol/L,白蛋白(Alb)28-35g/L;半年前复查尿潜血+~+++,尿蛋白++~++++,24 h尿蛋白2.1 g。
否认面部红斑、口干、眼干、猖獗龋齿、光过敏、雷诺现象、关节痛病史。否认阳性家族史。入院体检:皮肤干燥,头发稀疏,枕秃,趾指甲无光泽,部分脱落变形,双下肢轻度水肿。入院检查:血常规:白细胞计数8.23×109/L,嗜酸性粒细胞计数0.8×109/L;肝肾功能:Alb 27 g/L,血Cr 112μmol/L[估算的肾小球滤过率(eGFR)60.1 ml·min-1.1.73 m-2,总胆固醇6.82 mmol/L,低密度脂蛋白胆固醇4.61 mmol/L。
淋巴细胞培养联合干扰素释放试验:共计336个释放γ干扰素的细胞/106个外周血单个核细胞。尿沉渣:尿蛋白1 g/L,红细胞25~80个/μl,异形细胞95%,大量颗粒管型,上皮细胞173/μl;24 h尿蛋白定量5.15~8.31 g;尿渗透压662 mOsm/kgH20。抗核抗体H 1:160;抗双链DNA、抗可溶性抗原、抗中性粒细胞胞浆抗体均阴性;C4 0.039g/L,C3 0.438 g/L,补体CH50 9.4 U/ml;红细胞沉降率、IgG亚型、血免疫固定电泳均阴性。
角膜染色(-)、唾液流率及腮腺造影结果正常。胃镜及结肠镜:胃、十二指肠、回肠、回盲瓣、升结肠多发息肉,胃底胃体黏膜多发色素沉着(图1)。病理:胃底胃黏膜呈慢性炎症、散在嗜酸性粒细胞浸润;胃窦病变符合错构瘤性息肉;十二指肠降段符合增生性息肉;结肠增生性息肉;回肠黏膜急性及慢性炎症,间质中较多浆细胞,免疫组化:CD138、CD38、浆细胞灶性(+),IgG4阴性。肾脏穿刺病理:Ⅱ期膜性肾病伴小管-间质损害(图2)。唇腺活检:小叶结构尚清,局限腺体轻度萎缩,小导管扩张,弥漫性淋巴细胞浸润(>50个细胞);免疫组化:CD138(少量+)、CD38(个别+)、浆细胞(+),IgG4阴性。诊断:Cronkhite-Canada综合征(CCS)、Ⅱ期膜性肾病、肾病综合征。
治疗:泼尼松50 mg 1 次/d,2个月后逐渐减量;环磷酰胺0.2~0.6 g静脉注射1影周,累计剂量7.5 g;续以环孢素A 100mg 2次/d+雷公藤20 mg 2次/d治疗;随访10个月,水肿、腹泻缓解,复查肠镜:全结肠未见异常,十二指肠仍可见少许小息肉;24 h尿蛋白0.38 g,血生化:Alb 29g/L,血Cr 98 μmol/L。
讨论
CCS是一种罕见的以弥漫胃肠道息肉和外胚层异常三联征为特点的综合征,多见于成年人,平均发病年龄50~60岁,男女比约3:2,常呈特发性,无家族聚集倾向。日本学者将CCS分为5型:I型(腹泻型),II型(味觉减退型),Ⅲ型(口腔干燥型),Ⅳ型(腹部不适型)及V型(毛发脱落)。以前2型最常见。
根据较为典型的消化道及外胚层症状,本例患者CCS诊断明确。此外患者存在胃黏膜下多发色斑,提示CCS的外胚层改变受累器官不局限于皮肤。既往文献中CCS合并肾脏病变罕见。结合本例以及既往3例CCS合并膜性肾病、肾病综合征、狼疮肾病的个案进行分析,CCS合并肾病的原因可能有二:(1)合并胃肠道肿瘤,继之导致肿瘤相关性肾病:胃肠道肿瘤可能是CCS最常见的并发症,发生率高达14.5%一18.6%,CCS合并肾病的病例中曾有合并结肠癌的报道。
(2)免疫介导:CCS发病机制未明,但许多证据表明它可能是一种自身免疫病。首先,CCS患者抗核抗体阳性率高且易合并系统性红斑狼疮、甲状腺疾病、干燥综合征等自身免疫病。Riegert-Johnson等及Sweetser等均发现CCS息肉中IgG。阳性细胞数较其他类型消化道息肉显著增多,CCS息肉IgG4沉积提示CCS不除外是一种IgG。
相关的自身免疫病。CCS对糖皮质激素(下称激素)及免疫抑制剂敏感。梅奥诊所随访11例CCS患者,激素治疗3个月内10例患者有效(8例完全缓解,2例部分缓解,5例息肉消失);5例患者加用硫唑嘌呤,随访4.5年持续缓解;李曼等总结了国内42例CCS个案的临床资料,12例激素治疗者10例不同程度好转。激素有效不仅表现为胃肠道息肉显著减轻,外胚层改变也反应较好。本例患者足量激素及免疫抑制剂治疗后症状改善,结肠息肉完全缓解,24 h尿蛋白显著下降,临床获益明显。膜性肾病也是一种自身免疫病。
患者低补体血症较突出,推测该疾病激活了补体系统,其致病过程可能有免疫因素介导。此外,CCS息肉中嗜酸性粒细胞浸润常见,本例患者消化道、唾液腺、肾脏病变均发现较多淋巴细胞及少许嗜酸性粒细胞浸润,存在同源性,故患者的临床症状可能为一种系统性疾病在不同脏器的浸润。
综上,我们报道了一例罕见的CCS合并Ⅱ期膜性肾病及间质性肾炎病例,结合患者临床特点,参考既往文献推测CCS主要致病机制为非感染性,免疫介导可能性大。虽然CCS尚无法治愈,梅奥单中心经验、许多回顾性研究及本病例均提示激素有利于控制病情;鉴于激素单药治疗存在停药复发、激素依赖等问题,联用免疫抑制剂可能有助于维持病情缓解。本病例试用环磷酰胺、环孢素A、雷公藤治疗,初步观察疗效良好,远期疗效尚待进一步评估。


