Nat Genet:基于单细胞多组学技术解析DNMT3A R882突变在人类克隆造血中的影响
时间:2022-10-14 05:59:37 热度:37.1℃ 作者:网络
体细胞突变在人体健康组织中普遍存在,其比例也随着生理年龄的增长而增加。已有研究表明,健康人体组织克隆生长产物中的体细胞突变与癌症的复发驱动因子重叠(如TP53、PIK3CA和NOTCH1),表明癌症可能由癌前克隆嵌合体产物引起。
克隆性造血(clonal hematopoiesis, CH)通常指与某种获得性基因突变相关的髓系细胞增生,并与衰老相关。DNMT3A是CH中突变最频繁的基因,其编码一种DNA甲基转移酶。DNMT3A R882的热点突变在CH中较为常见,与髓系恶性肿瘤风险增加有关,并被怀疑代表某些肿瘤发展(如急性髓细胞白血病等)的早期阶段。CH提供了一个独特的环境来研究非恶性人类造血中DNMT3A突变的分子后果,但CH中的突变细胞在形态学和表型上与混合的野生型细胞相似,科研人员很难将基因型与表型联系起来。
近日,美国威尔康奈尔医学院团队与Dana-Farber癌症研究所的研究团队合作在Nature Genetics发表了题为“Single-cell multi-omics of human clonal hematopoiesis reveals that DNMT3A R882 mutations perturb early progenitor states through selective hypomethylation”的文章。研究团队应用单细胞多组学测序技术捕获单个细胞的突变状态以及下游表观遗传和转录信息,直接在原始人类样本中比较来自同一个体的突变细胞与其野生型对应体。该研究详细描述了DNMT3A R882热点突变对CH的影响以及体细胞驱动突变对克隆嵌合体的影响,揭示血液干细胞中常见的DNA甲基转移酶突变可能通过甲基化和基因表达的变化而导致疾病的发生。

文章发表在Nature Genetics
主要研究内容
人CD34+单细胞转录组测序中的DNMT3A R882基因分型
研究团队首先从CH样本中分离出活的CD34+细胞,并使用GoT30对转录组数据进行基因分型,捕获带有R882密码子的细胞。为绘制CH中CD34+祖细胞分化的轨迹,研究团队整合了不同样本的转录组数据,确定了可预期的祖细胞亚型。结果显示,DNMT3A突变并未形成新的细胞特征,这与CH患者没有表现出明显的外周血计数或形态学异常的临床特征相一致。相反,研究团队观察到CH中的突变型和野生型细胞在整个过程中都混合在一起,因此需要通过单细胞多组学将基因型与细胞表型联系起来进行更深入的研究。
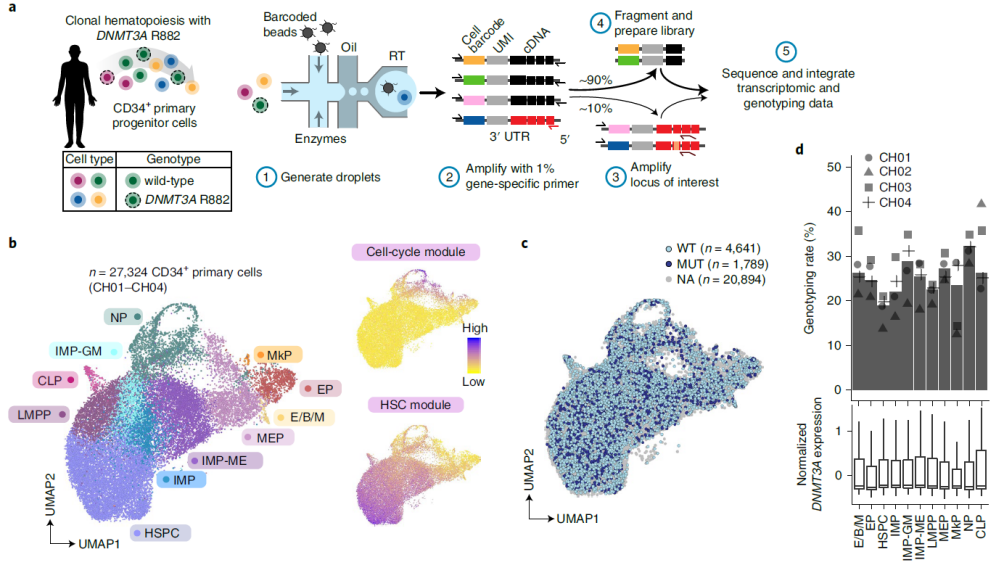
图1. 克隆造血分化过程中DNMT3A R882突变和野生型细胞混杂分布。来源:Nature Genetics
DNMT3A突变的人类祖细胞表现出谱系偏倚
研究团队将上述数据映射到造血分化路径上,发现携带DNMT3A R882热点突变的细胞分化表现出髓系偏倚,而非淋巴系偏倚。此外,突变的未成熟髓系祖细胞显示出巨核细胞-红细胞谱系扩增。上述研究结果表明,在造血系统肿瘤的恶性转化前期,转录因子活性的集中失调伴随着谱系和转录紊乱。
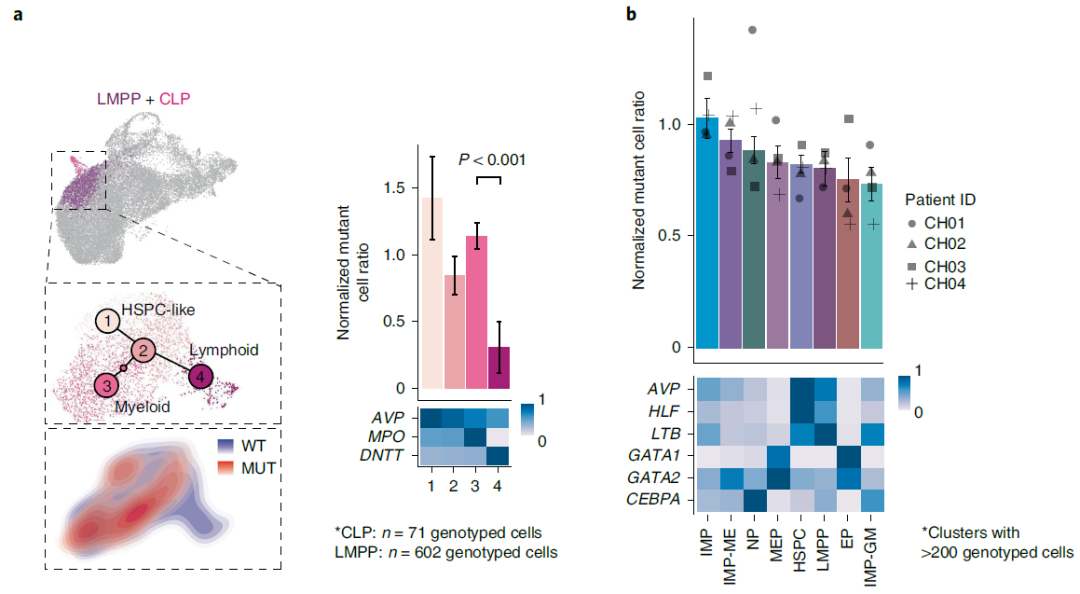
图2. DNMT3A R882突变CH细胞在关键节点表现出明显的分化倾向。来源:Nature Genetics
多组学解析DNMT3A突变引起的后果
为将因DNMT3A突变而引起的转录调节网络改变和DNA甲基化特征相关联,研究团队对来自相同个体的CD34+祖细胞进行多模态单细胞测序,以捕获DNA甲基化、转录组信息和靶向DNMT3A基因分型,可以比较来自同一个体的突变和野生型细胞的甲基化状态,单细胞转录组数据确定了主要的祖细胞身份。结果发现,突变组CpG岛的DNA甲基化特征减少。深入分析显示,与野生型细胞相比,DNMT3A R882细胞中增强子区域表现出显著的低甲基化以及全局低甲基化。
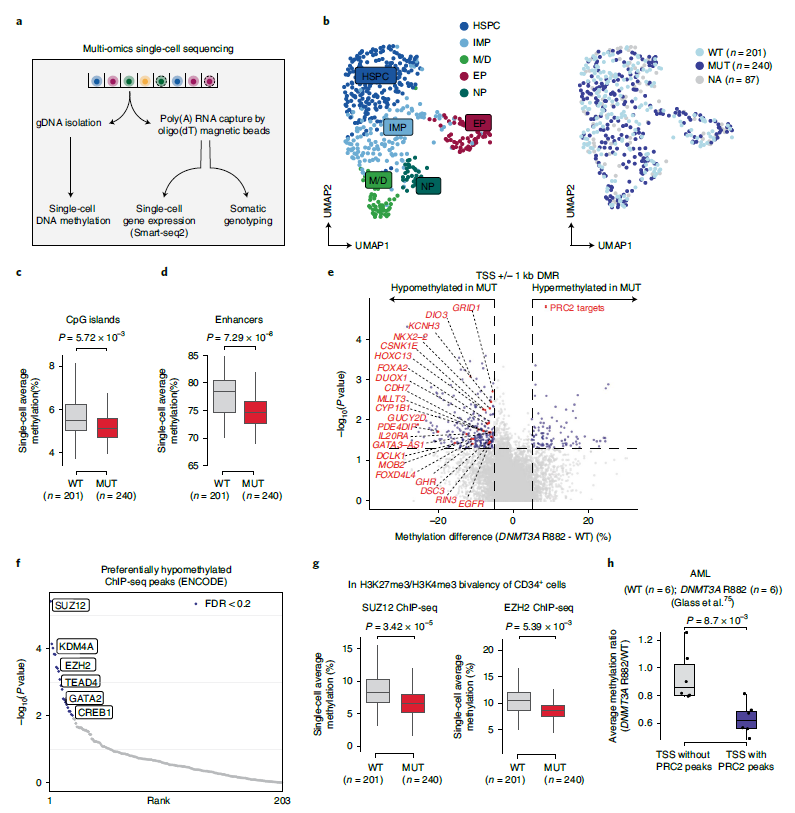
图3. DNMT3A R882促进人类造血过程中PRC2靶点的选择性低甲基化。来源:Nature Genetics
由于DNMT3A编码DNA甲基转移酶,研究团队特别检查了热点突变对甲基化模式和基因表达的影响。结果显示,DNMT3A R882热点突变导致多梳抑制复合物2(PRC2)靶标以及特定CpG侧翼基序的优先低甲基化。值得注意的是,低甲基化基序富含造血转录因子(如MYC/MAX、HIF1A/ARNT和USF1/2)的结合序列,可作为DNMT3A突变和异常转录表型之间的潜在关联机制。此外,MYC/MAX等位点的低甲基化也导致其转录靶点的表达增加。
上述结果显示,单细胞多组学方法为人们分析CH中因DNMT3A突变而导致的转录畸变提供了一个潜在的模型,支持通过关键造血转录因子结合序列的选择性低甲基化增强DNMT3A突变细胞的适应性。
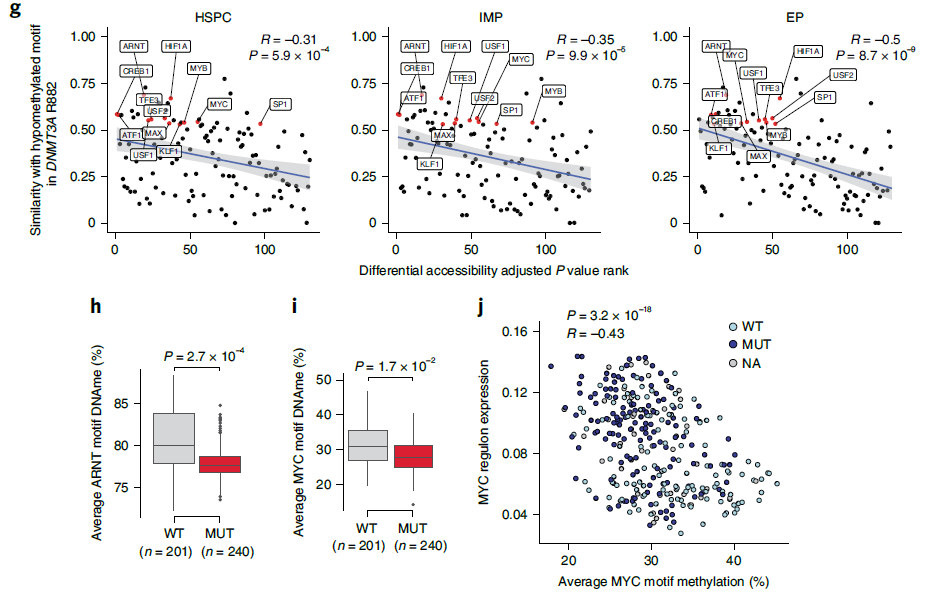 图4. DNMT3A R882显示与MYC结合基序相关的序列特异性。来源:Nature Genetics
图4. DNMT3A R882显示与MYC结合基序相关的序列特异性。来源:Nature Genetics
结 语
综上所述,该研究报道了人类CH原代CD34+细胞中DNMT3A R882突变的分子结局,并发现了关键的表观遗传和转录变异,这些变异重塑了造血分化的谱系偏向,并促进了肿瘤最初生阶段的克隆扩增。同时,该研究也证明了新兴的单细胞多组学方法在解决复杂科学问题方面的独特优势,为研究体细胞突变如何驱动人类体细胞进化中的正常组织嵌合体铺平了道路。
文章第一作者Anna S. Nam博士表示:“我们发现了一种将DNMT3A R882热点突变与非典型转录表型联系起来的机制。这些发现为未来可能针对相关细胞进行干预以预防癌症和其他克隆生长相关疾病铺平了道路。”
参考文献:
Nam, A.S., Dusaj, N., Izzo, F. et al. Single-cell multi-omics of human clonal hematopoiesis reveals that DNMT3A R882 mutations perturb early progenitor states through selective hypomethylation. Nat Genet (2022). https://www.nature.com/articles/s41588-022-01179-9


