瘦素与皮肤病研究进展
时间:2023-07-31 11:25:21 热度:37.1℃ 作者:网络
脂肪因子是由脂肪组织分泌的一系列生物活性物质,参与脂质和糖类代谢、炎症反应、凝血过程与血管稳态的调节。瘦素是脂肪因子中的一种,现有大量研究证实其在不同皮肤病的发生发展过程中起重要作用,并有可能成为多种皮肤疾病的治疗靶点。
瘦素的作用机制及生理功能
瘦素由7q31.3号染色体编码,主要由白色脂肪组织合成和分泌,由167个氨基酸组成,在食物摄入和能量消耗控制中起着关键作用。瘦素通过其跨膜受体(LEPR)发挥作用 ,LEPR分为6个亚型(LEPRa~f),下丘脑、成纤维细胞、内皮细胞、角质形成细胞、脂肪细胞和血液单核细胞均表达LEPR。瘦素可激活多种信号通路,其中Janus激酶/信号转导及转录激活因子(JAK/STAT)通路是主要通路。
瘦素与受体结合后,Janus激酶(JAK)2被激活,随后促进信号转导和转录激活因子(STAT)3的磷酸化,继而发生二聚化入核发挥其转录因子的活性功能,影响靶基因的表达,而产生的细胞因子信号转导抑制因子(SOCS)3蛋白又能抑制激活的JAK2/STAT3通路,从而构成负反馈。此外,瘦素还可通过增加电子流量、氧化还原反应的效率和能量利用,影响线粒体代谢。
瘦素受体的广泛分布决定了瘦素的多效性特点。在中枢,瘦素主要作用于下丘脑神经元细胞,通过影响大脑皮层和边缘区域来抑制食欲,并通过负反馈刺激能量消耗。在外周区域瘦素具有多种功能,如刺激血管生成,调节激素分泌,调节促炎细胞因子的产生等。生理情况下,外周瘦素水平遵循昼夜节律,在夜间达到峰值。血液中瘦素浓度与脂肪组织量和身体质量指数(BMI)呈显著正相关,肥胖会导致不可控的循环瘦素水平上升和瘦素抵抗,失去了其抑制食欲的作用。瘦素抵抗现象可能是瘦素信号通路障碍的结果,瘦素与受体的结合被限制,进而改变其受体的表达或信号转导。
除了调节能量代谢,瘦素还影响免疫系统。瘦素在先天免疫中的主要作用包括刺激单核巨噬细胞的吞噬和增殖、刺激中性粒细胞的趋化和氧自由基的释放、增强天然杀伤细胞(NK)的细胞毒性和增殖等。并且瘦素可以促进树突状细胞释放白细胞介素(IL)-8、IL-12、IL-6和肿瘤坏死因子(TNF)-α,且通过影响淋巴细胞受体,促进Th1/Th2平衡向Th1偏移,导致炎症加重。瘦素对免疫系统的广泛影响提示其在自身免疫性疾病的发病机制中可能发挥作用。此外,瘦素还在生殖发育、糖脂代谢和胰岛素敏感性等方面发挥重要作用。
瘦素通过多种方式参与皮肤的病理生理过程
虽然脂肪细胞是合成瘦素的主要部位,但研究表明瘦素及其受体在人和小鼠皮肤角质形成细胞、成纤维细胞、毛乳头细胞、毛母质及内根鞘等处均有表达。瘦素可通过激活STAT3信号通路,刺激角质形成细胞和成纤维细胞增殖、上皮化和胶原合成,并调节血管生成,从而引起皮肤的改善和再生。皮肤损伤后,局部合成和分泌瘦素增加,使伤口愈合时间缩短。
此外,瘦素还通过激活人β-防御素(hBD)-2促进皮肤抗菌防御。Lee等通过观察正常人角质形成细胞的全基因组转录反应,探究了瘦素影响角质形成细胞的分子机制,发现瘦素增强细胞内信号转导,并通过促进白细胞介素的产生在角质形成细胞中诱导炎症反应。
瘦素与皮肤疾病及其治疗
1.瘦素与毛发疾病
临床研究发现,雄激素性脱发(AGA)患者中血浆瘦素水平显著高于非AGA的对照组,且瘦素水平与脱发严重程度成正相关。尽管瘦素可能参与了一些自身免疫性疾病的发病机制,但研究显示斑秃患者和健康对照者血清瘦素浓度之间的差异无统计学意义。

毛乳头及内毛根鞘等不仅可分泌瘦素,并且存在瘦素受体。瘦素受体缺乏的db/db转基因小鼠毛发生长期延迟,在野生型小鼠剃毛的背部皮肤中注射瘦素20d后,注射区毛发生长,而db/db转基因小鼠局部注射瘦素未见毛发生长。瘦素水平在毛囊生长期初期最低,在生长期后期逐渐升高,静止期最高,也表明瘦素可能诱导毛囊进入生长期。
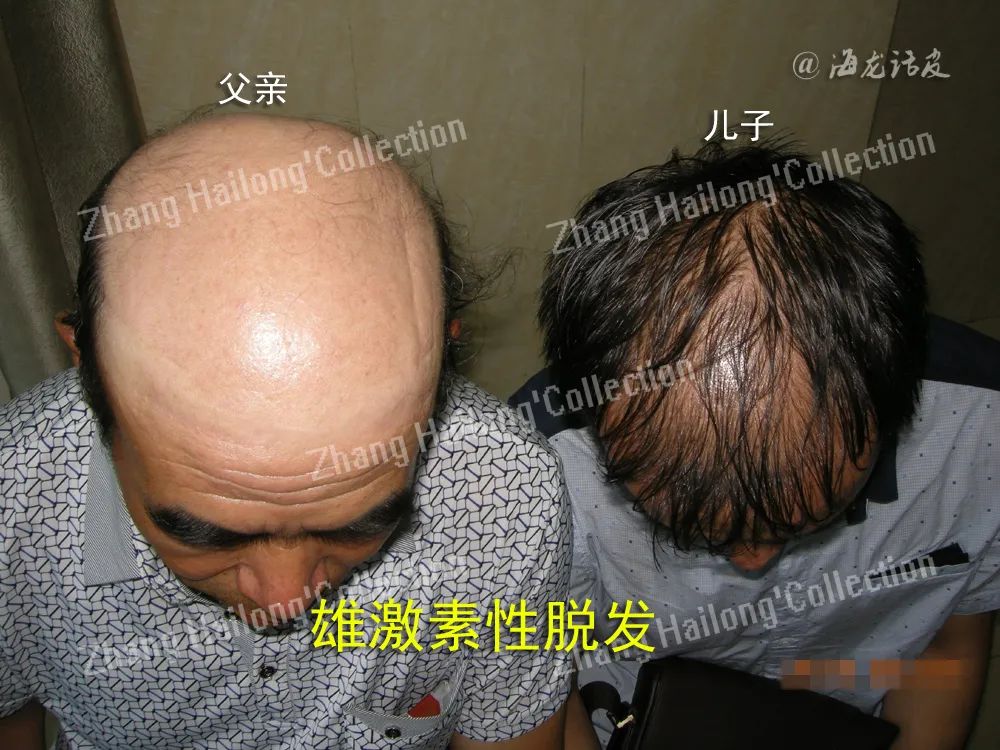
皮下注射瘦素对雄激素性脱发模型小鼠有明确治疗作用,且效果与外用5%米诺地尔溶液作用相当。但瘦素影响毛发周期和毛发生长的确切机制仍未完全明确,因此还需要更多的研究来进一步探讨瘦素与毛发疾病之间的关系。近期Gao等利用表面标记LEPR成功实现大规模分离功能性毛乳头细胞,为利用分离的毛乳头细胞治疗脱发打下了坚实的基础。
2.瘦素与银屑病
银屑病是一种由免疫介导的慢性炎症性皮肤病,常与高血压、肥胖、糖尿病、代谢综合征及心血管疾病和抑郁等共存。在银屑病中,激活的T细胞在真皮-表皮交界处通过刺激TNF-α,干扰素和各种 ILs 的产生诱导增生反应。瘦素促进IL-1、IL-6、趋化因子(CXCL)8和TNF-α的产生,可能诱导了银屑病的发生。上述过程刺激Th1/Th17轴,导致IL-17/IL-23升高。
此外,瘦素参与的JAK/STAT通路也增强了该轴的激活,可加剧银屑病病变中的血管生成。综上,瘦素在炎症中有双重作用:增强促炎细胞因子TNF-a及白介素的产生,并使T细胞向Th1表型分化。皮肤中瘦素水平的提高可能会诱导产生一种表皮生长因子蛋白—双向调节蛋白,在角质细胞增殖中发挥作用。因此抑制瘦素促炎作用的药物可能是银屑病的一种新的治疗方法。

研究发现重度银屑病患者中,瘦素和瘦素受体表达明显高于健康对照,且根据银屑病面积和严重程度指数(PASI)评估显示,血清瘦素浓度与银屑病严重程度呈正相关,全身治疗银屑病后瘦素的外周水平下降。然而也有研究发现银屑病患者和对照组的瘦素水平差异无统计学意义。Chelesch等研究发现,与类风湿关节炎(RA)相比,银屑病性关节炎(PsA)患者的循环血清瘦素较高, 因此瘦素有可能成为鉴别PsA和RA的标志物。
银屑病与瘦素基因多态性的关系目前研究较少,Abdel和Rashed提出瘦素基因G2548A多态性可作为血浆瘦素水平升高和银屑病风险增加的预测因子。Szentkereszty-Kovács Zita等的研究结果表明,瘦素受体基因中的rs1137101与早发型银屑病患者的肥胖相关。重组人甲硫氨酰瘦蛋白(metreleptin,美曲普汀)是FDA于2014年批准的一种皮下给药的瘦素类似物,用于全身性脂代谢障碍的患者。对于先天性瘦素缺乏的肥胖患者应用瘦素替代治疗,可以减重并且改善相关的代谢并发症如胰岛素抵抗、高三酰甘油血症。而瘦素类似物对于肥胖相关皮肤疾病的治疗前景仍需探索。
3.瘦素与系统性硬化症
系统性硬化症(SSc)的特点为血管和免疫功能紊乱引起纤维化,皮肤局限或弥漫性增厚变硬,与皮下组织萎缩有关。在小鼠模型中,瘦素增加抗核抗体的产生。在角质形成细胞中,瘦素促进了IL-6、IL-8和TNF-α的产生 并且促进Th淋巴细胞转化为Th1,从而加剧了炎症过程。此外,瘦素促进M1巨噬细胞的生长和分化。瘦素作为趋化因子,致使巨噬细胞进入脂肪组织,参与SSc患者局部炎症的形成。

研究显示,SSc患者血清瘦素水平明显高于健康对照组,非活动期SSc患者与活动期患者相比,瘦素在血液循环中的浓度较高。这与SSc早期和活动期以Th2淋巴细胞为主,非活动期以Th1淋巴细胞为主有关。这些研究结果提示瘦素可能是疾病严重程度的潜在标志物。脂肪因子在SSc中的作用仍需要深入的研究。
4.瘦素与系统性红斑狼疮
系统性红斑狼疮(SLE)是一种以免疫系统的异常活化和自身抗体异常增多为特征的自身免疫性疾病。最近瘦素在SLE发病机制中可能的作用受到重视。SLE发病机制涉及凋亡细胞的清除受损,对自身抗原的耐受性丧失,T细胞和B细胞的异常激活,以及慢性炎症。瘦素通过作用于淋巴细胞影响SLE,其通过维A酸受体相关孤儿受体γ(RORγ)促进淋巴细胞Th17亚型的分化,增加IL-17的合成,促进SLE的Th17反应。
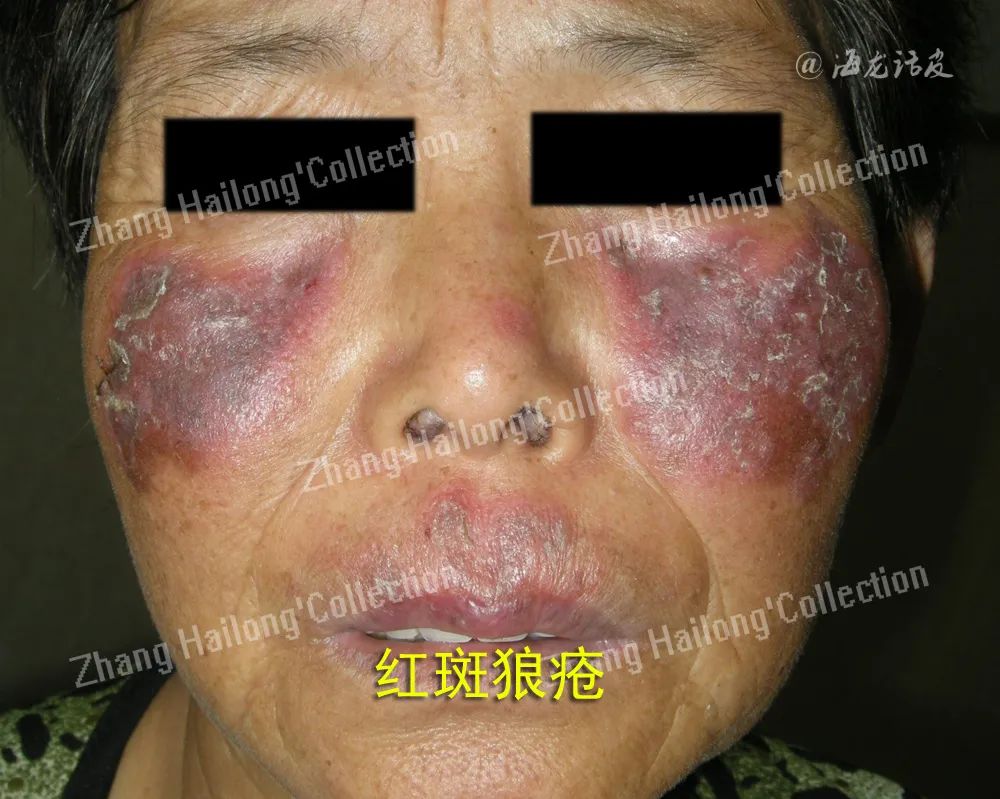
此外,瘦素可促进SLE模型小鼠自身反应性T淋巴细胞的存活和增殖。瘦素对T调节亚型(Treg)的抑制作用也被提出。Lourenço等研究证实瘦素缺乏的小鼠不易患SLE,并且比非瘦素缺乏小鼠晚发展为狼疮肾炎。瘦素的水平在自身抗体形成之前就开始增加了,这表明瘦素在SLE的发展中起重要作用,可能通过其调控B细胞的发育和成熟。
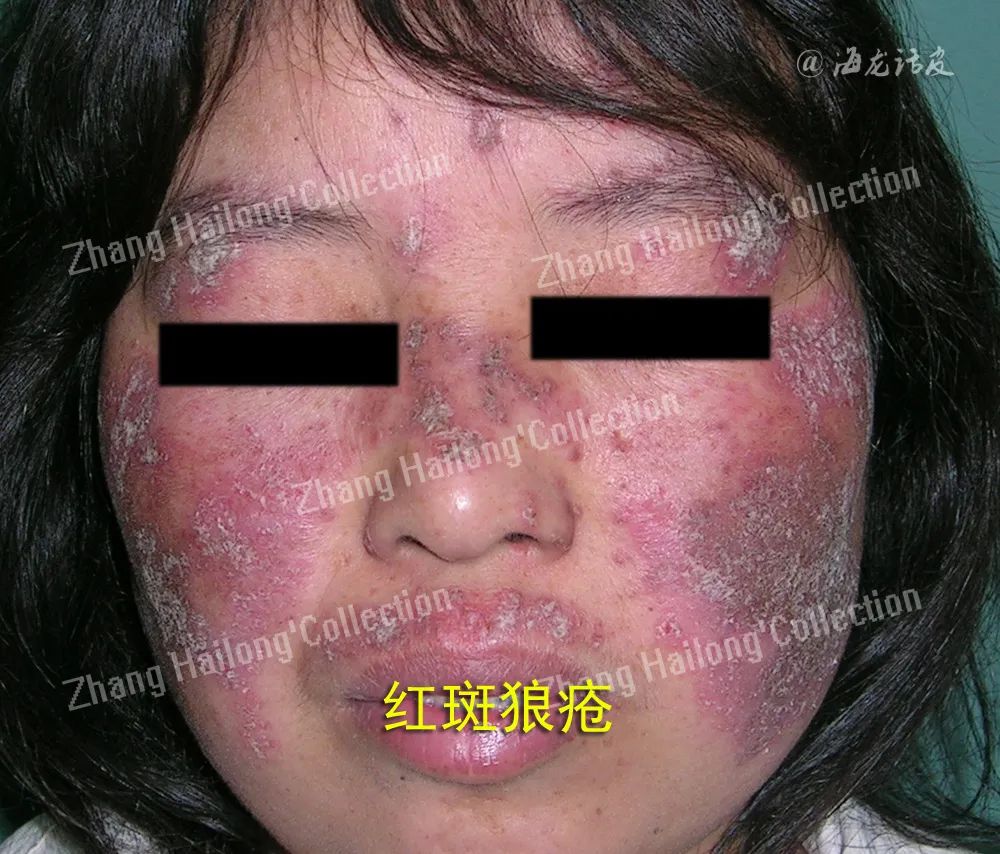
瘦素还通过作用于免疫细胞影响SLE。瘦素与中性粒细胞活化蛋白(NAP)-2激活PI3k/Akt信号通路,导致间充质干细胞老化。在SLE中,瘦素可能影响免疫细胞亚群的数量、细胞因子的分泌和抗凋亡蛋白的表达,还可通过激活JAK/STAT3/5和ERK1/2通路加速B细胞功能障碍,但瘦素与SLE的相互作用目前还不完全清楚。临床试验中SLE患者血清瘦素水平与对照组比较的研究结果也不一致,活动期和非活动期患者之间差异无统计学意义。
5.瘦素与皮肤肿瘤
肥胖和脂肪组织过量会导致瘦素水平升高,并增加许多肿瘤的风险。黑素瘤是一种与肥胖相关的恶性肿瘤。据文献报道,瘦素浓度增加可能会加速黑素瘤的生长。Malvi等对小鼠模型进行的研究表明,无论是通过药物干预体重还是通过饮食限制体重都可以抑制黑素瘤的快速发展。Vuletic等研究了LEPR表达对皮肤鳞状细胞癌(cSCC)临床形态学特征的影响,发现LEPR的表达对肿瘤的增殖和组织学分级有统计学意义,是cSCC恶性潜能的预测因子,这为使用LEPR拮抗剂进行个体化抗肿瘤治疗提供了可能性。
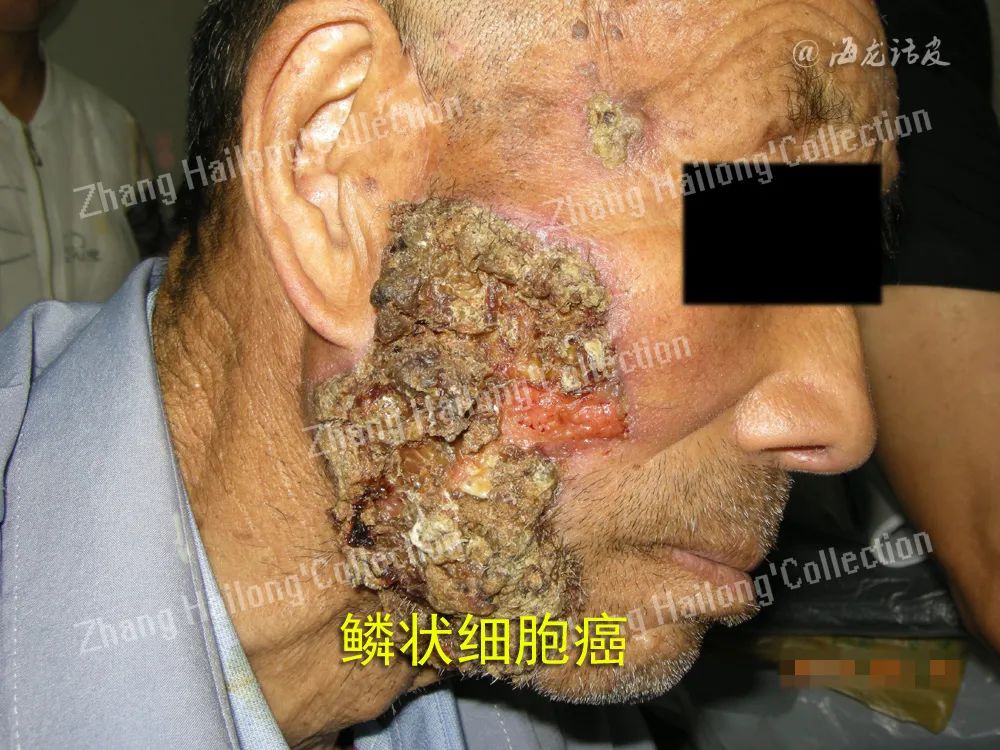
此外,肥胖还会影响某些类型癌症的治疗反应。瘦素途径可能介导肥胖相关的化疗反应损伤。Chi等认为脂肪因子可能导致黑素瘤细胞对化疗药物和靶向PI3K/Akt和MEK/ERK通路药物的耐药性,抑制瘦素或其受体系统可以提高治疗黑素瘤的疗效。目前基于部分降低瘦素水平,改善瘦素抵抗来治疗肥胖及其相关共病的研究还仅停留在动物实验水平。
6.瘦素与痤疮
皮脂腺对瘦素的刺激显示出炎症反应,表现为皮脂生成增多,STAT-3和核因子(NF)-κB通路被激活,并且细胞因子IL-6和IL-8的分泌增加,提示瘦素信号通路可能调控皮脂代谢。痤疮是一种毛囊皮脂腺的慢性炎症性疾病,发病机制包括皮脂溢出、毛囊皮脂腺导管口的异常角化及痤疮丙酸杆菌的感染等,因此推测瘦素可能参与痤疮的发生。然而目前对于瘦素和痤疮的关系各个研究结果不一,荟萃分析显示血清瘦素水平与寻常痤疮没有显著相关性。
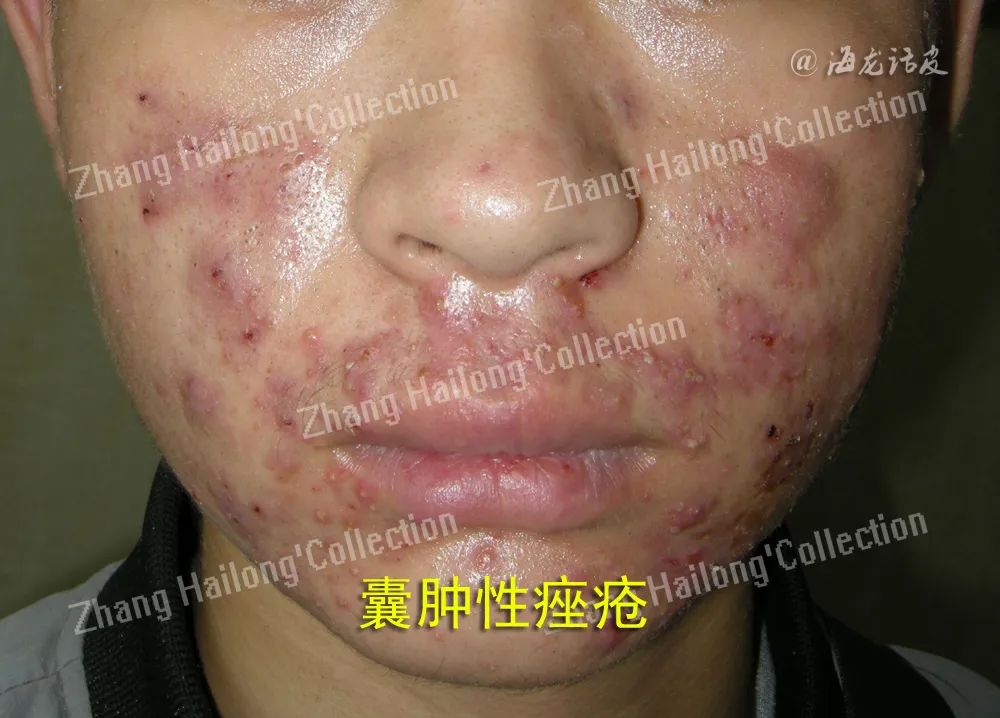
Mohamed等评估了瘦素基因多态性对于口服异维A酸治疗痤疮的影响,结果显示不同基因型之间治疗反应差异显著,瘦素rs7799039CC基因型的患者显示出更好的疗效和更轻的不良反应,提示瘦素基因型可作为口服异维A酸治疗的筛选标准。对于异维A酸口服治疗痤疮后瘦素水平的变化,目前结果仍存在矛盾。
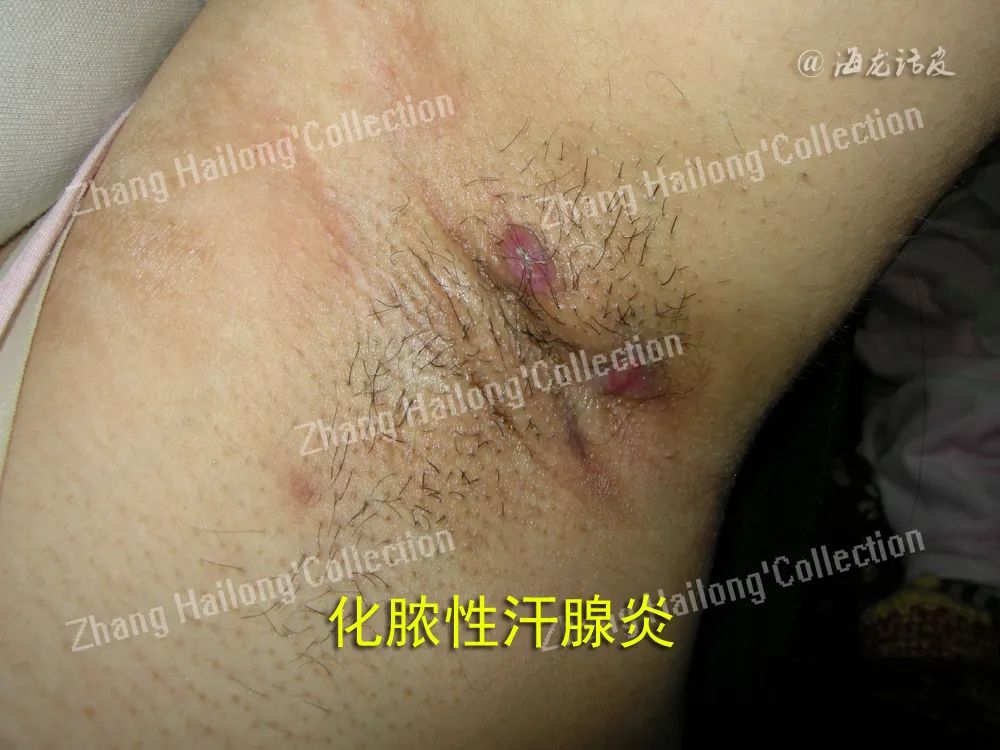
7.瘦素与化脓性汗腺炎
研究发现,肥胖是化脓性汗腺炎的危险因素。Malara等观察到,在化脓性汗腺炎患者中,瘦素水平显著上升。皮下脂肪组织中瘦素局部浓度的增加加剧了化脓性汗腺炎患者皮肤炎症,此外还加剧全身炎症。这两种现象都可能加重化脓性汗腺炎的症状。
8.其他
研究发现特应性皮炎的患儿血清瘦素水平不受局部应用糖皮质激素治疗的影响,其余治疗相关的研究多集中在乳腺癌等疾病中,对于皮肤病治疗方面的影响尚需更多探索。
小结
综上所述,瘦素作为一种多能性脂肪因子与人体多种免疫反应相关。瘦素在不同皮肤病发病机制中发挥不同作用,确切作用仍需要进一步研究。此外,药物干预调整瘦素水平或打破瘦素受体抵抗,有望成为皮肤病治疗的新靶点。对于多种皮肤疾病,应当预防和控制肥胖。
参考文献:
[1]吴逸凡,孔庆涛,桑红.瘦素与皮肤病研究进展[J].临床皮肤科杂志,2023,52(4):252-256.
[2]温旭红,张高峰,潘伦等. 瘦素对雄激素性脱发小鼠模型毛囊的影响[J]. 中国麻风皮肤病杂志, 2020, 36(8):461-466.
[3]Münzberg H, Morrison CD.Structure, production and signaling of leptin[J]. Metabolism, 2015, 64(1):13-23.
[4]Gulcelik NE, Halil M, Ariogul S, et al. Adipocytokines and ag-ing:adiponectin and leptin[J]. Minerva Endocrinol, 2013, 38(2):203-210.
[5]更多参考文献略。


