又一款PI3K抑制剂报上市 泛癌种PI3K抑制剂值得期待么?
时间:2023-01-12 15:02:21 热度:37.1℃ 作者:网络
近日,CDE官网显示,Incyte/信达生物帕萨利司片(Parsaclisib)申报上市,此前已被纳入优先审评,拟用于既往接受过至少两种系统性治疗的复发或难治性滤泡性淋巴瘤(FL)成人患者。
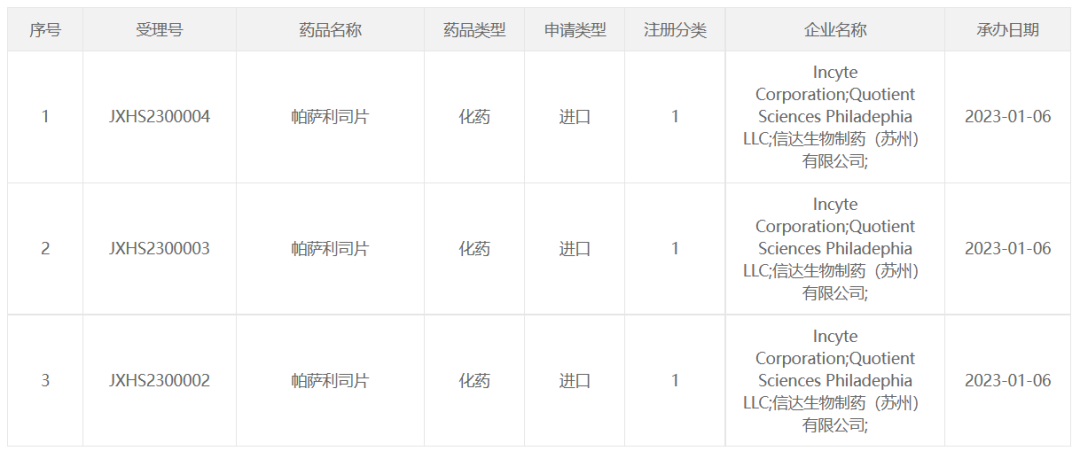
2022年6月Parsaclisib的中国关键II期研究结果显示:截至2021年12月,在61例复发或难治性FL患者中,客观缓解率(ORR)达86.9%(95%CI : 75.8%-94.2%),其中31.1%的患者实现完全缓解。中位无进展生存期(mPFS)和中位总生存期(mOS)尚未达到。今天我们来了解一下PI3K这个靶点~
泛癌种靶标——PI3K
磷脂酰肌醇3-激酶( phosphoinositide 3-kinase,PI3Ks) 途径是人类癌症中最常被激活的信号通路之一,PI3K/AKT/mTOR通路激活可见于各大肿瘤。几乎介导50%的恶性肿瘤的发生。目前的靶向药主要有三大类,即靶向PI3K/mTOR、广谱型的PI3K抑制剂和选择性的PI3K抑制剂。
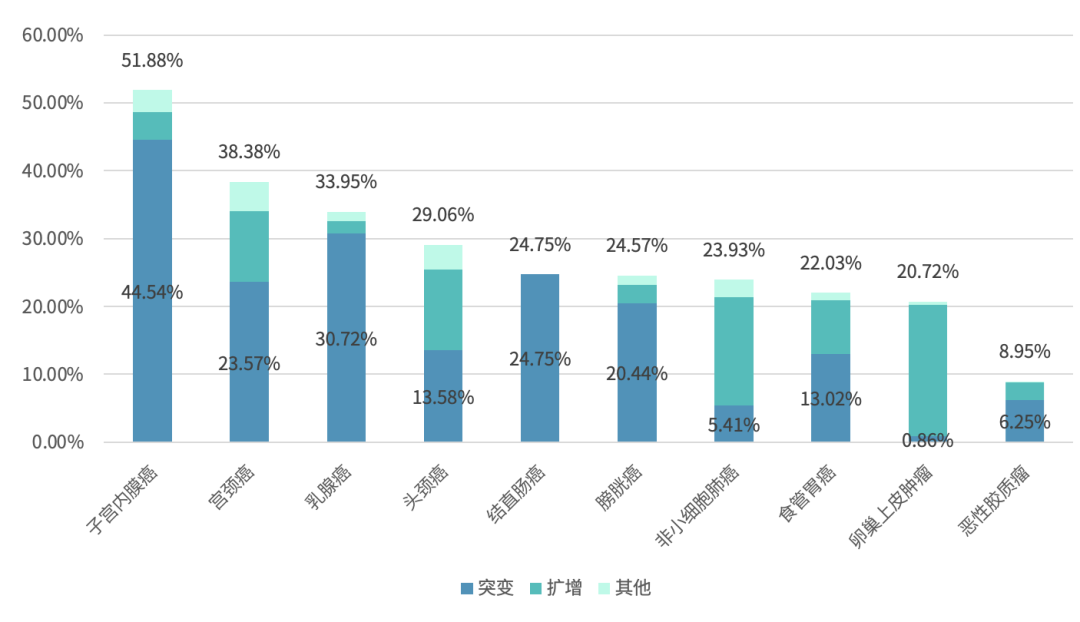
PIK3CA 基因在各肿瘤类型中的突变频率
随着PI3K抑制剂的上市,关于该类药物的不良反应也引起广泛关注,2022年4 月 21 日,FDA 召开了一场针对 PI3K 抑制剂的肿瘤咨询委员会(ODAC)会议,讨论 PI3K 抑制剂的毒性问题,以及是否随机对照试验数据能够有效地评估总生存期(OS),进而作为支持该类药物在血液恶性肿瘤领域的风险获益评估的实质性证据。这是FDA对 PI3K 抑制剂的重大考验。最终,ODAC以 16 票对 0 票通过随机数据支持未来对 PI3K抑制剂的批准,因为观察到该药物的毒性,一名选民投了弃权票。
FDA批准上市的PI3K抑制剂
1.艾德拉尼(Idelalisib)
PI3K作为一个新星靶点,直到2014年吉利德的PI3Kδ抑制剂idelalisib上市,行业才迎来首个获批的PI3K抑制剂。
艾德拉尼(Idelalisib)是第一代口服PI3Kδ抑制剂,用于治疗复发/难治性慢性淋巴细胞白血病(CLL)。在一项2014年进行的多中心III期试验,研究了idelalisib与安慰剂分别联合美罗华治疗复发慢性淋巴细胞白血病(R-CLL)效果。数据显示,idelalisib的ORR为81%(安慰剂组为13%),PFS未达到中位时间(安慰剂组为5.5月),没有显著增加不良反应的发生率。这一出色表现,令其在同年先后被批准用于R-CLL、至少二线以上的R/R FL以及SLL。
2.库潘尼西(Copanlisib)
2017年9月14日,拜耳的Copanlisib正式获得美国FDA批准治疗复发性滤泡性淋巴瘤,且已经接受了至少两次系统疗法的成人患者。
这款药的疗效在一项单臂的临床试验中得到了验证。这项临床试验招募了104名患者,他们都已经接受了至少两次治疗,但病情依然出现了复发。在试验中,接受Copanlisib治疗的患者其客观缓解率达到了59%,为患者的生活带来了显著改善。基于这项临床试验的出色数据,美国FDA曾授予这款新药优先审评资格。
3.度维利塞(Duvelisib)
一年后,Secura Bio的PI3Kδ/PI3Kγ双重抑制剂duvelisib获批上市,用于治疗至少两次既往治疗后复发或难治性慢性淋巴细胞白血病(CLL)或小淋巴细胞淋巴瘤(SLL)和至少两次既往治疗后复发或难治性滤泡性淋巴瘤(FL)。
在一项3期临床试验中,纳入复发性或难治性慢性淋巴性白血病(CLL)或小淋巴细胞淋巴瘤(SLL)的患者,将患者分为两组,分别使用duvelisib进行单药治疗、使用奥法木单抗治疗。结果显示:接受duvelisib治疗的患者的无进展生存期(PFS)为13.3个月,奥法木单抗组的无进展生存期(PFS)为9.9个月,患者疾病出现进展或死亡的风险降低了48%。通过该项试验数据可知,duvelisib可显著延长患者的生存期,降低疾病出现进展或死亡的风险,它能减轻患者的痛苦,改善患者的生活质量,对患者的病情有积极作用。
2022年3月18日,中国国家药监局(NMPA)官网最新公示,度维利塞胶囊(曾用名:度恩西布胶囊)已获批上市,适用于治疗既往至少经过两次系统治疗的复发或难治性滤泡性淋巴瘤(FL)。这是国内首款获批的 PI3K 抑制剂,此次石药集团引进的度维利塞在中国获批,有望为滤泡性淋巴瘤患者带来新的治疗选择。

4.阿培利司(Alpelisib)
诺华的PI3Kα抑制剂alpelisib在2019年正式获得FDA批准,联合氟维司群用于男性/绝经后女性 HR+/HER2-且携带PI3K突变的晚期乳腺癌。alpelisib是首个口服的PI3K选择性抑制p110α亚单位的抑制剂,对携带PI3K基因突变的患者来说,alpelisib联合氟维司群能够显著延长其PFS。
该获批是基于一项Ⅲ期试验SOLAR-1的研究结果。研究共纳入572例既往接受过内分泌治疗的HR阳性、HER2阴性晚期乳腺癌患者,其中341例患者存在PIK3CA突变,169例PIK3CA阳性的患者接受alpelisib(剂量为每日300 mg)+氟维司群(在第1周期的第1日和第15日以及随后各28日周期的第1日给药,剂量500 mg),172例PIK3CA+患者使用安慰剂+氟维司群。
在PIK3CA突变癌症患者队列中,Alpelisib+氟维司群组和安慰剂+氟维司群组的中位无进展生存期分别为,11.0月vs5.7月(进展或死亡的风险比,0.65;P<0.001)。12个月PFS率为46.3%vs32.9%。

Alpelisib+氟维司群组的有效率也是高于安慰剂+氟维司群组:26.6%vs12.8%。,对于有可测量病变患者,有效率分别为35.7%vs16.2%。针对未携带PIK3CA突变的乳腺癌患者Alpelisib未显示出治疗效果。
中位随访30.8个月(0.4-53.4个月),最终OS数据显示,alpelisib联合氟维司群和氟维司群单药组的中位OS分别为39.3月 vs 31.4个月, Alpelisib+氟维司群治疗较单药氟维司群组的mOS延长了7.9个月,但并未达到统计学差异(HR:0.86,0.64-1.15;P=0.15)。
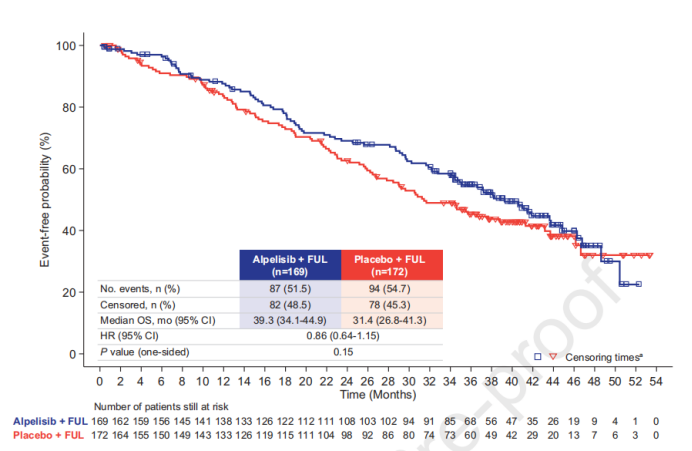
血浆ctDNA检测到PIK3CA突变的患者中,alpelisib加氟维司群组的中位OS为34.4个月(95%CI,28.7-44.9),而安慰剂联合氟维司群为25.2个月(95%CI,20.7-29.6) ,HR = 0.74; 95%CI,0.51-1.08),死亡风险降低26%。
Alpelisib目前在大陆尚未获批,香港有售。有需要的患者或家属可以联系找药宝典小助手进行对接。
5.厄布利塞(umbralisib)
2021年2月6日,美国FDA加速批准了厄布利塞(umbralisib,商品名:Ukoniq)上市,用于治疗既往接受过至少一种基于抗CD20疗法的复发/难治性边缘区淋巴瘤(MZL)患者,以及既往接受过至少三线全身治疗的复发/难治性滤泡性淋巴瘤(FL)成人患者。厄布利塞(umbralisib)由TGTherapeutics(中文名:TG治疗公司)研发,是全球上市的第一款PI3Kδ和CK1ε抑制剂。
该加速批准是基于开放标签、多中心、多队列的UTX-TGR-205研究(NCT02793583),UTX-TGR-205研究纳入69例MZL患者(既往接受至少1种含抗CD20的治疗方案)和117例FL患者(既往接受至少2种全身治疗)。在临床试验中,使用Ukoniq治疗的边缘区淋巴瘤(MZL)患者的客观缓解率(ORR)达到49%,包括16%的完全缓解率。在滤泡性淋巴瘤(FL)患者中,客观缓解率(ORR)达到43%,中位DOR为11.1个月。
但该药物因安全隐患于 2022 年 6 月被 FDA 正式撤市。
国内PI3K赛道
目前国内已有2款PI3K抑制剂获批上市,包括石药集团从Verastem引进的PI3K-δ和PI3K-γ双重抑制剂——度维利塞胶囊(2022年3月获批用于FL)、璎黎/恒瑞的国产首个PI3Kδ抑制剂——林普利塞片(2022年11月附条件获批用于FL)。Incyte/信达生物帕萨利司片(Parsaclisib)已经申报上市。
迈入临床 III 期的相关药物多为海外药物,阿诺生物针对实体瘤的pan-PI3K抑制剂(AN2025)正在国内外进行III期临床试验。国内厂商的相关药物临床试验目前多处于临床I 期 、II 期。上述部分药物除了直接性的抑制 PI3K 的活性以外,正大天晴的 TQ-B3525、诺华的 BYL719(Alpelisib)同样可以用于 PTEN 缺失或表达的乳腺癌治疗。
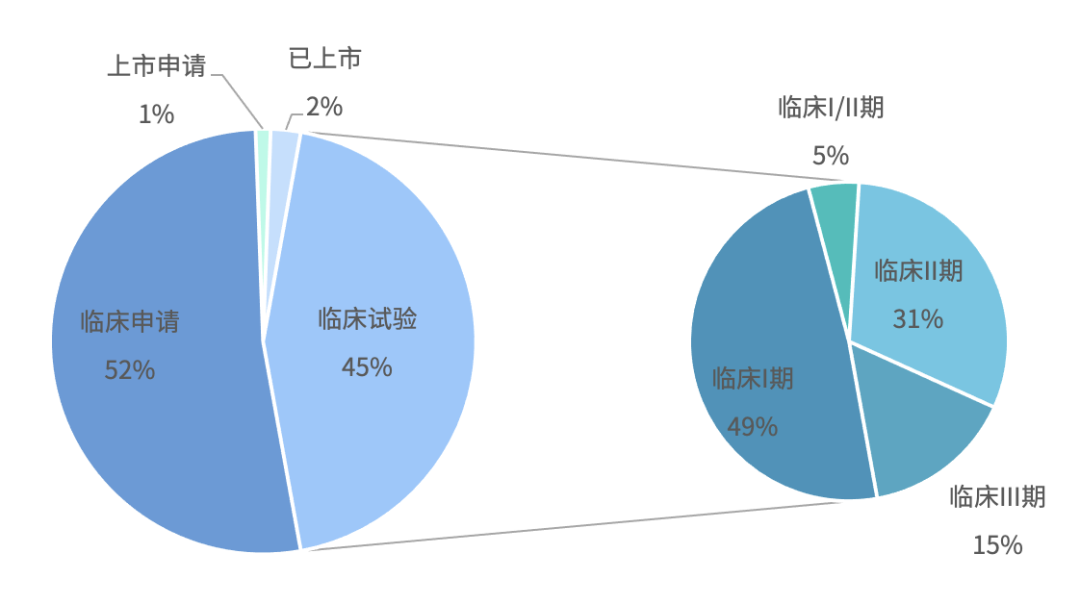
国内 PI3K 抑制剂临床试验情况
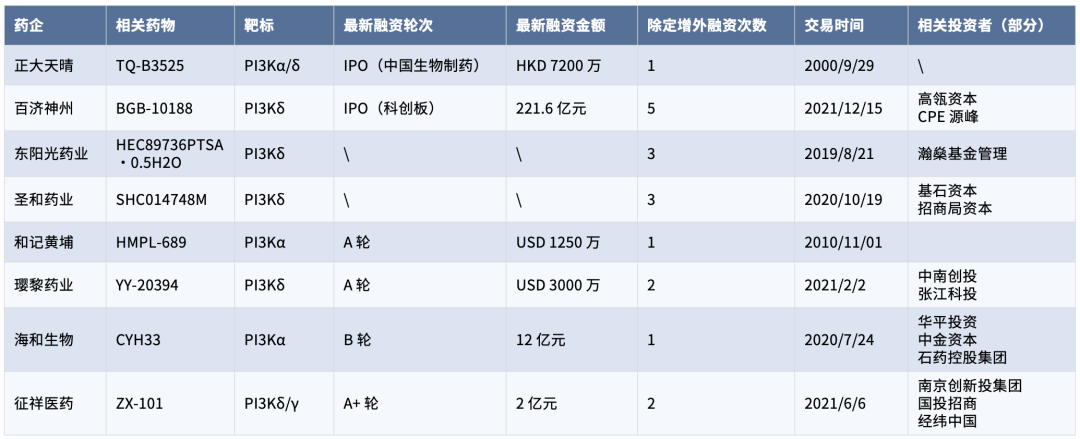
部分国内靶标 PI3K 相关厂商融资情况来源:来觅数据
: , 。 视频 小程序 赞 ,轻点两下取消赞 在看 ,轻点两下取消在看


