Science:癌基因ATAD2是打开肿瘤治疗的开关?
时间:2021-09-19 20:30:18 热度:37.1℃ 作者:网络
在癌症生物学发展的这几十年里,人们已经对癌症的起源达成了共识,即在正常细胞在分裂过程中,基因突变不断积累,导致致癌基因激活、抑癌基因失活,最终形成了癌细胞和肿瘤的发生。
但事实上,在每一个正常人的体内,都有可能存在成千上万的 DNA 突变细胞,然而只有在极少数情况下,这些发生了 DNA 突变的细胞才会癌变,导致癌症的发生。
为什么?
MSK 癌症生物和遗传学大佬 Richard M. White 教授带领的研究团队,在黑色素瘤斑马鱼模型中找到了控制黑色素瘤形成的“必需基因”——ATAD2 基因。
事实上,三磷酸腺苷酶家族蛋白2(ATPase family,AAA domain containing 2,ATAD2)是近年来发现的一种癌相关分子,在前列腺癌和乳腺癌等多种恶性肿瘤的发生和发展过程中发挥着重要作用.它是众多转录因子的共激活分子,并能参与表观遗传修饰,促进一系列下游癌基因的表达,进而改变肿瘤细胞的表型.研究还发现,ATAD2表达与肿瘤的组织学分级以及肿瘤转移,疾病复发和患者生存期等相关,提示其可作为肿瘤预后评价分子,具有重要的临床应用价值.另外,ATAD2不仅包括溴结构域(bromodomain,BRD),而且还是与细胞活性相关的ATP酶(ATPases associated with various cellular activities,AAA+ATPase),提示它可能是很有潜力的药物治疗靶点。
近年来发现,ATAD2 即所谓的染色质修饰因子,可以与基因附近的染色体区域结合,并通过表观遗传学修饰,激活胚胎发育相关基因。近年来,众多研究表明,ATAD2 是一种典型的癌症相关分子,在前列腺癌、乳腺癌、黑色素瘤等多种癌症的发生和发展中发挥着重要作用。
Richard M. White 教授在斑马鱼黑色素瘤易感模型中证实,敲除 ATAD2 基因,即使存在诸多致癌突变和抑癌突变,细胞依旧无法癌变形成肿瘤,而添加 ATAD2 基因,细胞则重新获得了癌变的能力。因此研究人员认为,基因突变虽然是癌症形成的关键驱动因素,但并非所有具有突变的细胞都会癌变。细胞环境,尤其是细胞中的某些特定基因,与基因突变协同作用才能使正常细胞癌变,这种环境或基因称为“致癌能力”。靶向细胞中控制细胞“致癌能力”相关基因,或为癌症治愈提供了潜在可能。
本研究的主要作者、MSK的Scott J. Callahan 博士更是激动的表示,“细胞癌变好比烧火, DNA 突变只是一根点燃的火柴,如果没有木材或木头是湿的,那么只能得到一瞬间的闪烁而无法燃烧起来。但如果有干燥的木头和火种,那么整个就会燃烧起来。而在这个例子中,ATAD2 就是柴火。因此,未来除了靶向 DNA 突变,靶向 ATAD2 或许可以更有效地治疗癌症。”

相关研究以“Developmental chromatin programs determine oncogenic competence in melanoma”为题发表在最新一期的 Science 杂志上。
黑色素细胞痣为什么可以不癌变?
近年来,通过基因组杂交和测序等先进的技术,科学家们发现了一系列关键的细胞信号传导通路和相关基因。其中,BRAF 基因突变与黑色素瘤的形成密切相关。目前,约 50%-70% 的黑色素瘤患者中均存在 BRAF 基因突变。
2003 年,就在 BRAF 致癌突变发现后不久,Pollock 教授等人便在黑色素细胞痣中发现了同样的突变,并且突变率高达 82%。也就是说,黑色素细胞痣虽然存在 BRAF 致癌突变,却可以数十年保持不癌变状态。
2010 年左右,White 教授在读博士后期间发现,斑马鱼黑色素瘤模型中,许多癌细胞的基因特征更偏向于胚胎细胞而不是成熟的黑色素细胞。
随后在对斑马鱼黑色素瘤模型基因改造的过程中,White 教授进一步发现,在黑色素细胞发育的不同阶段引入 BRAF 基因会导致不同的结果。具体来说,神经嵴阶段的黑色素细胞以及成黑色素细胞在引入 BRAF 基因突变后均会癌变产生黑色素瘤,而成熟的黑色素细胞在引入 BRAF 基因突变后却并不会癌变,反而形成了黑色素细胞痣。
为了进一步证实这一现象在人类中也存在,White 教授和 Studer 博士合作。Studer 博士是人类多能干细胞(hSPC)领域的大佬,他的研究包括利用人类血液细胞制造 hSPC,并通过 hSPC 为身体的任何不同组织,例如大脑、肝脏、肺部等创建人体肿瘤模型。
于是,White 教授和 Studer 博士利用 hSPC 制造了神经嵴阶段、成黑色素细胞阶段以及成熟阶段的黑色素细胞,并将 BRAF 基因分别导入到上述细胞中,然后将这些细胞植入小鼠体内。结果仍旧只有神经嵴阶段以及成黑色素细胞阶段的细胞能够形成肿瘤。
这些结果表明,仅基因突变并不足以让正常细胞癌变。
谁赋予了细胞癌变的能力?
事实上,White 教授并不是第一个对这一现象感兴趣的人。
2016 年的时候,波士顿儿童医院 Leonard Zon 教授就发现,机体内的某些细胞已经发生了致癌突变,但却没有癌变。并随后在斑马鱼黑色素瘤模型中证明,即使所有的斑马鱼都携带 BRAF 突变并丧失抑癌基因 p53,仍旧只有当 Crestin 基因激活的时候,才会形成肿瘤。相关研究也曾发表在 Science 杂志上。
同时 Zon 教授提出了一个新的癌症形成模型,在癌基因激活及抗癌基因沉默或丢失时正常组织已做好了准备癌变,但只有组织中的一个细胞回复到更原始的胚胎状态并开始分裂时才会形成癌症。他们相信这一模型不仅适用于黑色素瘤,还适用于大多数(并非全部)的癌症。
为了证明 ATAD2 在黑色素瘤形成过程中发挥了决定性作用,研究人员在黑色素瘤斑马鱼模型中去除,然后重新加入了 ATAD2 基因。结果发现,当 ATAD2 基因被去除后,细胞失去了癌变的能力,而重新将 ATAD2 添加到细胞中,则细胞可以重新获得这种能力。这意味着,ATAD2 基因是黑色素瘤能否顺利形成的关键。
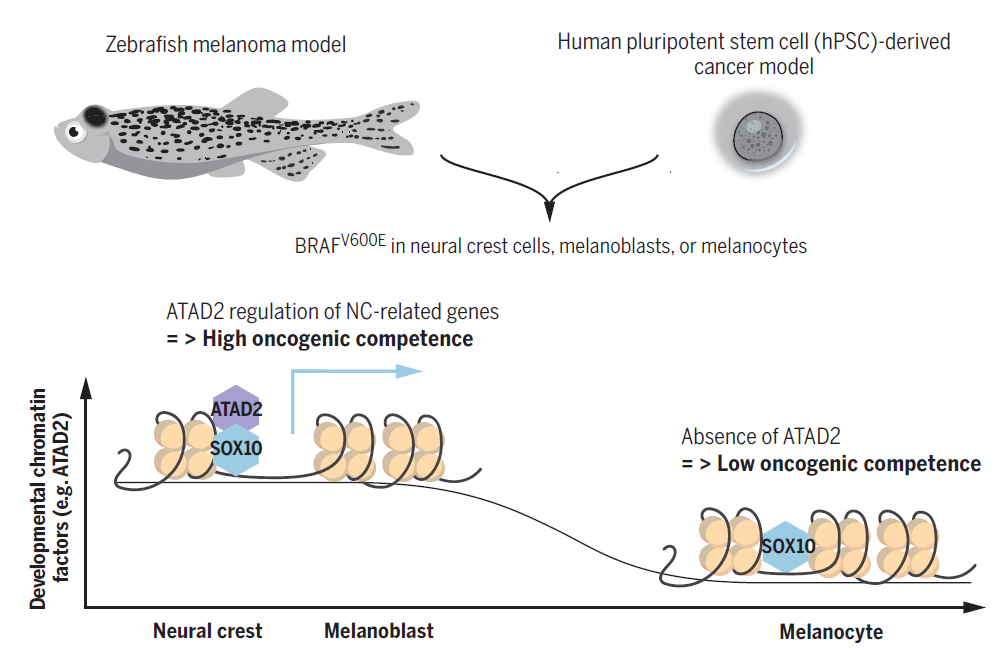 图 | ATAD2在细胞癌变过程中的作用(来源:Science)
图 | ATAD2在细胞癌变过程中的作用(来源:Science)
最后,利用 MSK 和癌症基因组图谱提供的大量数据,研究人员发现 ATAD2 基因激活的癌症患者生存率显著降低,这意味着它的确在癌症基因组方面发挥着重要的作用。
总的来说,White 教授和 Studer 博士及其团队的最新研究表明,黑色素瘤的形成取决于 ATAD2 基因掌握的“致癌能力”,没有它,即使拥有众多的致癌突变,黑色素细胞仍旧无法癌变。
研究人员表示,他们的研究结果为癌症形成提供了一个重要的新视角,与传统观点形成鲜明对比。
“几十年来一直存在的标准想法是,基本上需要两种类型的 DNA 突变才能患上癌症:激活的致癌基因和缺失的抑癌基因,一旦清除了这两个障碍,癌症就会形成。现在我们有了完全不同的东西——致癌能力——它为癌症发生增加了第三层内容。”
事实上,针对ATAD2基因特异性抑制剂也正在开发中。
ATAD2基因特异性抑制剂
原始出处:
ARIANNA BAGGIOLINI, SCOTT J. CALLAHAN, et al.Developmental chromatin programs determine oncogenic competence in melanoma. Science, DOI: 10.1126/science.abc1048
Zhang G, Li S, Cheng KW, Chou TF. AAA ATPases as therapeutic targets: Structure, functions, and small-molecule inhibitors.Eur J Med Chem. 2021 Jul 5;219:113446. doi: 10.1016/j.ejmech.2021.113446
Patton EE, Mueller KL, Adams DJ, Anandasabapathy N, Aplin AE, Bertolotto C, Bosenberg M, Ceol CJ, Burd CE, Chi P, Herlyn M, Holmen SL, Karreth FA, Kaufman CK, Khan S, Kobold S, Leucci E, Levy C, Lombard DB, Lund AW, Marie KL, Marine JC, Marais R, McMahon M, Robles-Espinoza CD, Ronai ZA, Samuels Y, Soengas MS, Villanueva J, Weeraratna AT, White RM, Yeh I, Zhu J, Zon LI, Hurlbert MS, Merlino G. Melanoma models for the next generation of therapies.Cancer Cell. 2021 May 10;39(5):610-631


