FRONT ONCOL:中国团队成功构建四阴乳腺癌远处转移预后模型!
时间:2021-10-07 18:04:17 热度:37.1℃ 作者:网络
乳腺癌是女性最常见的癌症,也是2021年美国癌症相关死亡的第二大原因。三阴性乳腺癌(TNBC)的特点是雌激素受体(ER)、黄体酮受体(PR)和人类表皮生长因子受体2(HER2)表达缺失,占所有乳腺癌的10%-20%。由于筛查计划启动和早期发现,淋巴结阴性TNBC的发病率显著增加。迄今为止,淋巴结阴性TNBC被认为复发中等风险,辅助化疗的比例很高,但部分淋巴结阴性TNBC患者的转移和死亡风险仍然很高,需要更定量的方法来告知淋巴结阴性TNBC中远距离转移和个性化治疗的风险。

本研究旨在,基于详细的临床病理学信息、有据可查的随访和完整的RNA测序数据,构建一个基于基因表达的预后特征,结合临床病理因素,为中国淋巴结阴性TNBC患者提供短期和长期疾病结果的定量预测。

表1总结了202名患者及其原发性肿瘤的临床和病理特征。在202名淋巴结阴性TNBC患者中,中位随访为68.2个月,观察到12例(5.9%)远距离转移病例。在12名患者中,4名(33.3%)患者多位转移,7名(58.3%)患者在随访期间死于乳腺癌。本研究组的手术患者肿瘤大小和年龄中位数分别为2.5厘米和53岁。
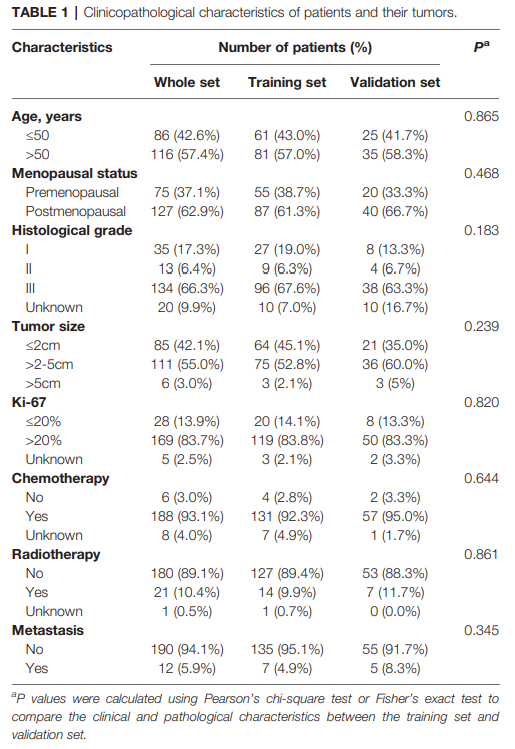
研究设计的概述如图1所示。我们在有或没有远处转移的两组之间鉴定了71个差异表达的mrna,还利用rna测序数据对两组有或没有远处转移的差异表达基因进行了基因集富集分析。在远距离转移的患者中,25个基因集在P值<0.05下显著丰富。在远处转移患者中,有56个mrna表达上调,15个mrna表达下调(图2)。我们构建了一个矩阵,集成了所有 202 名患者的 71 个不同表达的 mRNA 和临床病理学数据的 RNA 测序数据。我们构建了一个整合了71个差异表达mrna的rna测序数据和所有202名患者的临床病理数据的矩阵。然后将患者随机分为训练集(n = 142)和验证集(n = 60)。训练集和内部验证集之间的所有特征没有差异(表1)。采用LASSO Cox回归模型在训练集中选取B3GALT5-AS1、DNER、CSN1S1、KIF5A、SIX3、NOTUM、CPS1 7个基因。所选基因的log2(fold change)、多变量Cox回归系数、风险比、95%置信区间和P值的总结如表2所示。时间依赖性roc曲线和Kaplan-Meier曲线用于评估DMFS的7个基因特征的预后潜力(图3A, B)。3年期、4年期和5年期DMFS的AUC值分别为0.823、0.879和0.870,在验证集分别为0.727、0.705和0.689(图3A)。
基因组风险评分公式为:基因组风险评分= 0.18801037 × DNER + 0.28358112 ×CSN1S1+ 0.36011127 ×KIF5A+ 0.57677377 ×SIX3+ 0.70105693 ×NOTUM + 0.74508978 × CPS1 - 0.06761698 × B3GALT5-AS1。
通过选择训练集中的最佳临界值(1.78),将患者分为高(n = 15)和低(n =127)组(图3B, C)。使用相同的临界值(1.78),患者也被分为验证集中的高危组(n = 8)和低风险组(n = 52)(图3B, C)。DMFS作为7个基因标记的功能的Kaplan-Meier分析显示,在高风险组和低风险组之间存在高度显著的差异(图3B,训练集P<0.001在;验证集 P = 0.039)。



我们还创建了临床预后模型:临床风险评分公式如下: 临床风险评分公式为:临床风险评分= 0.21532 ×肿瘤大小(cm) - 0.04466 ×年龄(年)。3年期、4年期和5年期DMFS临床模型的AUC值分别为0.755、0.699和0.693,验证集分别为0.574、0.651和0.631(图4A)。在校正了患者年龄和肿瘤大小后,基因组风险评分仍是多因素Cox分析的独立预后因素(训练集风险比=2.64,95% CI: 1.76-3.96, P <0.001;验证集风险比=1.63,95% CI: 1.07-2.49, P =0.02)。
综合风险评分由基因组和临床风险评分得出:综合风险评分 = 0.9702 ×基因组风险评分+1.0854 ×临床风险评分。将临床模型与基因组风险评分进行整合后,训练集中3、4、5年期DMFS的AUC值分别为0.836、0.888、0.882(图4B)。在验证集中,组合模型的AUC值仍然很高,3、4和5年DMFS的值分别为0.801、0.793和0.768(图4B)。在训练集或验证集中,患者被分为高危组(n = 15或9)和低危组(n = 127或51)(图4C)。Kaplan-Meier对DMFS作为组合模型的函数进行的分析显示,训练集中的高风险组和低风险组之间存在显著差异(图4C, P <0.001)。同样,在验证集中也可以观察到这种趋势(图4C, P = 0.071)。

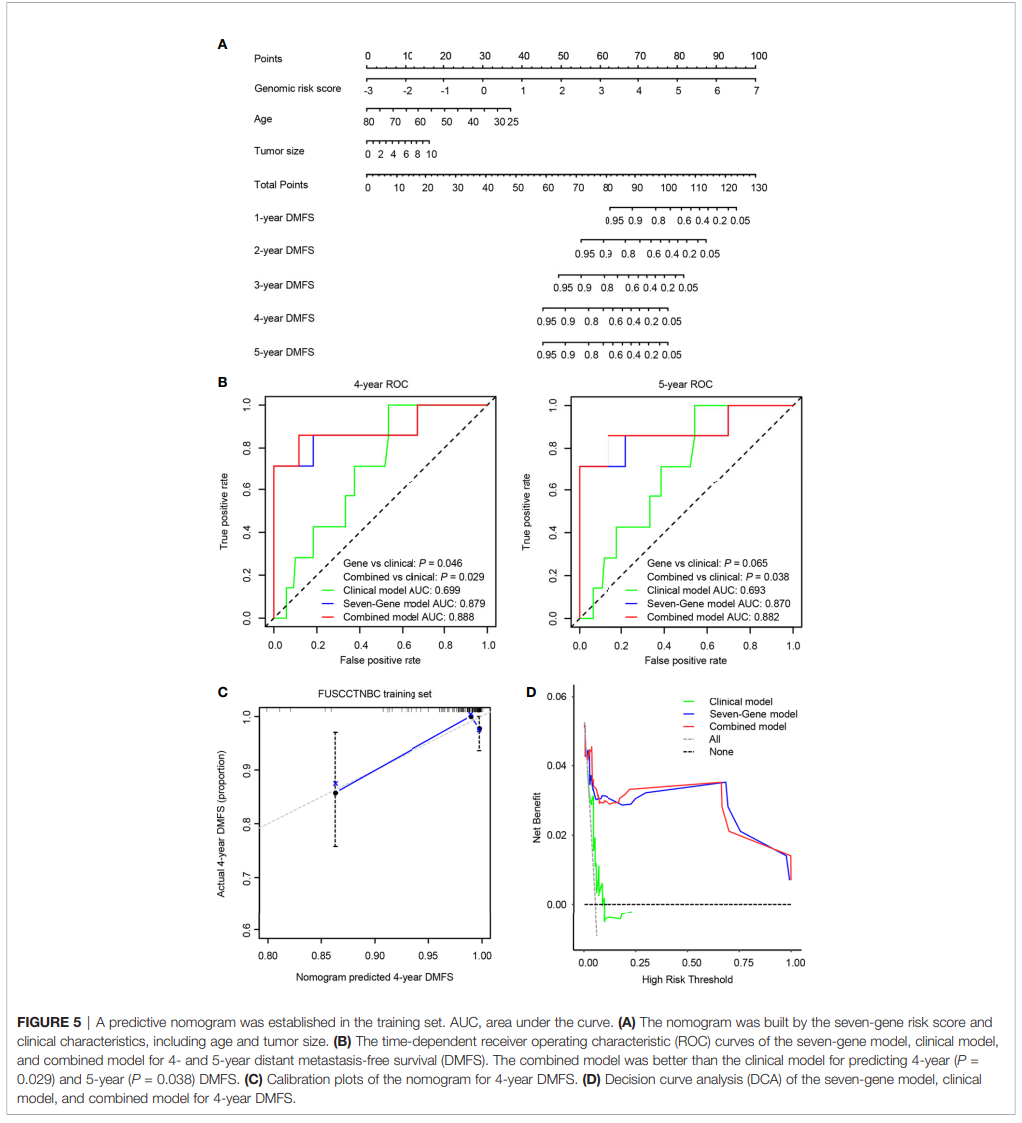
我们将7个基因标记与年龄和肿瘤大小整合在一起,在训练集中构建预后图(图5A)。组合模型的 C 指数值在训练集为0.874,在验证集为0.805。7个基因、临床模型和组合模型的4年和5年时间依赖性ROC曲线如图5B所示。在预测4年DMFS方面,7基因模型和联合模型均优于临床模型(基因模型P = 0.046;组合模型P =0.029)。联合模型预测5年DMFS的预后效果明显优于临床模型(P = 0.038),基因模型也趋向差异(P = 0.065)。图5C显示4年期DMFS预测的校准分析。蓝实线与灰虚线的拟合更接近,表明预测精度很高。决策曲线分析 (DCA) 显示,与临床模型相比,七基因模型和联合模型在预测4年DMFS方面优于临床模型(图5D)。
综上,本研究确定并验证了一种新的7基因特征模型,并结合患者年龄和肿瘤大小构建了预测阴性TNBC患者淋巴结DMFS的模型。较高的风险评分可能表明远处转移的可能性增加,反之亦然。考虑到潜在的益处和增加的远处转移的风险后,对于淋巴结阴性、具有高危评分的TNBC患者,可以考虑将治疗升级作为一种替代策略,而低风险评分的患者可以考虑降级化疗。
原文来源:
Peng et al.A Novel Seven Gene Signature-Based Prognostic Model to Predict Distant Metastasis of Lymph Node-Negative Triple-Negative Breast Cancer
Front. Oncol., 16 September 2021 | https://doi.org/10.3389/fonc.2021.746763

