基因编辑的未来遭质疑,因严重安全问题,FDA暂停基于基因编辑的CAR-T临床试验!
时间:2021-10-17 06:03:08 热度:37.1℃ 作者:网络
自2012年诞生以来,由细菌/古菌的防御系统改造而来的CRISPR基因编辑技术就吸引了全世界科学家的目光,在CRISPR技术的帮助下,人们得以快速精准地操纵基因、改变生命。摆脱遗传病、攻克癌症...这些曾经遥不可及的梦想从此变得触手可及。
2020年10月,CRISPR基因编辑迎来高光时刻,这一技术诞生仅8年就获得了诺贝尔奖的肯定。此后,CRISPR基因编辑在临床治疗上取得一系列里程碑进展,尤其是2021年6月《新英格兰医学期刊》NEJM 发表了世界首个体内CRISPR基因编辑疗法的临床试验结果【1】。诺奖得主詹妮弗·杜德娜(Jennifer Doudna)创立的 Intellia Therapeutics 开发的治疗转甲状腺素蛋白淀粉样变性(ATTR)的CRISPR基因编辑疗法,在6名患者的临床试验中安全有效。这也让全世界看到了CRISPR基因编辑技术在治疗遗传病的强大威力和前景。
随着CRISPR技术在遗传病领域一路过关斩将,越来越多的科学家和医药公司开始探索CRISPR在癌症治疗领域的应用。
早在2016年6月,四川大学华西医院的卢铀教授开始进行CRISPR基因编辑T细胞治疗癌症的1期临床试验,于2016年10月28日完成了世界首例基因编辑细胞人体注射。该研究也于2020年4月28日发表于国际顶尖医学期刊 Nature Medicine 【2】。这项1期临床试验证实了CRISPR基因编辑非小细胞肺癌患者的T细胞的PD-1基因进行癌症治疗的安全性和可行性。
我们都知道,CAR-T细胞疗法是癌症治疗利器,在多种血液类癌症中展现了让人印象深刻的强大效果。然而,这种提取患者自身T细胞并进行改造的细胞疗法由于复杂的流程和高度定制化,导致价格及其高昂,数十万美元的天价极大地限制了CAR-T疗法的应用。
为了解决CAR-T疗法的这些问题,许多科学家和医药公司开始开发基于CRISPR基因编辑的现货型CAR-T疗法(off-the-shelf CAR-T),通过CRISPR基因编辑技术改造T细胞,有望实现让细胞治疗从一个自体移植的复杂疗法变成一个异体移植的药物。
在这方面,Allogene Therapeutics 和诺奖得主 Jennifer Doudna 创立的 Caribou Biosciences 发展最为迅速,这两家公司已经上市,且均已开展相关临床试验。
然而,最近一名淋巴瘤患者在接受 Allogene 公司的经过基因编辑的抗CD19 CAR-T候选药物ALLO-501A治疗后,他的所有血细胞系都减少了,活检分析发现他的体内出现了具有染色体异常的抗CD19 CAR-T细胞。
由于染色体异常可能导致癌症发生,考虑到这种严重的潜在风险,FDA暂停了Allogene 公司的所有CAR-T临床试验。受此消息影响,Allogene 公司股价暴跌46%。
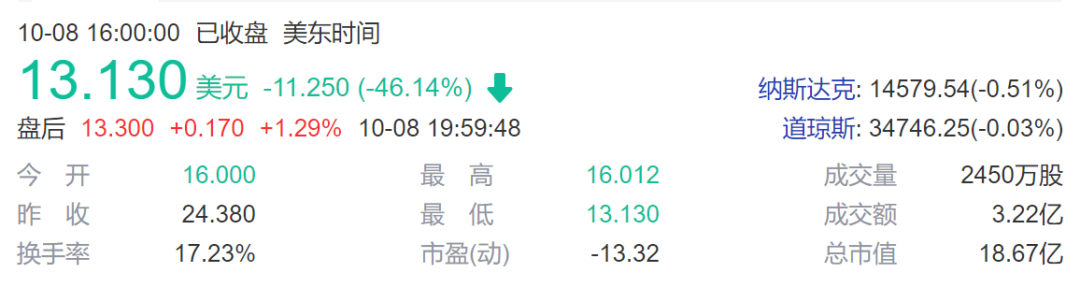
Allogene 公司股价下跌46%
波及整个领域
到目前为止,这些细胞为何会出现染色体异常仍然不得而知,可能在基因编辑过程中或在细胞快速扩增时出现了染色体异常。Allogene 公司的这项临床试验是使用是TALEN编辑技术对T细胞进行基因编辑,不管是TALEN还是CRISPR,涉及对染色体上DNA进行修改的技术都会面临这些问题,这也给现货型CAR-T疗法整个领域带来了挫折。
不仅是 Allogene 公司股价暴跌,同样做现货型CAR-T疗法的 Cellectis 公司和 Caribou Biosciences 公司股价也随之大跌。这也潜在风险也让人们对基因编辑的未来产生了担忧,几家上市的CRISPR基因编辑公司股价也开始下跌。
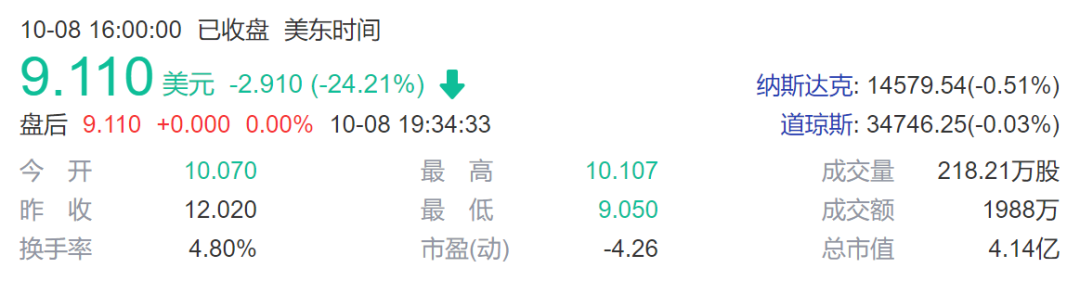
Cellectis 公司股价下跌24%
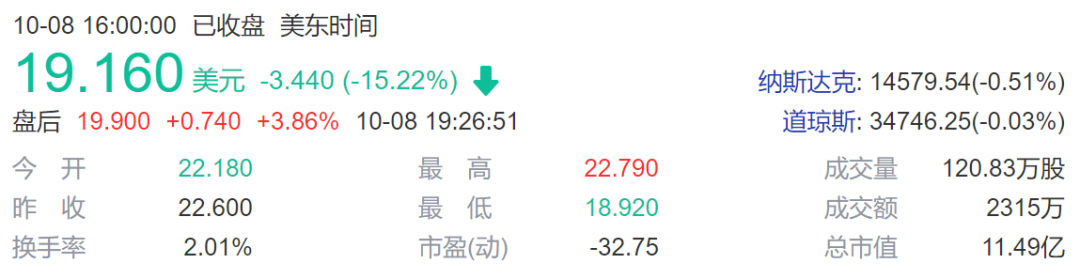
Caribou Biosciences 公司股价下跌15%
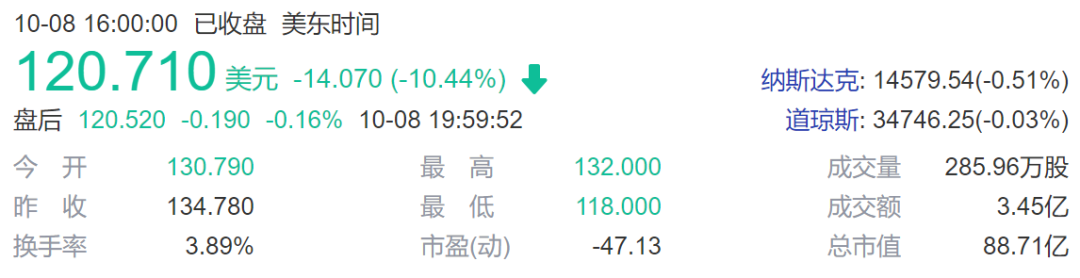
Intellia Therapeutics公司股价下跌10%
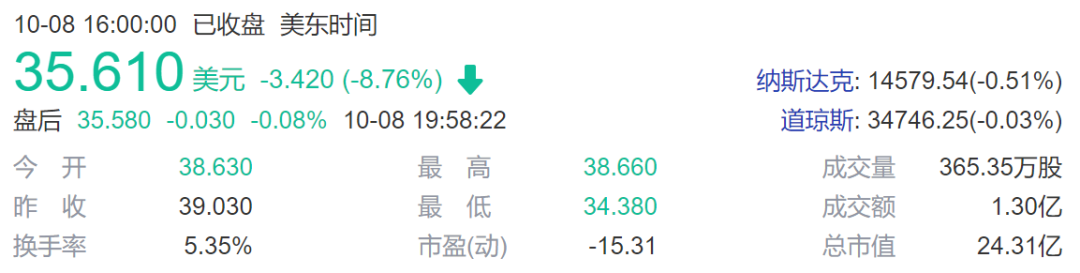
Editas Medicine股价下跌8%
CRISPR基因编辑的潜在风险
CRISPR基因编辑是一个优美的工具,然而,这个工具绝非完美,自诞生时起,CRISPR就伴随着脱靶性的担忧。实际上,随着基因编辑技术的优化,脱靶性已不是其面临的最大问题,而更多的风险因素逐渐开始暴露。
2021年4月12日,哈佛医学院 David Pellman 团队等在 Nature Genetics 期刊发表论文【3】。通过单细胞全基因组测序,发现CRISPR-Cas9基因编辑会破坏细胞核结构,导致微核和染色体桥的出现,最终导致染色体碎裂。这项研究表明,我们对CRISPR-Cas9基因编辑技术的安全风险及相关机制的认识仍有欠缺,在CRISPR基因编辑技术的安全性评估上还需谨慎。

在此之前,有多项研究发现了CRISPR基因编辑可能存在的多种潜在风险。
2018年6月12日,Nature Medicine 期刊背靠背发表两篇论文【4、5】,指出CRISPR-Cas9基因编辑能够激活p53引起的DNA损伤,这意味着,正常的p53基因会抑制CRISPR-Cas9基因编辑,也就是成功被编辑的细胞的p53基因很可能是有缺陷的,细胞癌变风险提高,如果将通过CRISPR/Cas9基因编辑的细胞用于治疗,将会有潜在致癌性风险。


2018年8月8日,Nature 的一篇论文指出【6】,CRISPR/Cas9基因编辑后的小鼠受精卵中出现频繁的大量碱基缺失(千碱基量级)。

2019年1月28日,Nature Medicine 的一篇论文则指出【7】,人体预先存在针对Cas9蛋白的免疫应答,这虽然不是安全问题,但会影响CRISPR基因编辑的疗效。

这篇 Nature Genetics 的论文指出,CRISPR-Cas9基因编辑过程中引入的DNA双链断裂,可能导致染色体碎裂,这是一种极具破坏性的基因组重排形式,可能会进一步导致致癌融合蛋白的出现或特定基因表达失调。
但目前所有CRISPR基因编辑领域临床疗法开发的公司都还没有考虑这个问题。
David Pellman 指出,目前研究的最多的治疗镰状细胞病和地中海贫血的CRISPR疗法,是在体外通过CRISPR-Cas9基因编辑CD34+造血干细胞,然后再回输到患者体内,他们估计回输的血细胞中有上百万个细胞存在CRISPR-Cas9导致的微核,具有染色体碎裂的风险。
目前,前全世界CRISPR-Cas9治疗的人还非常少,随着CRISPR疗法的普及,导致严重不良事件的基因毒性问题很可能随之出现。当然,这些研究并不为了减缓CRISPR的发展,而是让人们知道和重视CRISPR基因编辑存在的新的潜在风险。
结语
基因编辑在临床应用最基础的要求就是准确性与安全性。作为涉及DNA层面的遗传操作,基因编辑的副作用对病人造成的伤害无疑是可怕的,因此基因编辑技术进入临床使用需要慎之又慎。
对于准确性来说,CRISPR基因编辑技术自诞生以来,脱靶效应始终令人担忧,脱靶性通常是由于对DNA的错误切割造成的,除了提高CRISPR系统靶向的精准性以外,开发DNA切割活性丧失的dCas9,以及不依赖DNA双链断裂的单碱基编辑器也重要的方向。
对于安全性来说,人体对细菌来源的Cas9蛋白的免疫原性反反应,CRISPR-Cas9激活p53引起的DNA损伤,引起染色体大片段缺失,以及引起p53失活突变的富集等等,都是CRISPR在人体上应用的巨大障碍。
近几年,CRISPR基因编辑临床试验陆续开展,一些临床试验也展现了良好的效果。这表明,CRISPR基因编辑在人体上的应用已没有不可逾越的障碍,我们需要做的就是解决这些已发现的问题,为发展出安全和有效的人类基因编辑临床应用方案而努力。
参考资料:
1. https://www.nejm.org/doi/full/10.1056/NEJMoa2107454
2. https://www.nature.com/articles/s41591-020-0840-5
3. https://www.nature.com/articles/s41588-021-00838-7
4. https://www.nature.com/articles/s41591-018-0049-z
5. https://www.nature.com/articles/s41591-018-0050-6
6. https://www.nature.com/articles/s41586-018-0380-z
7. https://www.nature.com/articles/s41591-018-0326-x
8. https://www.nature.com/articles/d41587-021-00017-3
9. https://www.fiercebiotech.com/biotech/fda-stops-all-allogene-s-car-t-trials-over-safety-scare-raising-questions-about-future-gene


