Nature:白凡/黄岩谊团队与合作者揭示人体正常组织体细胞突变和衰老规律
时间:2021-12-27 14:01:39 热度:37.1℃ 作者:网络
人体内各种正常组织中细胞都在不可避免地积累突变。这些体细胞突变(somatic mutation)的发生通常与细胞活动中遭受的各类DNA损伤和细胞分裂过程中DNA的复制错误没有得到(正确的)修复相关。通常情况下,这些突变不会对体细胞的表型和功能造成明显影响,然而如果部分突变发生在一些与细胞增殖和死亡相关的重要基因上时,携带突变的体细胞很可能因此获得生长和竞争优势,造成体细胞突变克隆的形成及扩张,最终导致疾病和衰老的发生。最广为熟知的体细胞突变造成的疾病就是癌症。因此,研究正常组织中体细胞突变积累的过程及突变克隆的扩张及演化,对于更好理解癌症的早期发生过程具有重要意义。
2021年8月25日,北京大学生物医学前沿创新中心(BIOPIC)、北京未来基因诊断高精尖创新中心(ICG)白凡课题组、黄岩谊课题组、清华大学生命学院王建斌课题组和中国医学科学院北京协和医学院肿瘤医院林东昕、吴晨课题组合作在学术期刊Nature上发表题为A body map of somatic mutagenesis in morphologically normal human tissues的研究论文。该工作首次探索性地研究了来源于同一正常个体多个器官的正常组织中体细胞突变的图谱,揭示了相同种系背景及生活史下人体正常组织中体细胞突变积累及克隆演化规律,为理解癌症发生发展及细胞衰老等相关过程的机制奠定重要基础。

不同于肿瘤组织中癌细胞通常来源于单一克隆(monoclonal)扩张的情况,正常组织中的体细胞通常独立积累基因突变、以多克隆(polyclonal)平行演化的形式发展,因此同一个基因突变的积累往往只出现于少量细胞中,使得传统基于大量细胞的基因组测序技术难以检测到正常组织中的这些体细胞突变。
研究团队首先实现技术突破,发展了低起始量(600细胞)的深度全基因组/外显子组测序技术,使得捕获正常组织中的少量体细胞突变成为可能。其次,为了准确实现跨器官研究不同正常组织中体细胞基因突变积累和变异克隆演化规律,研究团队针对来自同一个个体的样本进行了系统深入的研究。
该研究从5名年龄在85岁以上的遗体捐赠者中获取了经组织病理学诊断为正常的支气管、食管、贲门、胃、十二指肠、肝、胰、结肠和直肠9种器官样本,并采用激光显微切割技术对每个器官的上皮组织根据空间分布进行切片取样和测序分析(图1a)。研究人员首先发现不同正常组织器官的体细胞均存在大量的突变积累,而体细胞突变负荷(somatic mutational burden)及等位基因突变频率(variant allele frequency)表现出明显的器官差异性。
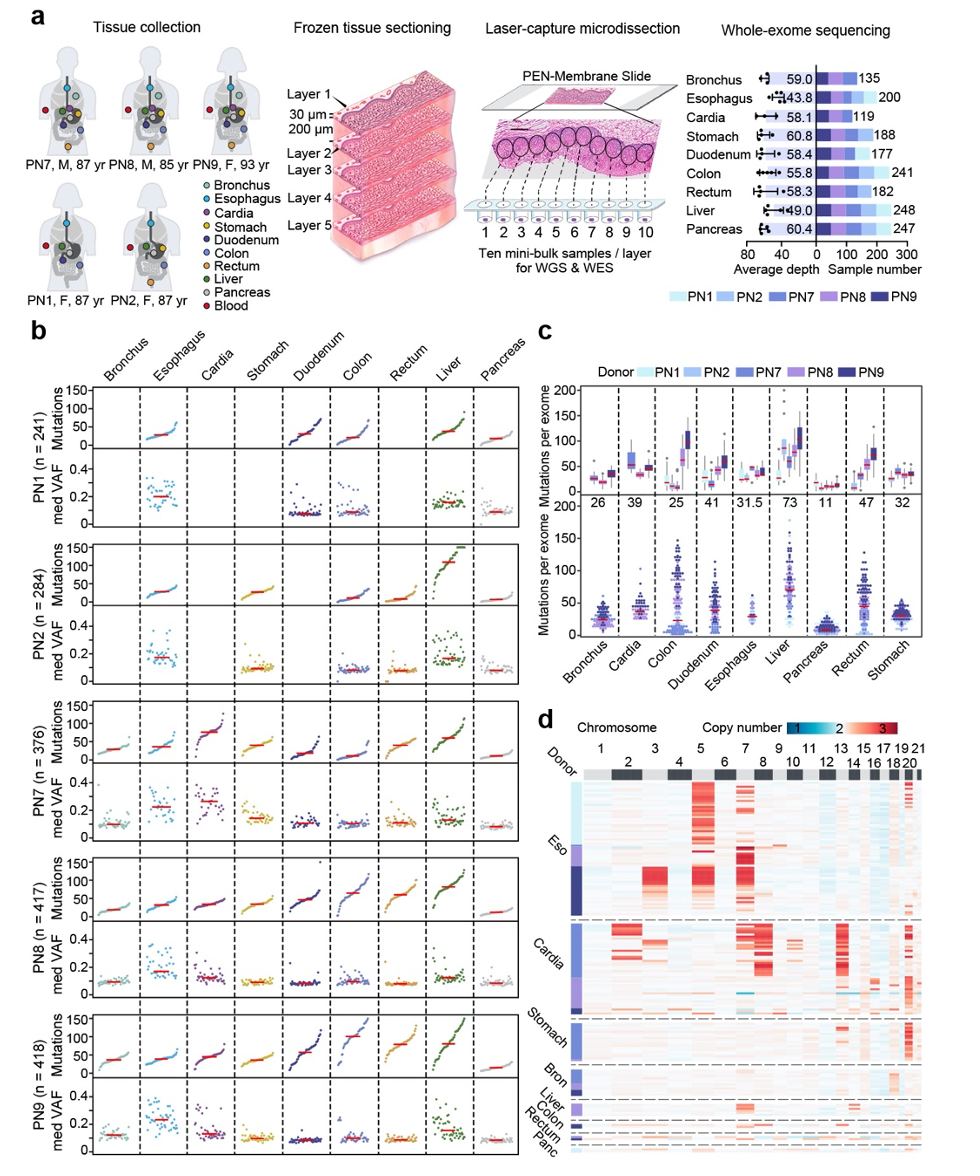
图1:9种正常组织体细胞突变及拷贝数变异图谱
通过矫正突变检测灵敏度及考虑不同器官克隆结构,研究人员比较了来源于同一个体的不同器官组织中的突变积累情况,发现正常的肝组织在9种组织器官中具有最高的体细胞突变负荷,甚至高于众多上皮细胞组织,而胰腺实质细胞中的突变负荷是最低的。结合GTEx项目中组织特异性基因表达数据,研究人员进一步发现在部分器官中体细胞突变负荷随基因表达量的增高而降低,潜在地反映了DNA转录偶联修复过程在高表达基因中更为活跃。
然而,与体细胞突变的情况不同,基因拷贝数变异(copy number alteration)尤其是基因组大范围拷贝数变异较少出现于各种正常组织中,并且拷贝数变异的发生具有一定的器官偏好性。在9种正常组织中,食管组织发生基因拷贝数变异最为频繁,且食管组织中的拷贝数变异事件集中发生于整段的3号、5号和7号染色体上(图1)。
接下来,研究人员通过对单碱基突变特征(single-base-substitution mutational signature)分析解析了不同正常组织积累大量体细胞突变的潜在驱动原因。利用Bayesian hierarchical Dirichlet process算法,研究人员总共分解出了出现于不同器官组织中的7种不同突变特征。
其中,与年龄及衰老过程相关的内源性突变特征SBS1和SBS5广泛地出现于所有的组织中,这说明与衰老相关的突变过程是造成人体正常组织积累体细胞突变的重要原因。有趣的是,SBS1与SBS5两种突变特征在各种正常组织中对体细胞突变积累的相对贡献比例存在着明显的器官特异性。在十二指肠、结肠和直肠的正常组织中,SBS1与SBS5的比例相对较高,而在支气管、胰腺、肝及食管组织中这个比例相对较低。这可能潜在的与不同组织中体细胞细胞增殖及更新换代的速率相关。
此外,两种与外源诱变因素相关的突变特征SBS4(与吸烟相关)和SBS22(与诱变剂马兜铃酸相关)主要出现于肝组织中,这揭示了外源环境因素对人体正常组织体细胞突变积累的诱导作用,同时反映了肝组织具有较高的受环境因素诱变的风险。通过结合样品在显微切割中的具体空间物理位置信息,研究人员进一步发现即使在同一个体、同一组织中的临近样品之间,突变特征可以存在明显的异质性,由此反映了各种内、外源致变因素在正常组织中的作用活性存在物理区域上的差异 (图2)。
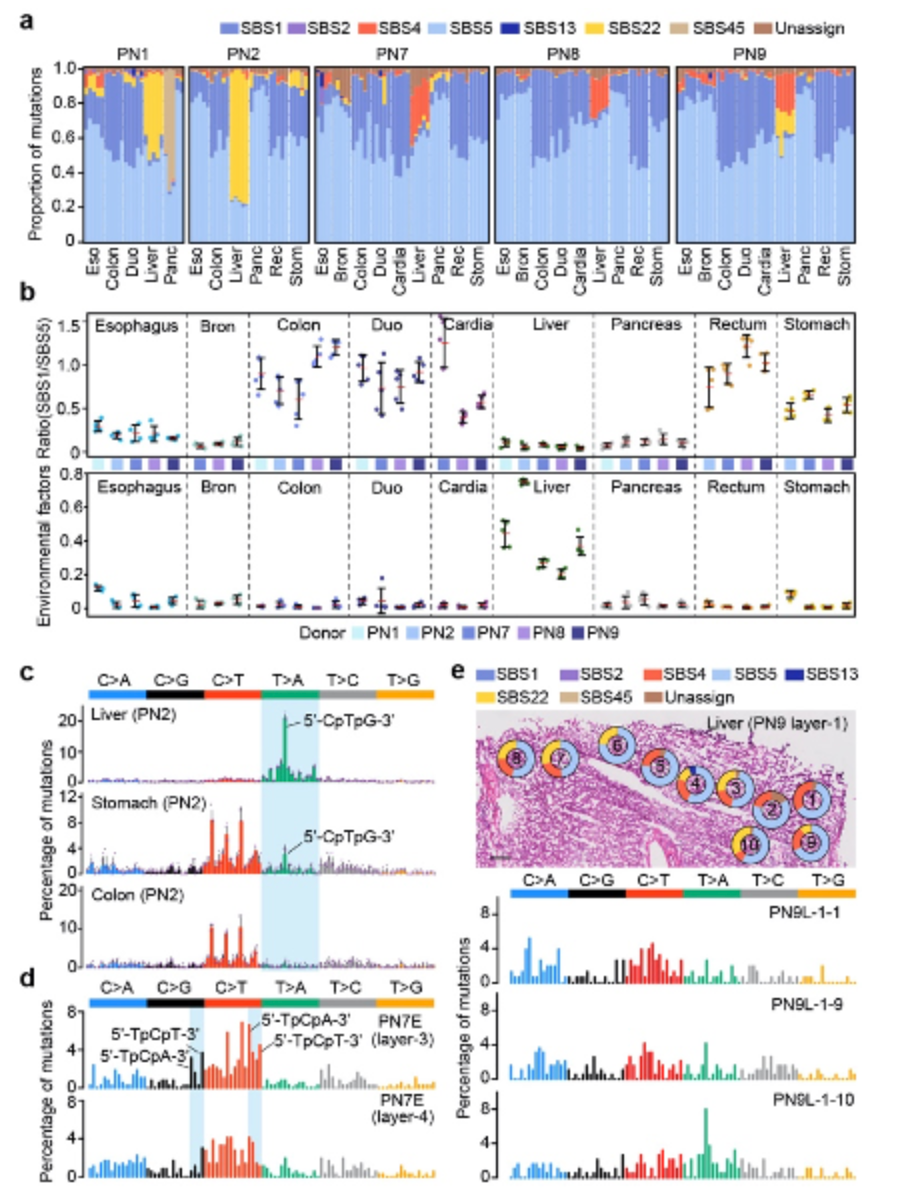
图2:正常组织体细胞突变特征解析
通过对数据的进一步挖掘,研究人员分析了各种正常组织中积累的与癌症相关的“驱动基因”突变,总共找到了32个发生突变的“驱动基因”,其中包括了NOTCH1、TP53、ARID1A和ERBB2等被广泛认知的、与肿瘤发生相关的基因。对“驱动基因”突变的深入分析揭示:
(1)NOTCH1是研究所涉及正常组织中发生突变最多的驱动基因,其突变广泛出现于多种组织中;
(2)TP53是正常组织中发生癌症相关热点突变(hotspot mutations)最多的基因;
(3)“驱动基因”突变的积累在器官之间以及个体之间存在明显异质性,且具有一定的器官偏好性。例如,食管是所有9种正常组织中积累“驱动基因”突变最多的组织,而胰腺实质是最少的组织;NOTCH1和TP53突变显著富集在正常食管组织中,而MUC6突变集中发生在正常贲门和胃组织中;
(4)部分“驱动基因”突变在正常组织中发生的频率高于其在对应的癌组织中的发生频率,潜在地反映了克隆演化在正常组织中与癌组织中可能存在不同的分子机制。例如,MUC6突变在正常胃(包括贲门和胃)中出现的频率显著高于胃癌中出现的频率(图3)。

图3:驱动基因突变在各种正常组织中的积累情况
最后,研究人员深入分析了同一个体的各个正常组织中体细胞突变克隆扩张及演化情况。通过关联体细胞突变负荷与突变克隆细胞比率(mutant cell fraction)的分布情况,研究人员发现突变克隆扩增的程度并不必然与突变负荷相关:
(1)食管和贲门组织中突变克隆扩张相对较大但体细胞突变负荷相对较低;
(2)结肠和直肠组织中突变克隆扩张相对较小但体细胞突变负荷相对较高;
(3)部分肝组织样品同时具有较高的体细胞突变负荷和较大的突变克隆扩张。
进一步,通过结合空间取样的位置信息及突变克隆细胞比率聚类情况,研究人员构建了亚毫米级别分辨率的突变克隆空间扩张图谱(图4),发现在正常食管中突变克隆可能扩张到近毫米级别,潜在与食管中广泛积累的“驱动基因”突变以及拷贝数变异相关。而在结肠和直肠等组织中,克隆扩张很少超过显微切割的范围,且突变克隆往往以独立起源及演化的模式存在,潜在地受限于组织的物理微结构(physical micro-structure; 例如:crypt结构)。这些结果表明,在不同组织及器官中,体细胞突变克隆的扩张及演化会受到多种因素的促进或制约。
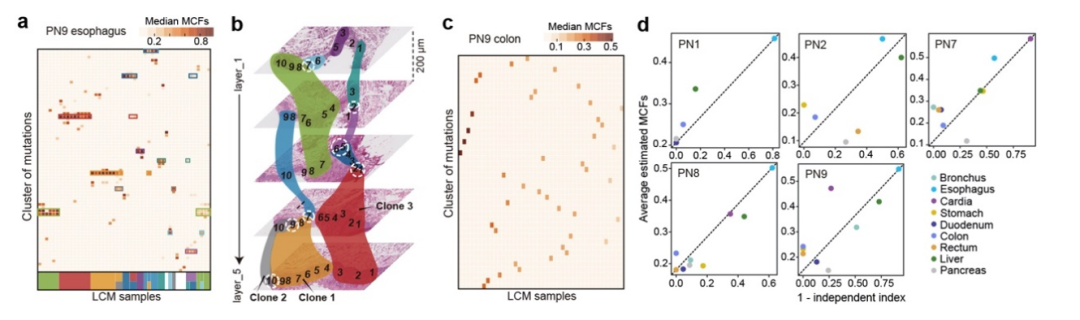
图4:体细胞突变克隆扩张及演化
北京大学生物医学前沿创新中心(BIOPIC)博士后李若岩(现工作于英国剑桥Wellcome Sanger Institute)、博士研究生狄琳、清华大学生命学院博士研究生李杰及中国医学科学院北京协和医学院肿瘤医院樊文艺博士(现为北京大学博士后)为本文的并列第一作者。北京大学BIOPIC白凡研究员、黄岩谊教授、清华大学生命学院王建斌研究员以及中国医学科学院北京协和医学院肿瘤医院吴晨教授、林东昕院士为该研究论文的共同通讯作者。感谢所有同意并参与的捐赠者及其家人对科学研究做出的贡献。该研究项目得到了国家自然科学基金委、中国医学科学院创新工程、北京市卓青计划、北京未来基因诊断高精尖创新中心、北京结构生物学高精尖创新中心等的支持。
原始出处:
Li R, Di L, Li J, Fan W, Liu Y, Guo W, Liu W, Liu L, Li Q, Chen L, Chen Y, Miao C, Liu H, Wang Y, Ma Y, Xu D, Lin D, Huang Y, Wang J, Bai F, Wu C.A body map of somatic mutagenesis in morphologically normal human tissues.Nature. 2021 Sep;597(7876):398-403
白凡研究员

白凡,北京大学生物医学前沿创新中心(BIOPIC)、北京未来基因诊断高精尖创新中心(ICG)、生命科学学院研究员,北京大学第一医院兼职研究员,博士生导师,国家自然科学基金委优秀青年基金、杰出青年基金获得者。2003年本科毕业于北京大学物理系,2008年获得英国牛津大学生物物理博士学位,2008-2011年间先后在牛津大学、日本大阪大学从事博士后研究工作。
白凡实验室将综合利用单分子荧光显微成像技术、单细胞基因测序技术,研究与医学临床直接相关的前沿课题,包括:(1)单细胞基因测序技术应用于癌症病人外周血循环肿瘤细胞研究,探索癌症转移的分子生物学机制及无创癌症诊断、预后判断、疗效评价的临床方法;(2)大样本基因测序研究中国人群高发癌症的基因突变特征,发掘引起癌症表型转化、转移的关键驱动事件;(3)研究细菌行为、致病性,抗生素杀菌原理和细菌抗药、耐药的分子机制。
黄岩谊研究员

黄岩谊,北京大学生物医学前沿创新中心(BIOPIC)研究员,北京未来基因诊断高精尖创新中心(ICG)研究员、副主任,北京大学-清华大学生命科学联合中心研究员,北京大学化学与分子工程学院教授。1993年进入北大学习,1997年获化学专业理学学士学位,2002年获无机化学专业理学博士学位。2002-2005年在美国加州理工学院应用物理系、2005-2006年在美国斯坦福大学生物工程系从事博士后研究工作。2006年回到北京大学工作。
黄岩谊课题组致力于发展应用于面向生命科学和医学研究的新技术,课题组当前的研究兴趣集中在微量样品多组学技术、微流控技术及类器官培养技术三个方面。


