Nat commun:阿尔茨海默病分期和亚型的多队列-纵向聚类分析
时间:2022-11-18 20:54:06 热度:37.1℃ 作者:网络
了解阿尔茨海默病(AD)异质性对于理解AD的潜在病理生理机制非常重要。然而,AD脑萎缩亚型可能反映的是疾病的分期也可能是疾病的亚型。近期《nature communications》期刊发表了题为“Multi-cohort and longitudinal Bayesian clustering study of stage and subtype in Alzheimer’s disease”的文章,作者利用纵向磁共振成像数据(891名AD患者,305名健康对照者)和纵向聚类分析方法评估了AD脑萎缩随时间变化的轨迹。作者发现了五种纵向脑萎缩模式,将先前报告的AD亚型分为两种萎缩途径(中颞叶和皮质)。本研究将AD亚型从横截面理解过渡到纵向聚类视角。作者提出的模型有助于解决将AD疾病阶段和实际的疾病亚型区分开的一个长期问题。
 研究背景
研究背景
阿尔茨海默病(AD)的脑萎缩与认知能力下降和神经原纤维缠结(NFT)的拓扑扩散有关。神经病理学和体内神经影像学研究挑战了AD作为单一实体的假设,支持AD作为一种异质性疾病的假设。最新研究表明AD的异质性可以从两个主要维度来解释:严重程度和典型性,它们以各种生物标志物和临床表现的形式出现。基于区域萎缩和/或NFT扩散,文献报道了四种AD亚型:典型亚型、海马保留型、边缘优势亚型和微小萎缩亚型。
迫切需要知道的是观察到的异质性是否反映不同的疾病阶段或不同的亚型,以及这些亚型是否最终在疾病的晚期阶段汇集。生物标志物研究、数据收集和计算方法的进步显著提升了研究不同疾病异质性的能力。这些计算方法结合各种体内病理生理标志物来模拟疾病的异质性。根据神经病理学、神经影像学、临床和生物标志物对AD患者进行有意义的分组来揭示AD临床诊断的异质性。
然而,目前的研究是基于横断面分析,增加了所识别的模式反映不同疾病阶段而不是疾病亚型的可能性。最近的研究从横截面成像数据集模拟了体内亚型生物标志物的轨迹,来推断疾病分期。这是评估和解释疾病分期的第一步。然而,不能排除已识别的模式可能仍然反映的是不同疾病阶段的可能性,因为纵向信息不用于聚类,仅用于描述事后亚型。这一假设在具有各种生物标志物类型(增加疾病特异性)的模型中得到了部分证实,但是当每个患者的事件的明确时间尺度不到位时,这一假设仍然是不现实的。
最近的综述介绍了目前识别异质性疾病亚型的方法,并总结了文献中现有的AD亚型,指出了需要克服的重要数据和方法学局限性,以更好地理解AD中的异质性。根据他们的结论,该领域缺乏基于明确时间尺度(即测量时的年龄,疾病发作时的年龄)的纵向AD亚型,以便将疾病阶段与疾病亚型区分开来。
这项研究的目的是评估AD脑萎缩模式的异质性是源于对疾病不同阶段的观察,还是反映了具有特定萎缩和认知轨迹的不同亚型。作者使用纵向贝叶斯聚类框架对纵向数据进行建模,从临床疾病发作(明确的时间尺度)开始8年内,同时评估疾病分期和异质性(以前的研究仅使用横断面数据)。利用来自四大洲的多中心队列的结构磁共振成像(MRI)数据(Alzheimer’s Disease Neuroimaging Initiative,Japanese ADNI,AddNeuroMed 以及the Australian Imaging, Biomarkers and Lifestyle study)来探寻AD不同萎缩轨迹。仅纳入淀粉样蛋白阳性AD患者以增加诊断特异性。
此外,评估了萎缩亚型在疾病过程中是否聚合,这是了解AD异质性的重要一步。通过外部数据集中对发现的萎缩模式进行验证,以评估作者提出的模型对新患者进行分类的能力。最后,评估了认知能力下降和相关疾病修饰因子(如APOE基因型,教育和病前智力)的亚型间和亚型内的差异。
结果
纳入样本包括来自4个队列的1196名参与者(891 位AD痴呆患者和305位认知功能正常者),纳入数据集和验证数据集分别由320和571名AD痴呆患者组成。队列的人口统计学资料见表1。
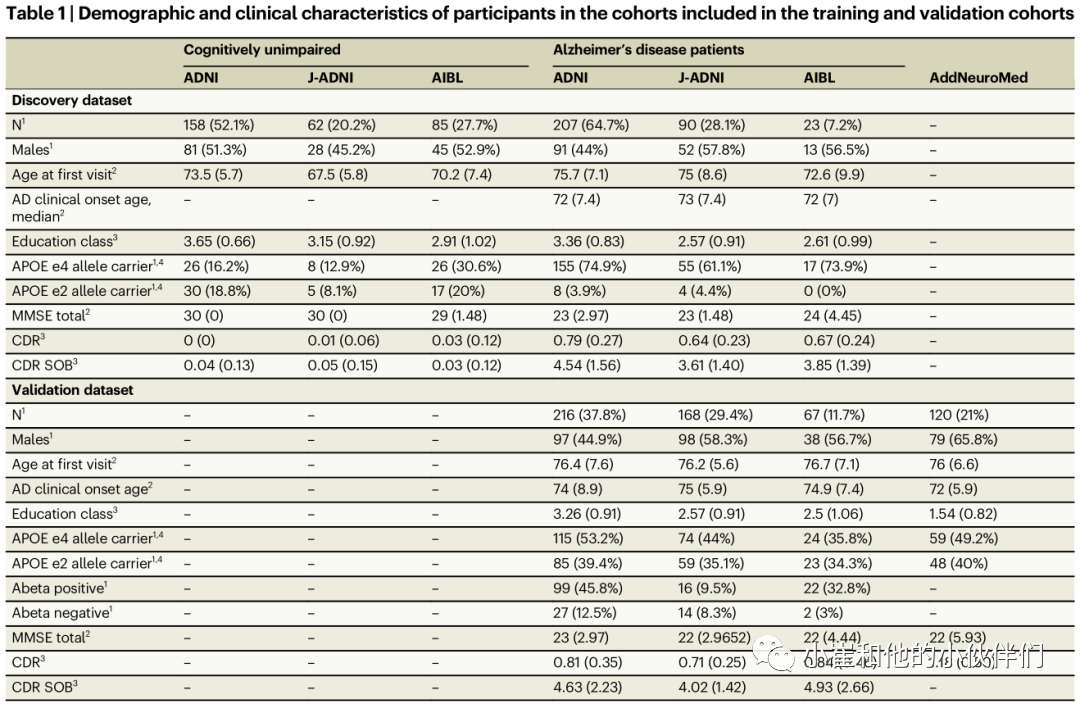 表 1 纳入和验证队列的参与者的人口统计学资料。注:1n (%);2median(中值绝对距离);3平均值(标准差);4百分比分母是指未丢失的APOE记录的总和;教育年限分为 4 个等级(1 = 0-8年;2 = 9-13年;3 = 13-15年;4>15年)。AD 组在基线 MRI 访问时的 MMSE 分数的中值为 23(第一个四分位数:21,第三个四分位数:25)。
表 1 纳入和验证队列的参与者的人口统计学资料。注:1n (%);2median(中值绝对距离);3平均值(标准差);4百分比分母是指未丢失的APOE记录的总和;教育年限分为 4 个等级(1 = 0-8年;2 = 9-13年;3 = 13-15年;4>15年)。AD 组在基线 MRI 访问时的 MMSE 分数的中值为 23(第一个四分位数:21,第三个四分位数:25)。
认知未受损(CU)组和AD组的纵向灰质模式显示CU组的灰质随着年龄的增长而恶化(图1A)。和预期的一致,AD组显示出更广泛的萎缩(图1B)。应用AD 数据集的校正方法(每例AD患者的灰质相对于图1A中的CU模型进行标准化)显示:在人群水平上AD根据患者的随年龄呈现出不同的萎缩模式。65岁以下的患者通常有更多的后皮质萎缩,而75岁以上的患者表现为典型的AD中颞叶萎缩模式(图1C)。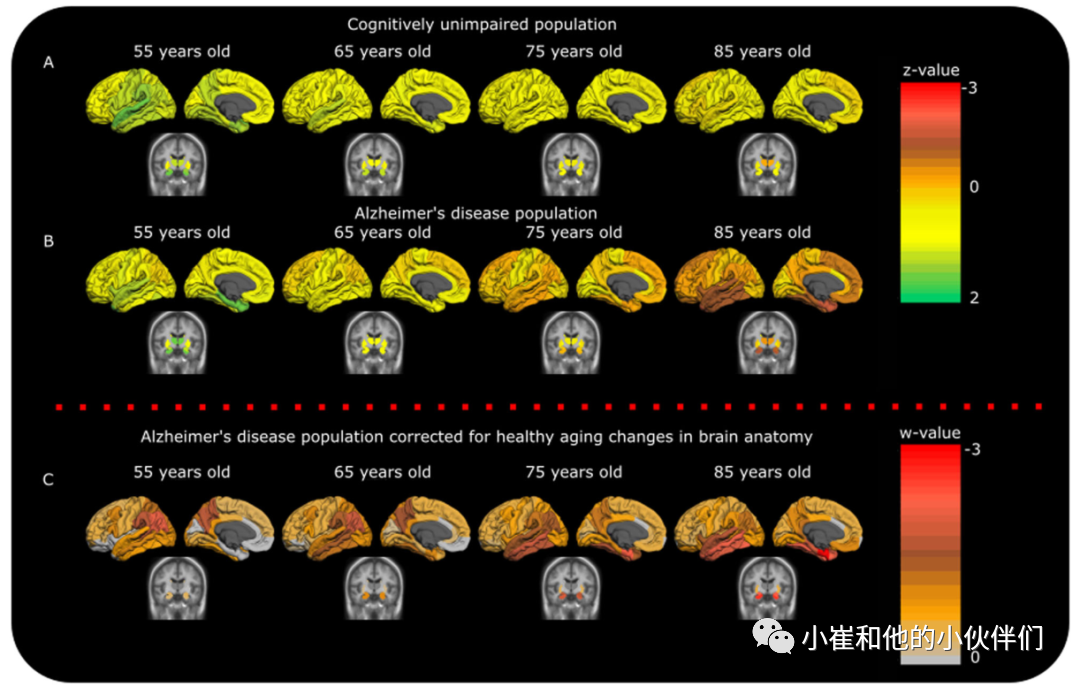 图 1 CU 组和 AD 组的脑萎缩模式。为了计算不同年龄(A,B)的CU和AD萎缩模式,数据进行了z值转换。使用一个混合效应多变量模型来可视化两个诊断标签(红色,更多的萎缩;黄色,更少的萎缩)之间的萎缩差异。右上方的颜色图例是指样本均值的标准偏差(0 对应于AD和CU样本值的均值)。在55岁时,AD似乎与CU人群具有相似的萎缩水平,并且随着年龄的增长而显示出差异。为了使基于CU样本(C)的AD数据校正的可视化,使用了两个单独的混合效应多变量模型(一个用于CU样本,一个用于AD样本)。AD数据根据CU数据进行了标准化。因此,较低的颜色图例显示低于CU总体的 AD总体的标准偏差(w 值,0对应于CU样本值的平均值)。与对照组相比,较年轻的 AD患者(55至65岁之间)表现出更多的后皮质萎缩,而较年长的AD患者(75岁以上)显示出更明显的中颞叶和海马萎缩。
图 1 CU 组和 AD 组的脑萎缩模式。为了计算不同年龄(A,B)的CU和AD萎缩模式,数据进行了z值转换。使用一个混合效应多变量模型来可视化两个诊断标签(红色,更多的萎缩;黄色,更少的萎缩)之间的萎缩差异。右上方的颜色图例是指样本均值的标准偏差(0 对应于AD和CU样本值的均值)。在55岁时,AD似乎与CU人群具有相似的萎缩水平,并且随着年龄的增长而显示出差异。为了使基于CU样本(C)的AD数据校正的可视化,使用了两个单独的混合效应多变量模型(一个用于CU样本,一个用于AD样本)。AD数据根据CU数据进行了标准化。因此,较低的颜色图例显示低于CU总体的 AD总体的标准偏差(w 值,0对应于CU样本值的平均值)。与对照组相比,较年轻的 AD患者(55至65岁之间)表现出更多的后皮质萎缩,而较年长的AD患者(75岁以上)显示出更明显的中颞叶和海马萎缩。
聚类评估
纵向聚类分析表明,2-聚类和5-聚类模型最优,差异最小。2 -聚类模型更适用于一个聚类准则(MCMC 样本中随机效应参数越少,自相关度越高),而 5 -聚类模型更有利于另一个聚类准则(较低的模型偏差)。其他聚类解决方案的质量评分组合较差(许多自相关 MCMC 样本或模型偏差较高)。2-聚类解决方案仅在皮质严重程度(高与低脑萎缩)方面将发现集分开,而5-聚类解决方案(图2,拟合值)揭示了空间上不同的萎缩亚型。由于从探索性的角度来看,不同的空间萎缩亚型更为重要,并且考虑到AD亚型的先前文献,在这里作者将对5-聚类方案的结果进行解读。
 图 2 AD发病以来不同纵向萎缩模式的皮质厚度和皮质下体积的拟合值。临床AD发病时的萎缩拟合值。每行代表一组具有相应萎缩模式的患者。色标显示皮质变薄和皮质下体积损失与Aβ阴性,认知未受损(CU)个体(红色,更多萎缩;黄色,较少萎缩)相比。数据经过w值转换,因此颜色表示低于老化控制的CU组的标准偏差。颅内体积和MRI扫描仪场强的拟合值是固定的。
图 2 AD发病以来不同纵向萎缩模式的皮质厚度和皮质下体积的拟合值。临床AD发病时的萎缩拟合值。每行代表一组具有相应萎缩模式的患者。色标显示皮质变薄和皮质下体积损失与Aβ阴性,认知未受损(CU)个体(红色,更多萎缩;黄色,较少萎缩)相比。数据经过w值转换,因此颜色表示低于老化控制的CU组的标准偏差。颅内体积和MRI扫描仪场强的拟合值是固定的。
集群萎缩模式和判别特征
在这些数据集中,作者发现五组患者表现出逐渐或急剧的纵向萎缩进展(图2)。与CU组相比,最大的集群,微小萎缩(MA,59.1%),在临床AD发作时中具有非常小的中颞叶萎缩(图2,低于CU总体1.6个标准差)。该型进展缓慢,内嗅和海马受累,延伸至其它颞叶区域。第二大集群,边缘优势萎缩(LPA,29.1%),在临床开始时表现为内嗅性皮质萎缩,后来累及包括海马体在内的其它颞叶区域。第三个集群LPA+(7.2%)在空间上与LPA集群相似,但在AD发病时内嗅皮层表现出更多的萎缩。萎缩逐渐延伸到颞叶,然后进一步延伸到皮层的其余部分。
作者还发现了一个聚集性弥漫性萎缩(DA,1.6%),在AD发病时已经有颞叶和额叶受累,萎缩在病程中迅速扩散。最后一个聚集体,海马保留型(HS,3.1%),发病时有顶叶萎缩,没有内颞叶结构受累,但萎缩进展迅速。MA和LPA模式集中于广泛的颞叶萎缩,而LPA+在疾病发作7年后集中于DA。随着时间的推移,最不典型的萎缩模式HS也进展为更弥漫性的萎缩模式,但较少涉及海马。聚类名称是根据AD开始时的萎缩模式确定的。表 2 提供了每种亚型的四维表征,以说明萎缩和认知模式如何随时间的演变(表3,图 3)。
簇截距(AD开始)显示 HS 和 DA簇在皮质顶叶明显比其它三个簇更薄(图 2 和 4)。LPA 簇的内嗅萎缩少于 LPA+。关于集群斜率(随时间的萎缩演变),后扣带回、盖部、眶部和岛叶将DA和HS与其它三个集群区分开来(图 2、4)。HS簇的缩斜率最陡,其次是DA和LPA+簇。
 表 2 四组AD患者的纵向萎缩和认知轨迹总结。
表 2 四组AD患者的纵向萎缩和认知轨迹总结。
 表 3 聚类集群特征。注:1n (%);2median(中值绝对距离);3平均值(标准差);4AD开始时的估计值(估计标准误差);5AD开始时的估计值(估计的年度变化);教育年限分为4个等级(1 = <0-8 岁;2 = 9-13 岁;3 = 13-15 岁;4 > 15 岁)。使用 Holms-Sidak 方法评估多次比较的校正。ANART 美国全国成人阅读测试、MMSE 简易精神状态检查、CDR临床痴呆评分、CDR SOB CDR方框总和、GDS老年抑郁量表。a集群1与其他集群之间的基线差异。b集群1与其他集群之间的纵向差异。c发现数据集和验证数据集之间的基线或纵向差异。
表 3 聚类集群特征。注:1n (%);2median(中值绝对距离);3平均值(标准差);4AD开始时的估计值(估计标准误差);5AD开始时的估计值(估计的年度变化);教育年限分为4个等级(1 = <0-8 岁;2 = 9-13 岁;3 = 13-15 岁;4 > 15 岁)。使用 Holms-Sidak 方法评估多次比较的校正。ANART 美国全国成人阅读测试、MMSE 简易精神状态检查、CDR临床痴呆评分、CDR SOB CDR方框总和、GDS老年抑郁量表。a集群1与其他集群之间的基线差异。b集群1与其他集群之间的纵向差异。c发现数据集和验证数据集之间的基线或纵向差异。
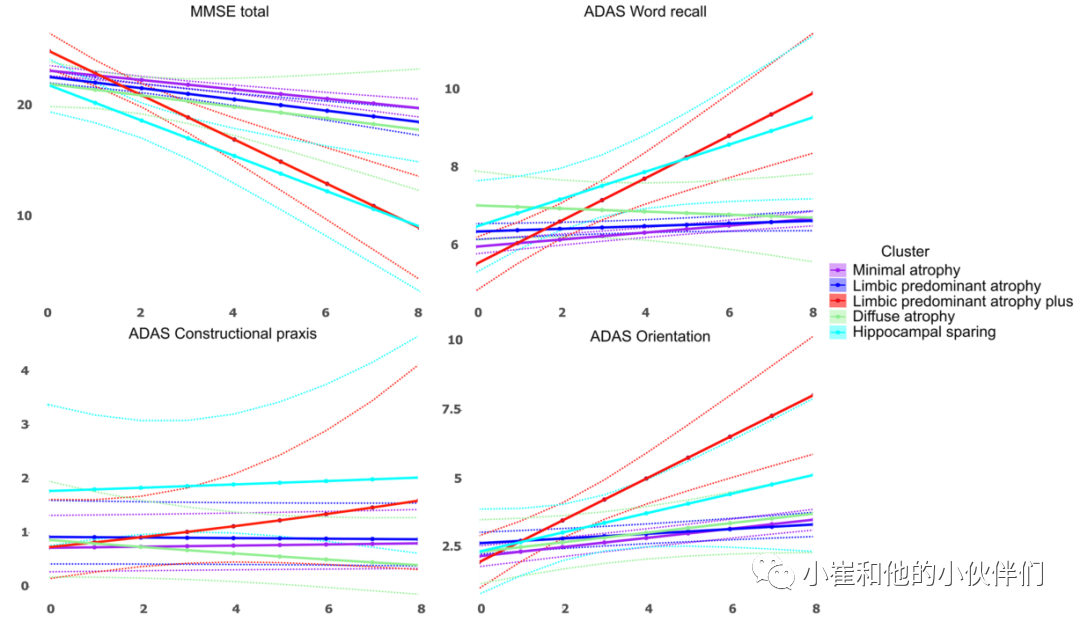 图 3 痴呆临床发作后的集群特异性认知轨迹。使用混合效应模型估计轨迹,以考虑受试内部和队列变异性。MMSE简易精神状态检查,ADAS阿尔茨海默病评估量表。虚线表示 95% 置信区间。
图 3 痴呆临床发作后的集群特异性认知轨迹。使用混合效应模型估计轨迹,以考虑受试内部和队列变异性。MMSE简易精神状态检查,ADAS阿尔茨海默病评估量表。虚线表示 95% 置信区间。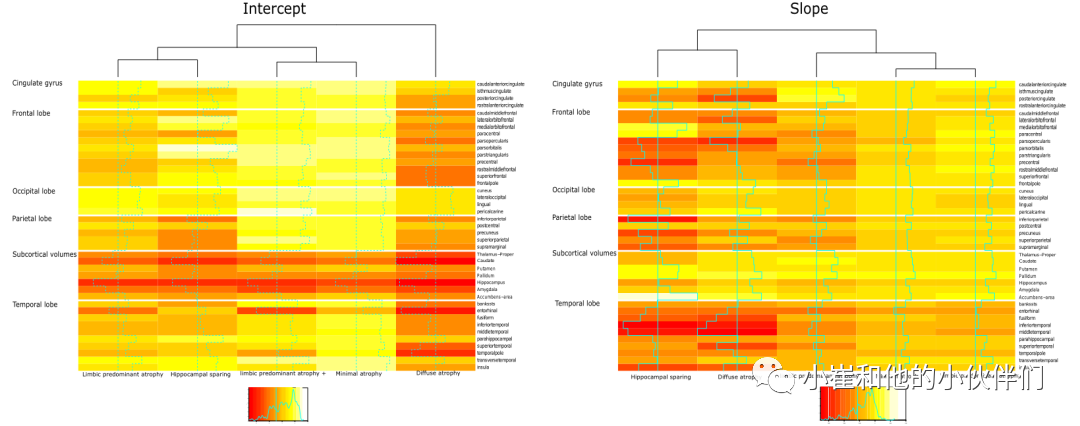 图 4 纵向聚类模型聚类均值截距和斜率萎缩系数。热图的每一行都是根据神经解剖学空间位置进行分组(红色,更多的萎缩;黄色,更少的萎缩)。表示不同聚类的列是根据聚类之间的相似性进行分组。单元格内的垂直线表示聚类区域平均ROI值(垂直虚线表示值0,与CU样本无差异)。弥漫性萎缩簇的截距最低,并且不与任何其它簇分组。弥漫性萎缩和海马保留簇的簇斜率组合在一起。边缘优势亚型和微小萎缩亚型归为一类。
图 4 纵向聚类模型聚类均值截距和斜率萎缩系数。热图的每一行都是根据神经解剖学空间位置进行分组(红色,更多的萎缩;黄色,更少的萎缩)。表示不同聚类的列是根据聚类之间的相似性进行分组。单元格内的垂直线表示聚类区域平均ROI值(垂直虚线表示值0,与CU样本无差异)。弥漫性萎缩簇的截距最低,并且不与任何其它簇分组。弥漫性萎缩和海马保留簇的簇斜率组合在一起。边缘优势亚型和微小萎缩亚型归为一类。
与2-cluster方案相比,5种纵向萎缩模式(图 2)揭示了一个精细的分组,其中包括AD患者萎缩分期的典型分布的变化。在表 3 中,作者总结了萎缩的纵向模式,以显示五种纵向模式的不同特征以及与之相关的患者特征。在主聚类分析之后,聚类特异性萎缩截距和斜率的事后等级聚类(图 4,斜率树状图和图例)定量显示,MA、LPA 和 LPA+随时间推移具有相似的萎缩空间分布(然而AD发作时的萎缩水平不同,萎缩进展速度不同)从颞中叶开始并进一步扩散到新皮层。HS模式遵循另一种空间萎缩分布,即从皮质区域开始。DA簇与HS模式一起定量分组,但同时表达两种进行性萎缩模式,因为作者在疾病晚期阶段(已经广泛的萎缩)观察到它。
集群特征
五个集群中每个队列的患者百分比相似(表 3)。在发现的数据集中,MA 的 APOE e4 携带者频率最高(75%),而HS最低(40%)。DA和HS集群的患者具有较高的教育水平(>15 岁),其次是MA、LPA 和LPA+ 组(≤15 岁)。使用MA(数据集中最大的集群)作为参考组,作者发现LPA+ 和 HS 的美国国家成人阅读测试(ANART)分数显著降低(p < 0.05)。对于LPA,AD 发作时的简易精神状态检查 (MMSE) 明显更差(p < 0.05)(图 3)。
纵向来看,LPA+ 和 HS的MMSE下降最快(p < 0.05)。关于阿尔茨海默病评估量表 (ADAS-cog) 子量表,在LPA中,记忆力(单词回忆)最初较低,而LPA+ 在该领域随时间推移下降最快。在AD发作时,HS的语言(遵循命令)和实践(结构性)明显比其它集群差。在 AD 发作时,LPA+ 的定向 (ADAS) 更差。在模型验证中,未发现Aβ在聚类状态之间存在差异。有关患者病史的信息可用于阿尔茨海默病神经影像学计划 (ADNI) 和日本阿尔茨海默病神经影像学计划 (J-ADNI),但不适用于澳大利亚影像、生物标志物和生活方式研究 (AIBL) 或AddNeuroMed 队列。
截距和斜率协方差矩阵
MA具有最大的总节点强度,并被用作截距和斜率的成对聚类比较的参考组。LPA和LPA+ 的节点强度较低,几乎没有例外(图 5)。DA仅在少数内侧(额叶、颞叶和枕叶)大脑区域(截距和斜率)具有较高的节点强度,而HS在一些腹内侧前额叶和内侧颞叶区域的截距处具有较高的节点强度。
 图 5 聚类特异性协方差矩阵与节点强度的比较。将聚类特定截距(A、C、E 和 G)和斜率(B、D、F 和 H)协方差矩阵与网络理论进行了比较。球体直径显示每个区域的节点强度。最小萎缩星团的节点强度高于其它星团的区域以红色显示,蓝色则相反。
图 5 聚类特异性协方差矩阵与节点强度的比较。将聚类特定截距(A、C、E 和 G)和斜率(B、D、F 和 H)协方差矩阵与网络理论进行了比较。球体直径显示每个区域的节点强度。最小萎缩星团的节点强度高于其它星团的区域以红色显示,蓝色则相反。
模型验证
作者的模型通过两种方式得到验证。首先,作者使用了一个独立的未见过的患者MRI数据集,以评估这五种纵向萎缩模式是否可以对新数据集进行合理的分类。除此之外,作者还对ADNI和J-ADNI/AIBL数据集分别进行了聚类分析。聚类概率表明,很少患者有属于发现数据集中的多个聚类,在验证数据集中更少(数据集的0.009%)。最后,在验证数据集中,各聚类在中位病程时的中位皮质和海马萎缩与同一疾病阶段的模型拟合值具有高度相似性(图 6)。
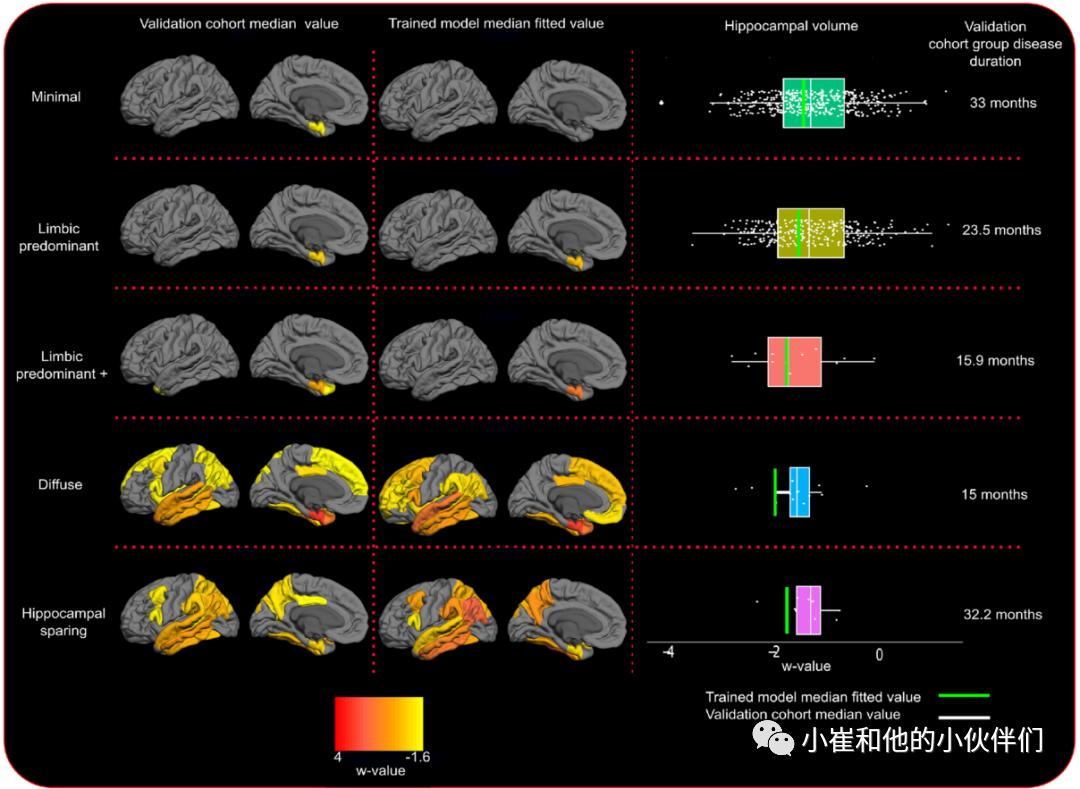 图 6 模型拟合值和验证数据集萎缩水平的比较。训练后的聚类分析模型与新验证数据集的AD开始后的萎缩拟合值。对每组新观察结果进行分类,并计算中位疾病持续时间。然后通过聚类模型(中间列)计算每个聚类中位疾病持续时间的萎缩拟合值。每个聚类的新数据的中位数萎缩图(组中位数萎缩)显示在左列中。右列显示每个簇的海马体体积(箱线图颜色:绿色,最小;n = 420,橄榄色:边缘优势;n = 283,橙色:边缘优势+;n = 12, 蓝色:弥漫性;n = 13, 紫色:海马的;n = 8)。新观察结果(包括重复测量)和模型拟合值海马萎缩(绿色垂直线)。
图 6 模型拟合值和验证数据集萎缩水平的比较。训练后的聚类分析模型与新验证数据集的AD开始后的萎缩拟合值。对每组新观察结果进行分类,并计算中位疾病持续时间。然后通过聚类模型(中间列)计算每个聚类中位疾病持续时间的萎缩拟合值。每个聚类的新数据的中位数萎缩图(组中位数萎缩)显示在左列中。右列显示每个簇的海马体体积(箱线图颜色:绿色,最小;n = 420,橄榄色:边缘优势;n = 283,橙色:边缘优势+;n = 12, 蓝色:弥漫性;n = 13, 紫色:海马的;n = 8)。新观察结果(包括重复测量)和模型拟合值海马萎缩(绿色垂直线)。
此外,当聚类分别应用于ADNI和J-ADNI/AIBL数据集时,前者显示五种不同的萎缩模式,后者显示四种不同的萎缩模式。在独立队列中发现的萎缩模式与总体发现数据集相似,包括MA、LPA、LPA+、DA和HS。从数量上来说,MA更类似于ADNI聚类3和JADNI/AIBL聚类3(在截距和斜率方面),LPA更类似于ADNI聚类2和J-ADNI/AIBL聚类2,LPA+更类似于ADNI聚类1和J-ADNI/AIBL 聚类3,DA 更类似于 ADNI 聚类4 和J-ADNI/AIBL聚类4,最后HS更类似于ADNI聚类2和 J-ADNI/AIBL聚类1。
讨论
本研究的一个主要贡献是将AD亚型从横截面理解过渡到纵向聚类视角。以前报道的一些AD亚型似乎反映了疾病的不同阶段,这些阶段可以在本文的五种纵向萎缩模式中观察到。因此,作者的数据有助于解决将疾病阶段与实际疾病亚型分开的长期问题。这是通过使用明确的时间尺度,即从疾病发作开始8年内对来自四大洲的891名AD痴呆病例的大型多种族队列中对纵向数据进行建模来实现的。另一个重要发现是,具有明显不同萎缩轨迹的AD亚型可能在疾病晚期汇集。这是对AD神经退行性变的新认识,结合神经病理学和临床异质性的知识,可以为未来个性化预测AD的生物学改变和认知功能下降奠定基础。
在模拟的临床疾病发作时,作者的方法成功识别了先前在神经病理学和神经影像学亚型研究中发现的相同萎缩模式 (典型亚型、海马保留型、边缘优势亚型和微小萎缩亚型)。作者的结果揭示了两种主要的萎缩途径。作者引入路径这一术语来描述AD患者,这些患者随着时间的推移表现出相似的萎缩大脑区域空间分布。在相同的萎缩途径中,患者可能比其他人(LPA 和 MA)进展得更快(LPA+),但随着时间的推移,他们的萎缩空间分布是相似的。该途径与AD中的第二种不同萎缩途径形成对比,后者具有不同的空间分布,主要是随着时间的推移皮质萎缩。进展率的差异也反映了患者认知能力下降的速度。了解在同一途径内以及不同途径之间的影响进展差异的潜在因素是未来一个非常重要的研究方向。
MA、LPA或LPA+ 纵向萎缩簇的某些疾病阶段,发现了轻微萎缩(仅限于内嗅皮层的萎缩)、边缘显性萎缩(主要在边缘区域萎缩)和典型萎缩(海马、颞叶、顶叶和额叶广泛萎缩)AD亚型。MA 是正在研究的数据集中最具代表性的聚类,并且在聚类内具有最高的变异性。需要强调的是,MA聚类包括以轻微和边缘优势萎缩模式分组的患者,以及可能一些早期典型的文献报道的AD患者。因为在本文中模拟了从疾病发作开始的萎缩轨迹,说明了CU Aβ阴性受试者的纵向结构变化。
通过模拟萎缩轨迹来连接文献中的萎缩模式,从而明确地进行疾病分期。MA和LPA聚类可能属于在两个不同阶段观察到的相同AD亚型,因为MA患者在 AD发病两年后达到LPA水平(基线)。MA 和 LPA 聚类之间认知截距(MMSE 和ADAS单词回忆)的差异支持它们反映不同疾病阶段的观点。LPA+ 簇似乎处于相同的萎缩途径上,但与MA和LPA簇相比,萎缩率更快。LPA+聚类中的患者在五个已确定的聚类中认知下降最为急剧,包括记忆力和定向能力。LPA+患者具有与MA和LPA 相似的APOE e4、教育和疾病发作。然而,作为认知储备的代表,LPA+ 的病前智力显著高于MA和LPA。作者认为,由于较高的认知储备,LPA+患者可以达到比MA和LPA集群更高水平的脑萎缩,同时保持相似的临床严重程度,直到他们达到AD发病。随时间推移 MA、LPA和 LPA+聚类中的脑萎缩动态不同。
然而,目前的数据似乎表明,这三个纵向萎缩簇属于AD中的同一萎缩途径,即中颞叶萎缩途径。这种有充分记录的途径中的萎缩被证明与自体解剖的神经原纤维缠结病理学相关。尽管这三个聚类(MA、LPA 和 LPA+)属于相同的萎缩途径,但它们的萎缩率和认知能力下降的速度差异很大,这可能具有重要的临床意义。这些观察到的差异可能是由于保护和危险因素以及潜在的伴随非 AD 脑部病变的综合作用。例如,Ferreira及其同事发现小血管疾病标志物的位置和频率在 AD 亚型之间存在差异。
本文中HS聚类类似于先前神经病理学和神经影像学亚型研究中描述的海马保留亚型。与其它AD亚型相比,这种亚型常以皮质萎缩为特征。本文中HS聚类的一些特征包括陡峭的萎缩轨迹,较低频率的APOE e4等位基因、高病前智力、受教育程度更高、早发型AD,这与先前研究报道的海马保留亚型相关特征一致。该聚类的频率最低,这也与以前的研究一致。显著受影响的构造和概念实践是海马保留亚型的一个关键特征,这在本次研究中也得到了证实。MA和HS聚类协方差模式之间的比较揭示了这两组之间的网络差异。在MA中,由于疾病引起的解剖学差异主要局限于AD发病时作为网络组合的内侧颞叶和皮质区域。另一方面,AD发病时的HS聚类网络差异也涉及基底神经节。此外,HS聚类在来自MA簇的一些腹内侧前额叶和内侧颞区的截距处具有更高的节点强度。基于所有这些结果,作者认为HS型萎缩模式代表了AD中一种独特的萎缩途径,即皮质途径。
解释DA聚类的萎缩轨迹具有一定挑战性,因为在临床发病时已经存在过度的额叶和颞叶萎缩。本文的数据显示,在萎缩的中颞叶和皮质途径的晚期阶段,AD患者可能会显示与DA集群相似的萎缩水平。因此,这组患者可能属于萎缩的两种途径中的任何一种。与LPA +类似, DA聚类中的认知储备(平均教育超过15年)可以解释更大的萎缩水平(在痴呆发病时)。DA聚类的萎缩模式与文献中报道的典型AD萎缩亚型相似,但频率较低。在最近一项使用tau PET的横截面聚类研究中,主要包括临床前AD,没有一个聚类具有类似于典型AD萎缩模式的tau空间分布,但观察到tau的皮质和内侧-颞叶模式。此外,另外两项关于前驱AD的研究发现,颞顶叶葡萄糖代谢降低或颞顶叶萎缩增加(典型的AD模式)的人群,但是样本频率较低,这与本文的研究结果一致。
本文研究解决了一些重要的方法学挑战,这是第一次基于纵向生物标志物轨迹建模发现AD萎缩亚型。纵向聚类方法的一个直接优点克服了当疾病进展时聚类(横截面分析)的受试者保持在同一聚类中的假设,这是不现实的。以前的研究已经采用了任意的时间尺度来模拟生物标志物的进展。本文的评估是基于明确定义的时间尺度,即从临床发病开始的时间。这种方法有助于追踪每个聚类病程早期的异常变化。以前,纵向解释不能直接与现有的数据相关联,因为它们没有锚定到特定的时间范围内。本文根据纵向Aβ阴性CU个体的数据集计算了每个患者的萎缩w值,校正了大脑形态中年龄的影响。
研究也有一些局限性。仅在AD异质性的背景下对萎缩轨迹进行了建模。不包括AD前扫描,降低了在诊断AD痴呆之前推断萎缩模式的能力。此外,未来在聚类研究设计中添加非AD病理的生物标志物将有助于了解AD亚型中合并症的作用。此外,本文纳入研究的AD患者的随访时间较短,未来对萎缩轨迹的重新估计将包括每位患者的更多MRI检查,以获得更好的评估。
总之,基于一个大型多种族AD痴呆患者队列,作者发现了五种纵向脑萎缩模式,将先前报告的AD亚型分为两种萎缩途径(中颞叶和皮质)。作者将AD亚型的横断面理解转移到纵向聚类。作者的研究是朝着回答一个紧迫问题迈出的一步,即AD中观察到的异质性是否反映了疾病阶段或不同的生物学亚型。在作者提出的模型的帮助下,有可能解开AD中的异质性,从而实现精准医疗,并有可能在未来改善疾病的治疗。


