免疫检查点抑制剂的慢性免疫毒性
时间:2022-10-31 17:59:59 热度:37.1℃ 作者:网络
前言
免疫检查点抑制剂(ICIs)已成为癌症治疗的核心支柱,在经济发达国家,几乎一半的转移性癌症患者有资格接受ICIs。截止2021年12月,有八种批准的药物用于17种不同的恶性肿瘤,这些药物在多种(新)辅助治疗和维持治疗中的应用日益增多。ICIs也经常用于联合方案,包括涉及其他类别ICIs、化疗、细胞治疗和/或靶向治疗的方案。这样,持久的反应越来越普遍,因此,描述ICIs治疗的长期生理意义变得越来越重要。
相比治疗后复发的患者,具有持久反应的患者似乎拓宽了外周T细胞和B细胞库,并似乎发展了免疫记忆。这些反应的分子基础并不完全清楚,但无论其作用机制如何,ICIs治疗效果的延长持续时间往往远远超过其药代动力学半衰期。这种持久的药效作用对毒性也有影响。
新出现的证据表明,持续毒性可能比预期的更常见,虽然这些慢性后遗症通常是低度的,但会影响内分泌、风湿病、肺、神经和其他器官系统。致命毒性还包括多种临床表现,可发生在0.4–1.2%的患者中。考虑到患者长期生存的可能性,这种风险是一个特别重要的考虑因素。
此外,免疫检查点阻断对多种免疫过程具有影响,包括动脉粥样硬化、心力衰竭、神经炎症、肥胖和高血压,这些尚未被描述,但仍然是一个重要的研究领域,可能与癌症幸存者有关。
免疫激活与irAEs
大多数免疫相关不良反应(irAE)的免疫激活可能与抗肿瘤免疫反应所需的活性相关,这种肿瘤特异性假说得到了治疗反应与irAEs发病率之间可重复的正相关关系的支持。然而也有证据表明,irAE具有与抗肿瘤活性无关的机制,包括涉及微生物组、病毒或组织特异性因子的机制。
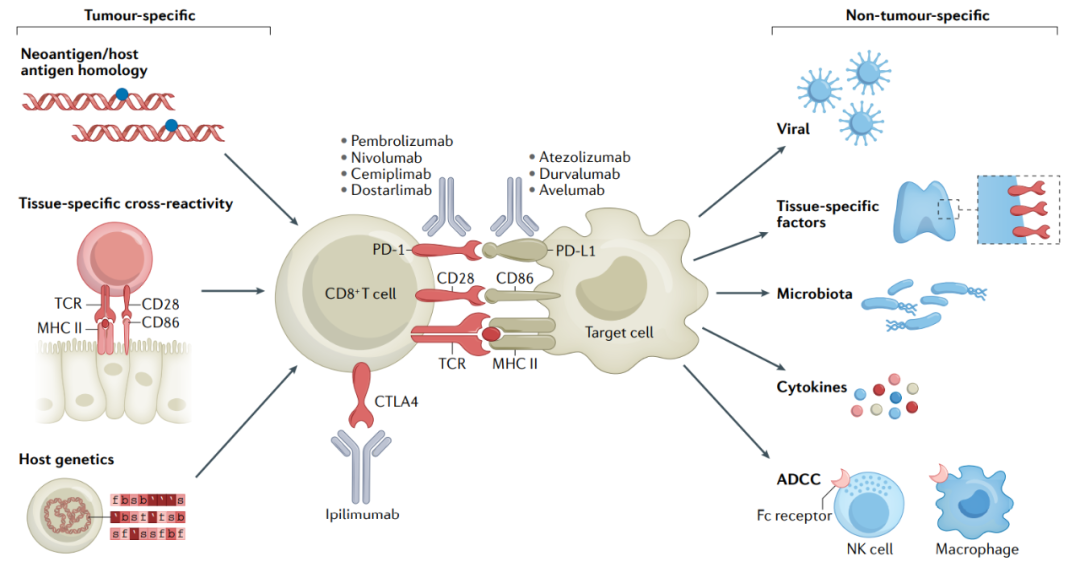 不同的ICI方案具有不同的毒性特征,对于含有抗CTLA4抗体的治疗方案(ipilimumab加nivolumab的组合为30–55%),高级别irAE通常以剂量依赖性方式发生,但对于作为单一疗法使用的抗PD-1–PD-L1抗体(10–15%发生率),不具有剂量依赖性。
不同的ICI方案具有不同的毒性特征,对于含有抗CTLA4抗体的治疗方案(ipilimumab加nivolumab的组合为30–55%),高级别irAE通常以剂量依赖性方式发生,但对于作为单一疗法使用的抗PD-1–PD-L1抗体(10–15%发生率),不具有剂量依赖性。
irAE基本上可以发生在任何器官系统中,包括心脏、骨髓、肾脏、骨骼、垂体和其他器官。irAE最常发生在治疗的前三个月,也可在治疗期间的任何时间出现,甚至在治疗结束后的几个月出现。尽管缺乏来自随机临床试验的有力证据,但通过提供症状管理、停用ICIs和服用大剂量糖皮质激素,急性重症IRAE可得到合理有效的管理。
大多数irAE在治疗过程的早期出现,但也可能出现延迟事件,即治疗1年后出现的irAE。在涉及118名患者的一项研究中,高级别、延迟性irAE的估计发病率为5.3%。最常见的迟发性irAE是结肠炎、皮疹和肺炎,两名患者死亡。值得注意的是,大多数患者(74%)在irAE发病时接受抗PD-1抗体治疗,12%的患者在前3个月内停止治疗,14%的患者在3个月以上停止治疗。这些观察结果强化了这样一种观点,即irAE(急性或延迟)可能在停药后偶尔出现,但通常发生在积极治疗期间。
慢性irAEs
到目前为止,由于急性irAE的临床表现更为显著,需要紧急治疗,因此受到了大部分关注。然而,数据表明,慢性irAEs比以前认识到的更普遍。慢性irAE的定义缺乏普遍共识,这里将其定义为ICIs停止治疗后irAE持续时间≥12周。根据这个定义,大约43%的患者至少具有一种慢性irAE。
慢性irAE缺乏共识的原因可能有几个。首先,大多数急性irAE至少在使用类固醇后会有所改善,并且通常会通过交替疗法解决。其次,临床试验中的不良事件报告往往侧重于最常见的治疗相关毒性,因此,低频事件通常被低估或忽略。第三,大多数初步临床试验都招募了转移癌患者,而描述转移性疾病患者的慢性和长期事件具有挑战性,因为这些患者通常预期寿命有限,因此限制了长期随访。这类患者还可能接受后续的全身治疗、手术和/或放疗,从而使毒性归因更加困难。最后,癌症患者中常见的多种共病的存在可能会进一步损害慢性irAE的识别。
然而尽管存在这些挑战,但在接受ICIs治疗的一部分患者中观察到的持久的临床反应使一些后续研究能够产生初步的见解。在这些研究中,内分泌疾病(如甲状腺功能减退和新出现的1型糖尿病)和风湿病毒性(如关节炎)成为最常见的慢性irAEs。其他各种低发病率事件也出现了,包括神经性疾病、皮炎和肺炎等。
内分泌irAE
最早发现的慢性irAEs是那些影响内分泌器官的疾病,在接受ICIs治疗的患者中有15–40%的患者出现这种情况。甲状腺机能减退症是最常见的内分泌irAE,在接受抗PD-1/PD-L1作为单一疗法的患者发生率约为10%,在接受ipilimumab加nivolumab的患者中发生率高达20%。
垂体炎几乎是接受ICIs治疗的患者所独有的。与接受抗PD-1/PD-L1抗体的患者相比,接受ipilimumab治疗的患者发生这种情况的频率更高(5–10%),发病时间更早(中位9–12周)。72。接受ipilimumab的患者的偏好似乎与垂体激素分泌细胞上CTLA-4的表达有关,从而导致抗体和补体结合。
其他内分泌irAE虽然不太常见,但也有类似的持续性。ICI诱导的糖尿病(ICI–DM)发生在<1%的治疗患者中,但可能表现为糖尿病酮症酸中毒,通常需要终生补充胰岛素。与垂体炎形成鲜明对比的是,ICI–DM几乎只见于接受抗PD-1/PD-L1抗体的患者,在接受抗CTLA-4单一疗法的患者中少见。
风湿病irAE
考虑到风湿病属于自身免疫疾病的范围,各种风湿病irAE的出现似乎并不令人惊讶。有趣的是,系统性红斑狼疮和混合性结缔组织疾病迄今为止与ICIs无关,类似RA、风湿性多肌痛症、多发性肌炎和Sjögren综合征都会发生。
大约一半的患者在停用ICI后会出现持续至少6-12个月的持续性关节炎症状。来自小范围的数据表明,ICI诱发的慢性关节炎对生活质量有较大负面影响,至少与其他irAE的影响相当。在其他风湿病irAE中,ICI诱发的干燥综合征与Sjögren综合征既有相似之处,也有不同之处,即口干症占主导地位,而不是眼部受累。
风湿性irAE的一个主要的挑战性问题是慢性低度毒性的管理,该问题适用于多个器官系统,但在风湿性irAE的情况下最为明显。风湿性irAE可能会损害生活质量,但通常不足以持续服用大剂量类固醇或停用ICI。因此,在进行ICI治疗的情况下,患者通常会继续接受低剂量类固醇和/或抗风湿药物(DMARDs)。
胃肠道irAE
在接受抗PD-1抗体治疗的患者中,结肠炎发生率高达5%,通常表现为腹泻,较少出现腹痛和便血。然而,任何级别的腹泻(44%)或严重腹泻/结肠炎(15%)在接受含ipilimumab的方案的患者中发生率更高。
肝炎发生在3-10%的患者中,无症状或可能表现为非特异性症状,包括不适和肌痛,较少出现黄疸和急性肝衰竭。迟发性腹泻也可能反映胰腺功能不全。在一个队列中,接受抗PD-1抗体的患者中报告了1%的脂肪痢发生率,中位发病时间为9个月。值得注意的是,这组患者中有10%出现胰腺萎缩的影像学征象,尽管这一发现在无症状患者中的机制和临床意义仍有待观察。
肺部irAE
肺炎是抗PD-1抗体发病率和死亡率的主要来源之一,最常见的表现为干咳、血氧饱和度降低和双侧毛玻璃影(包括间质性肺炎和机化性肺炎)。尽管大多数患者在症状出现后至少1-2年仍有持续的影像学表现,但这些患者中的大多数症状已得到缓解。
此外,还观察到罕见的慢性喘息或咳嗽患者,肺结核的再激活也可能发生。回顾性研究的数据表明,未接受ICIs的癌症患者的发病率相似,因此尚不清楚ICIs是否在这种效应中发挥作用。
心血管irAE
急性暴发性心肌炎是最早发现的与ICI相关的心血管irAE,通常表现为心电图紊乱,包括心律失常和并发肌炎。其他公认的心脏后遗症包括心包炎,这在接受抗PD-1/PD-L1抗体的肺癌患者中更常见,通常较少暴发性,对皮质类固醇更敏感。血管性irAE也有描述,包括急性血管炎,尤其是颞动脉炎和风湿性多肌痛。总的来说,这些事件可能发生在多达1–2%的接受治疗的患者身上。
涉及ICI和其他传统或靶向治疗的联合方案是另一个重要的研究领域,这两种疗法都可能有其固有的慢性心脏毒性。类似地,在RCC和其他几种癌症患者中,ICIs通常与血管内皮生长因子抑制剂(如阿昔替尼或伦伐替尼)联合使用,后者与许多心血管后遗症有关,包括高血压、血管疾病和心肌病。
神经性irAE
高达5%的患者会出现神经性irAE,在含ipilimumab的治疗方案中更常见。这些事件可影响神经肌肉接头(重症肌无力和Lambert–Eaton肌无力综合征)、中枢神经系统(脑膜脑炎)和周围神经(感觉和运动神经病,包括格林-巴利综合征)。
脑膜脑炎通常通过急性治疗得以解决,一些患者是否出现慢性缺陷尚不清楚。ICI相关重症肌无力的长期预后尚不明确,尽管在大多数患者中,ICI相关重症肌无力似乎要么完全缓解,要么通过疾病特异性治疗得到控制。ICI相关的格林-巴利综合征的病死率很高(19%),即使是通过免疫调节症状确实有所改善的患者,通常也有残余虚弱和/或感觉丧失。周围神经病变似乎是最有可能演变为慢性症状的神经系统疾病。据报道,大约2%的患者接受了针对切除黑色素瘤的辅助性抗PD-1抗体治疗,其中近一半患者出现慢性周围神经病变。
皮肤irAE
皮肤毒性是ICIs患者最常见的并发症之一,包括各种炎症性皮炎综合征、瘙痒和白癜风。这些事件通常会带来一个具有挑战性的临床困境,因为这些事件令人烦恼,但并不危及生命,而且似乎没有足够的症状来停止治疗,或者需要大剂量类固醇。ICI诱发的皮炎或瘙痒患者可能需要持续使用抗组胺药、局部类固醇和/或GABA能激动剂。根据已有的经验,尽管皮炎和瘙痒在停药后通常会持续数周或数月,但这些IRAE往往最终会消失。白癜风在黑色素瘤患者中比在其他癌症患者中更常见,通常无法治愈,并可能成为终身并发症。严重的皮肤反应,如斯蒂芬斯-约翰逊综合征和大疱性类天疱疮,也可能有危及生命的长期后果。
其他irAE
与急性IRAE类似,一系列广泛的低频事件可能最终变成慢性irAE。例如肾炎,在一个系列中,大约10%的患者需要血液透析,这些患者中有一半未能恢复足够的肾功能,需要进行肾脏替代治疗。
血液学毒性,包括特发性血小板减少性紫癜、再生障碍性贫血、噬血细胞性淋巴管组织细胞增生症和纯红细胞再生障碍性贫血,也都可能发生,尽管很少发生,但可能是致命的。眼部症状可能包括葡萄膜炎和结膜炎。其他症状,如疲劳,也可能在ICI停药后仍然存在。这些非经典irAE后遗症的病理生理学、发病率和时间过程尚未得到系统研究。
致命性irAEs
致命性irAE很少见,可能是由于类固醇和/或其他免疫抑制剂难以抵抗的严重自身炎症引起的。尽管这些事件明显属于与慢性毒性不同的类别,但在ICIs产生的潜在持久性反应的背景下,需要特别考虑致命事件的风险。
数据表明,致命性irAE的发生率较低,从0.4%的抗PD-1/PD-L1抗体单一疗法,到约1.2%的抗CTLA-4/PD-1联合方案。尽管有一定发生率,但与细胞毒性化疗、分子靶向治疗,甚至癌症的高风险外科手术相关的死亡率相比,这些死亡率相对较低。
死亡可能由各种器官特异性irAE引起。心肌炎是病死率最高的irAE(25–50%的患者),主要原因是重症患者出现难治性心律失常。肌炎也可伴有心肌炎,导致膈肌麻痹和呼吸衰竭。肺炎在10-15%的患者中是致命的,通常是由于呼吸衰竭。肝炎(由暴发性肝衰竭引起)和结肠炎(由结肠穿孔引起)也可导致死亡,尽管其发病率通常要低得多。
神经性irAE虽然不常见,但在10-15%的患者中也可能致命,通常是由于难治性或长期的格林-巴利综合征、脑炎或重症肌无力样综合征。值得注意的是,致命性irAE通常在治疗过程的早期出现,中位数为15天(联合治疗)和40天(抗PD-1抗体作为单一治疗),这表明ICI启动后迅速释放的预先存在的器官特异性炎症可能是这些事件的原因。
此外,还观察到致命性irAE患者年龄偏大的趋势,这表明年龄偏大和相关的功能储备减少可能使患者更容易死亡。长期免疫抑制可能是长期难治性毒性患者死亡的直接原因,因为机会性感染的存在也可能使临床过程复杂化。
再激发的安全性
irAE的另一个长期影响是,从治疗中获得一些益处但也有严重毒性的患者是否应该在irAE解决后再次接受挑战。临床医生可能会寻求重新挑战一部分患者,包括那些可能从进一步治疗中受益的早发毒性患者,或在ICI停止时仍有反应,后来出现疾病进展的患者。
目前缺乏关于再激发安全性的前瞻性数据。回顾性研究的数据表明,约25–50%的患者再次接受抗PD-1/PD-L1抗体的治疗后,IRAE复发。目前,确定哪些患者复发IRAE的风险最高具有挑战性。一个系列的数据表明,再次激发后,结肠炎、肺炎和肝炎的复发率高于其他irAE,年龄较大也与irAE复发有关。
停药和再激发之间的较长时间延迟可能会降低复发毒性的风险(例如,在因irAE停药超过12个月后再次治疗的患者)。临床医生在做出再激发的决定时应考虑irAE的类型和严重程度。一种尚未进行广泛临床试验的理论方法是,结合选择性免疫调节疗法恢复ICIs。例如,IL-6等细胞因子的靶向抑制理论上可以使抗肿瘤免疫反应与irAE脱钩,并允许安全的再激发。目前正在进行几项临床试验测试这些方法(NCT03293784、NCT03999749和NCT04940299)。
小结
ICIs在多种癌症中具有持久的反应以及通常可控制的毒性,因此成为癌症患者一种极具吸引力且广泛使用的治疗选择。这种广泛的应用拓宽了治疗相关和生存的考虑,而不仅仅是产生抗肿瘤免疫反应,从而对生活质量产生终身影响。因此除了典型的irAE外,了解阻断免疫检查点分子的慢性irAE以及对整体免疫功能的长期影响具有非常重要的意义。
: , 。 视频 小程序 赞 ,轻点两下取消赞 在看 ,轻点两下取消在看


