肠道粪副拟杆菌通过促进支链氨基酸降解缓解心血管疾病
时间:2022-11-03 23:48:57 热度:37.1℃ 作者:网络
心血管疾病(CVD)在全球范围内日益流行,每年导致1700多万人死亡。动脉粥样硬化以血管壁斑块形成、内皮功能障碍和动脉壁炎症为特征,是CVD的主要原因。动脉粥样硬化的发病机制复杂,涉及慢性炎症、基质变化和血脂异常。肥胖、吸烟、糖尿病、高血压、肠道生态失调、睡眠障碍、身体活动不足、环境应激和家族史都被定义为动脉粥样硬化发生和发展的危险因素。目前,动脉粥样硬化的临床治疗主要包括降脂或降糖药物、抗炎药物和改变更健康的生活方式。
近年来,组学技术快速发展,拓展了我们对动脉粥样硬化的理解,而肠道微生物群在CVD中的关键作用正在被探索和阐明。一些肠道微生物来源的代谢物显示出抗动脉粥样硬化或促动脉粥样硬化作用。例如,短链脂肪酸(SCFAs)和次级胆汁酸能改善动脉粥样硬化,而另一个例子是来源于肠道三甲胺的三甲胺- N-氧化物,它被证明可加速动脉粥样硬化病变的形成。然而肠道菌群和CVD之前仍有很多未知关联,研究肠道菌群对CVD的影响,将有助于开发针对肠道菌群的抗动脉粥样硬化疗法。
2022年10月17日,中科院微生物所刘宏伟/刘双江团队在Nature Metabolism上发表了题为《Gut Parabacteroides merdae protects against cardiovascular damage by enhancing branched-chain amino acid catabolism》文章,发现肠道中的粪副拟杆菌Parabacteroides merdae(P. merdae)中的porA基因能将支链氨基酸(BCAAs)降解为SCFAs,降低肠道和血浆中的BCAAs水平,降低动脉斑块巨噬细胞的mTORC1通路活性及IgA水平,改善小鼠动脉粥样硬化症状。该研究揭示了肠道菌群驱动的BCAA分解代谢在维持机体心血管健康方面的重要作用,为基于肠道菌群的抗动脉粥样硬化疗法提供了新靶点。

GMD能缓解高脂饮食的ApoE敲除小鼠的动脉粥样硬化
灵芝杂萜衍生物(GMD)有靶向肠道菌群缓解高血脂和肥胖的作用,然而其机制尚不明确。为了探究GMD是否能缓解动脉粥样硬化,作者用高脂饮食饲喂ApoE敲除小鼠诱导其动脉粥样硬化,然后分别用GMD(5 mg/kg和10 mg/kg)和阿托伐他汀处理小鼠9周。结果显示,GMD能显著改善小鼠总胆固醇、低密度脂蛋白、胆固醇、总甘油三酯和游离脂肪酸等指标。GMD小鼠血浆ox-LDL、MDA、hs-CRP、LPS和炎症因子水平也有显著降低。超声检测表明GMD显著改善了主动脉弓厚度和血流量。病理检查表明GMD组主动脉根部病变和总主动脉病变面积显著减少,而主动脉斑块胶原蛋白含量增加。综上所述,GMD具有抗动脉粥样硬化的作用。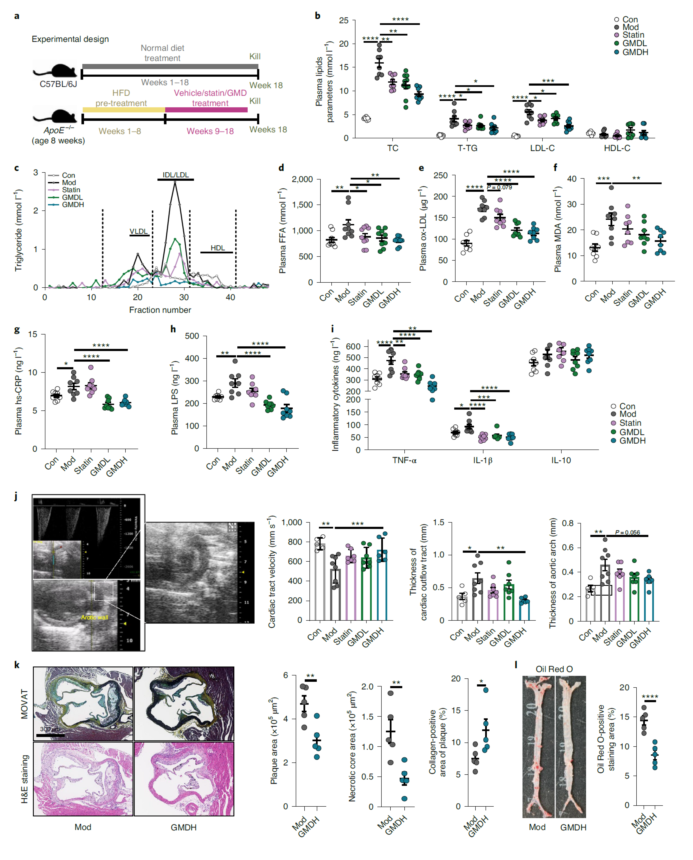
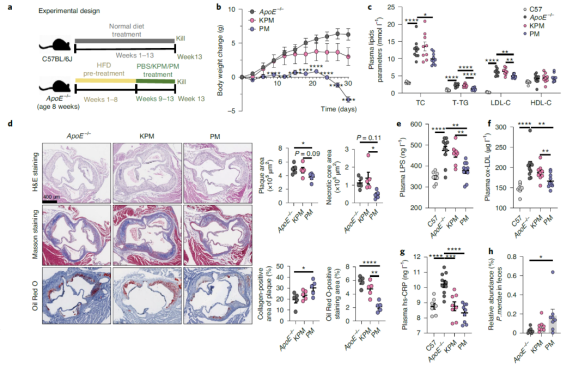
GMD可以调节高脂饮食ApoE敲除小鼠的肠道菌群
作者先前的研究表明GMD是一种强大的α-葡萄糖苷酶抑制剂,可以延缓肠道中碳水化合物的分解,改变碳水化合物在消化道中的分布,调节肠道微生物的修饰。
在本研究中,作者通过16S rRNA测序分析了GMD对高脂饮食的ApoE敲除小鼠肠道微生物组的影响,发现GMD处理的ApoE敲除小鼠肠道中P. merdae、Bacteroides acidifaciens和Bacteroides testinalis等物种的组成和丰度有显著差异。功能分析发现GMD处理组小鼠肠道菌群中BCAA降解和氨基酸代谢功能明显增强。丰度分析表明GMD组肠道中P. merdae和对照相比丰度高了420倍,是物种水平上变化最大的。基于两个肠道菌群验证队列的分析表明,与健康对照组相比,CVD患者的P. merdae丰度显著降低,而BCAAs水平较高。更重要的是,他汀类药物治疗不能改变P. merdae的丰度。综上而言,P. merdae可能是介导GMD缓解动脉粥样硬化的关键因素。
P. merdae能缓解高脂饮食ApoE敲除小鼠的动脉粥样硬化
为了进一步探究P. merdae在缓解动脉粥样硬化中的作用,作者将P. merdae、高温灭活的P. merdae或PBS给高脂饮食4周的ApoE敲除小鼠灌胃。治疗4周后第3天,P. merdae组小鼠在粪便中的P. merdae含量显著增加,小鼠的体重、血浆TC水平、总TG水平和LDL-C水平得到了改善;P. merdae处理还显著减少了小鼠主动脉根病变面积、斑块区域脂肪沉积和坏死核心区域,增加了斑块胶原蛋白水平;P. merdae处理小鼠的血浆LPS、ox-LDL、hs-CRP和肝脏脂肪变性水平也降低了。而高温灭活的P. merdae对体重、高脂血症和病变面积没有影响。16S rRNA测序发现,与GMD处理一样,P. merdae灌胃显著增加了高脂饮食ApoE敲除小鼠肠道中Akkermansia和Parabacteroides的丰度,增强了BCAA降解通路。这表明P. merdae缓解了动脉粥样硬化。

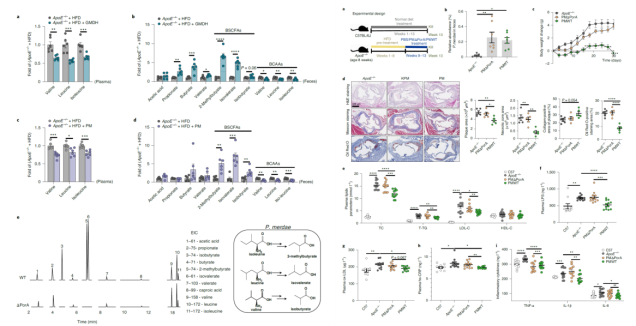
 P. merdae促进小鼠肠道中BCAA的降解
P. merdae促进小鼠肠道中BCAA的降解
众所周知,BCAAs可以在肠道中转化为支链短链脂肪酸(BSCFAs)。作者检测发现,GMD或P. merdae处理小鼠粪便和血浆BCAAs水平减少,而粪便中BSCFAs水平(包括异丁酸、异戊酸和2-甲基丁酸)显著增加,这表明GMD和P. merdae促进了肠道中BCAA的降解。
为了证实P. merdae对BCAAs的分解能力,作者用酵母提取物、蛋白胨和脂肪酸(YCFA)培养基体外培养,培养24小时后在培养基中检测到了异丁酸盐、异戊酸盐和2-甲基丁酸等BSCFAs。这表明P. merdae有将BCAAs转化为BSCFAs的能力。为了确定P. merdae中BCAAs相关的代谢途径,作者使用gutSMASH进行了泛基因组分析,鉴定出一个可以将BCAAs催化为BSCFAs的porA基因的同源基因。进一步,作者构建了一个porA缺乏的P. merdae突变株(PMΔPorA),GC-MS分析证实PMΔPorA无法将BCAAs转化为BSCFAs。而验证队列中,与健康对照者相比,CVD患者的P.merdae和porA基因水平显著降低。这表明P. merdae中porA基因发挥了将BCAAs转化BSCFAs的作用。
接下来,为了测试porA基因依赖的BCAA降解是否P. merdae的抗动脉粥样硬化作用关键因素,作者将PMΔPorA菌株或野生型菌株(PMWT)移植给高脂饮食的ApoE敲除小鼠。实验发现,porA基因的缺失不影响P. merdae的定植能力,但正如预测的那样,PMΔPorA组小鼠的血浆和粪便BCAAs水平远高于PMWT组,并且PMΔPorA菌株不能改善小鼠的血脂水平、炎症水平和动脉粥样硬化症状。值得注意的是,PMΔPorA组和PMWT组小鼠肝脏、脂肪和肌肉中BCAA关键分解代谢基因BCAT2、BCKD E1α、BCKD E1β、BCKD E2以及PP2Cm在的表达水平无差异。这表明,P.merdae的porA是促进小鼠肠道BCAA分解代谢、改善动脉粥样硬化的关键基因。
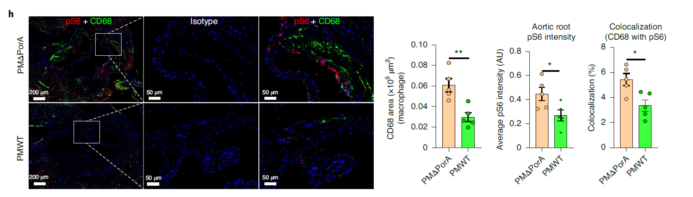
 P.merdae对mTORC1信号通路的抑制作用
P.merdae对mTORC1信号通路的抑制作用
血浆BCAAs升高与胰岛素抵抗呈正相关,限制饮食BCAAs可以改善肥胖和胰岛素敏感性。在本研究中,作者观察到高脂饮食的ApoE敲除小鼠在移植野生型P. merdae后高血糖和葡萄糖耐量有所改善,而移植PMPorA则无此效应。mTORC1通路的过度激活与动脉粥样硬化和胰岛素抵抗相关。BCAAs是mTORC1激动剂,补充BCAAs可激活mTORC1通路,加剧内皮细胞的炎症和氧化应激。
作者对野生型P. merdae组和PMΔPorA组的小鼠主动脉根进行免疫荧光染色,比较了动脉粥样硬化斑块巨噬细胞中mTORC1通路的激活,发现P. merdae组小鼠显示出较低S6磷酸化水平。这提示,BCAA-mTORC1通路介导了P. merdae抗动脉粥样硬化。此外,作者发现野生型P. merdae治疗小鼠的斑块巨噬细胞分泌的IgA水平明显低于PMΔPorA治疗小鼠,这证实了之前报道的BSCFAs能调节IgA的分泌。
 总结
总结
肥胖、血脂异常和肠道失调是心血管疾病相关因素。GMD已被证明可以通过调节肥胖小鼠的肠道菌群来缓解肥胖和高脂血症。在本研究中,作者发现GMD通过增加肠道中副杆菌的丰度和增强支链氨基酸分解代谢来预防肥胖相关的动脉粥样硬化。16S rRNA测序发现,GMD能显著增加肠道中P. merdae的丰度。给高脂饮食ApoE敲除小鼠移植P. merdae也能增强肠道BCAA降解,缓解动脉粥样硬化。机制上,P. merdae中的porA基因能将BCAAs降解为SCFAs,降低肠道和血浆中的BCAAs水平,降低动脉斑块巨噬细胞的mTORC1通路活性及IgA水平,改善小鼠动脉粥样硬化症状。敲除porA后,P. merdae不能缓解动脉粥样硬化。该研究发现了肠道菌群调控CVD的新机制,为CVD治疗提供了新的靶点。

: , 。 视频 小程序 赞 ,轻点两下取消赞 在看 ,轻点两下取消在看


