南开大学张新歌、王玉霞/山东省立医院毋中明团队《AFM》:胍基和半乳糖修饰具有氧气自给功能的纳米光敏剂可用于口腔生物被膜的清除
时间:2023-07-16 13:12:36 热度:37.1℃ 作者:网络

龋齿是由牙齿、牙齿表面的微生物生物被膜和饮食中的糖类之间相互作用引起的疾病。细胞外聚合物(EPS)基质可以保护致龋细菌变异链球菌(S. mutans)免受抗生素的侵害,阻止药物渗透。此外,生物被膜的复杂结构减少了基质内深层细菌获取营养物质和气体交换的机会,降低其代谢活性和对多药物的敏感性。因此需要开发新的抗菌策略清除龋齿生物被膜。在此,南开大学张新歌教授/王玉霞&山东省立医院毋中明教授合作,依据生物被膜特有的特征,设计了胍和半乳糖修饰的自供氧纳米光敏剂,利用胍的正电性增强纳米颗粒渗透进入生物被膜的效率,结合并杀灭膜内细菌。通过构筑自供氧平台,增强光动力治疗效果解离EPS基质,达到抑制龋齿进一步的目的。自供氧纳米光敏剂因半乳糖的引入具有良好的生物相容性,而胍与细菌表面的静电相互作用以及糖-凝集素的结合使得p(GF/GEF)-I具有优异的细菌捕获能力。在小鼠龋齿模型中,以常见的口服抗菌剂氯己定(CHX)为阳性对照,发现经532 nm光源辐照的p(GF/GEF)-I极大地减轻了龋齿病变的严重程度。该研究以题为“Guanidine and Galactose Decorated Nanophotosensitizer with Oxygen Self-Sufficient Capability for the Localized Ablation of Oral Biofilm”的论文发表在《Advanced Functional Materials》上。
在本研究中,构建了一种新型的胍和半乳糖装饰的自供氧纳米光敏剂p(GF/GEF)-I,并通过多种方法探究其物理化学和光学性能。加入二吡咯烷基碘化硼(BODIPY-I)作为光敏剂,通过可逆加成-断裂链转移聚合(RAFT)合成胍类聚合物,基于带正电的胍与带负电的细菌之间存在强静电相互作用,胍修饰的纳米光敏剂具有较好的抗菌活性和生物被膜穿透特性,渗透进入生物被膜后可有效杀灭膜内细菌。生物被膜深处呈乏氧微环境,通过引入全氟聚醚,利用氟碳结构的高携氧特性,成功构建自供氧系统,提高在乏氧微环境下光敏剂的光动力治疗效果,达到清除小鼠口腔牙齿生物被膜的目的。进一步引入半乳糖,改善了光敏剂的生物相容性,提高了其临床应用的潜力。
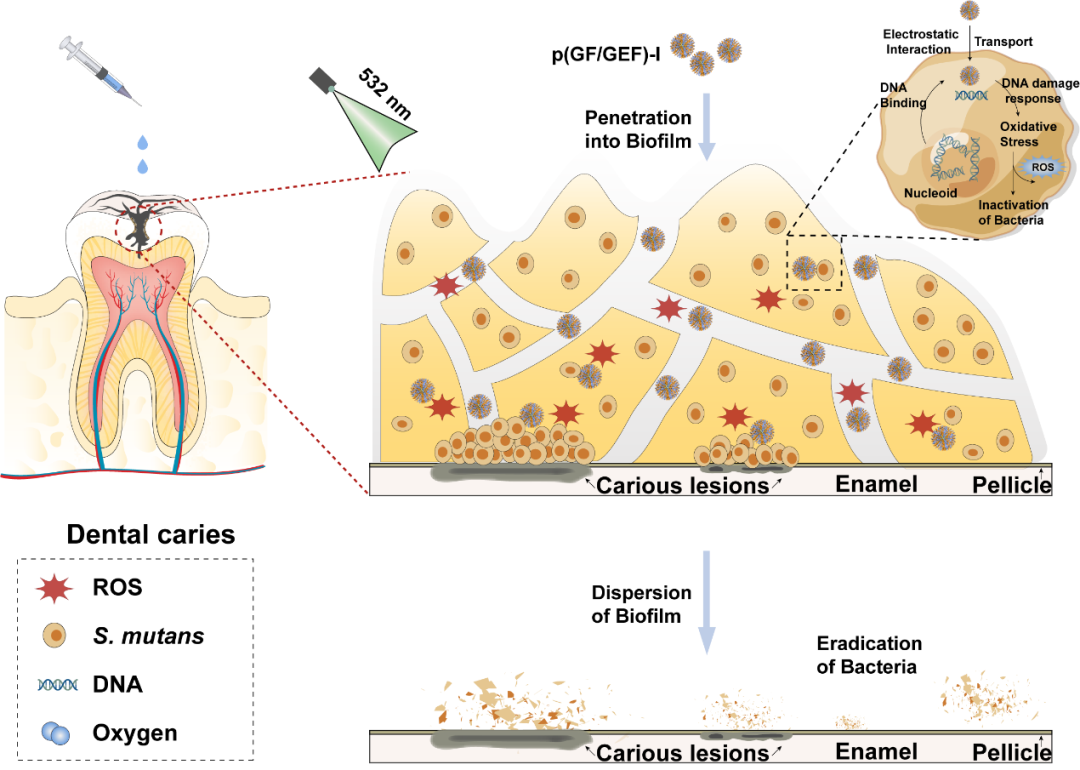
方案1. p(GF/GEF)-I介导的光动力治疗有效去除龋齿生物被膜的机制
【p(GF/GEF)-I的自组装构建】
利用两亲嵌段共聚物的自组装特性,通过超声乳化法制备了双链结合的纳米光敏剂p(GF/GEF)-I。使用TEM观察到光敏剂具有规则球状结构,DLS检测其流体动力学直径<200 nm,能够顺利进入生物被膜孔道。避光静置条件下观测p(GF/GEF)-I的粒径变化,发现在5天时间内粒径和PDI变化不大,表明光敏剂具有优异的稳定性。自供氧是提高光动力治疗效率的关键步骤,实验测得p(GF/GEF)-I在500 μg/mL浓度下的溶氧量达到13.5 mg/mL,远高于缺失氟碳链光敏剂的溶氧量,表明自供氧系统构筑成功。
我们探究了p(GF/GEF)-I对细菌细胞的靶向能力。与对照组相比,p(GF/GEF)-I具有优异的细菌粘附特性和抑制细菌粘附宿主细胞能力,这主要是由于纳米光敏剂可通过胍与细菌表面的静电相互作用,以及半乳糖与特异性粘附素结合作用靶向细菌,防止细胞感染。此外,纳米光敏剂在500 μg/mL浓度下,和对照组相比在细胞毒性上无显著性差异,说明p(GF/GEF)-I的细胞毒性可忽略不计。
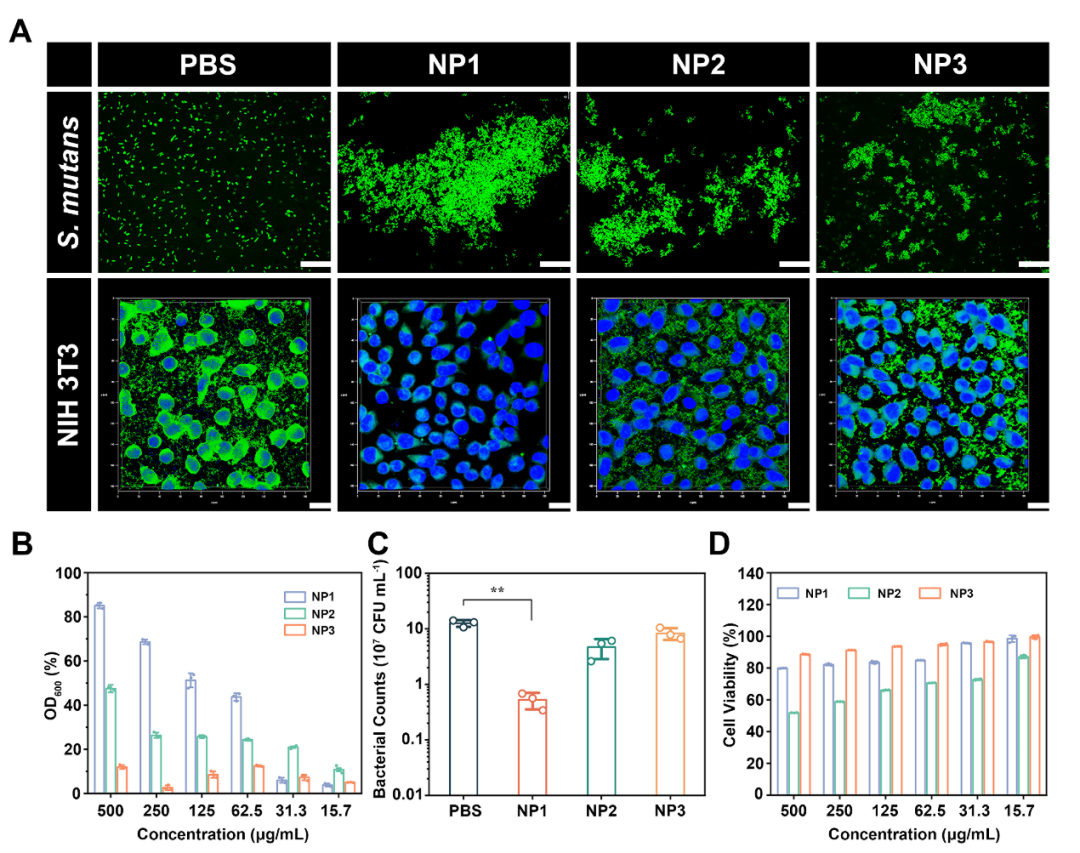
图1. 纳米光敏剂p(GF/GEF)-I的细菌靶向能力及生物相容性
【纳米光敏剂的光治疗效率及体外抗菌能力】
单线态氧(ROS)的产生是衡量光动力治疗效率的重要参数。通过DCFH-DA法评价纳米光敏剂的光治疗效果,发现双链比例为1:1(w/w)条件下,532 nm光源辐照8 min可产生大量ROS,证明其光治疗效率较高。进一步以致龋细菌S. mutans为模型菌评价p(GF/GEF)-I的体外抗菌性能。结果表明,以PBS组为阴性对照,胍抗菌效果达到了64%,而胍和光动力治疗协同达到了96%,展现了优异的抗菌活性。
由于p(GF/GEF)-I表面带正电荷,因此更易穿透和扩散到生物被膜中。荧光标记的纳米光敏剂与生物被膜共孵育60 min后几乎完全渗透生物被膜,这为杀灭膜内细菌提供了必要条件。通过一系列实验表明,纳米光敏剂在扩散进入生物被膜后,通过静电相互作用和糖-粘附素结合快速靶向膜内细菌,穿越跨膜通道进入细胞并结合DNA,致使细菌细胞发生氧化应激,产生大量ROS并导致细菌凋亡,从而实现杀死膜内细菌,防止因细菌重新定植造成的二次感染。
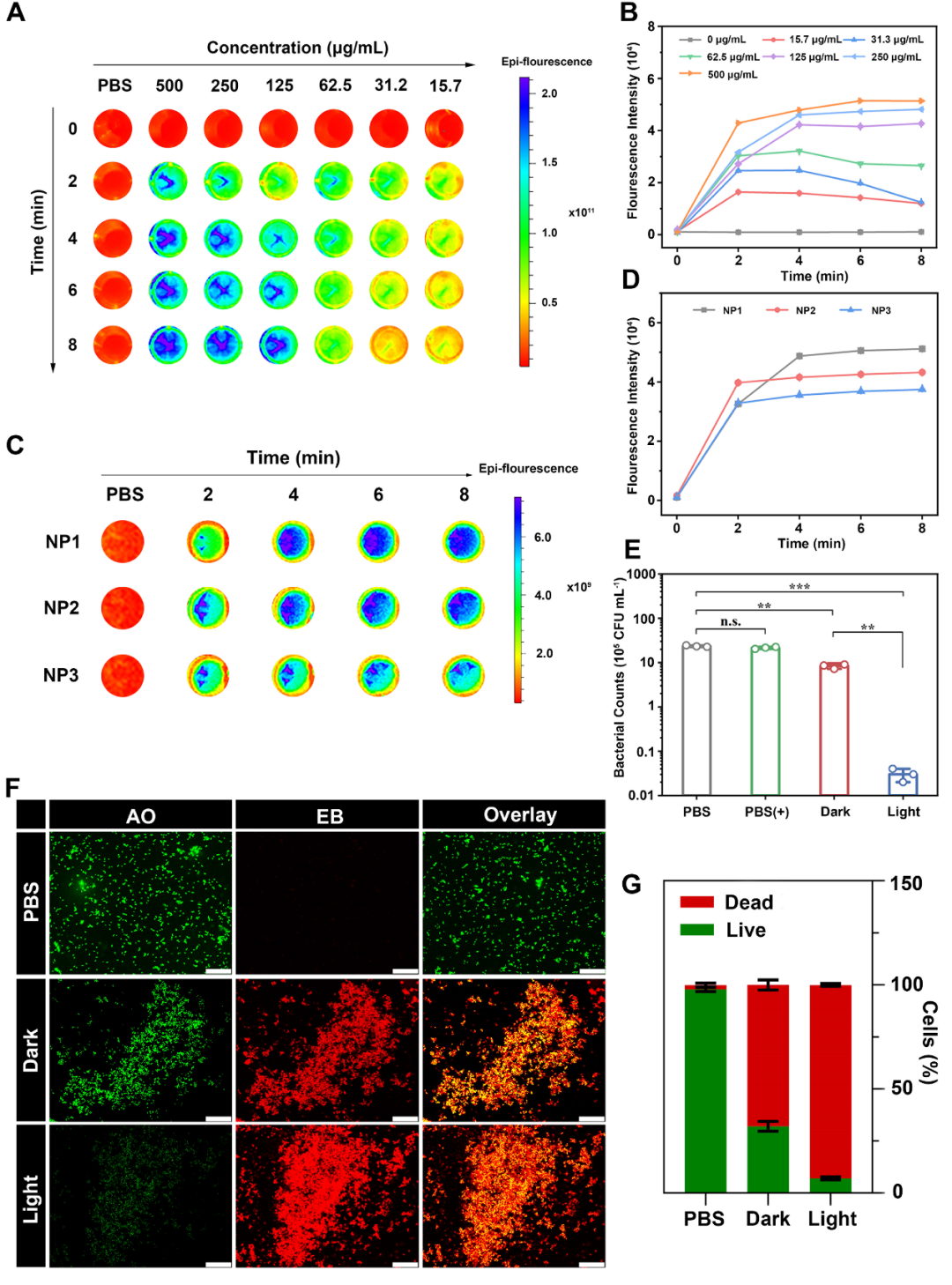
图2. p(GF/GEF)-I的光治疗效率及体外抗菌性能评价
【纳米光敏剂的生物被膜内抗菌机理】
为了探究p(GF/GEF)-I的抗生物被膜能力,分别通过体外抗生物被膜实验和人源性离体牙抗生物被膜模型评价了纳米光敏剂在体外的抗龋特性。与PBS相比,纳米光敏剂经光辐照后的生物被膜分散率分别达到89%和93%,表现出良好的抗生物被摸特性。而无光照条件下,p(GF/GEF)-I抑制生物被膜能力也达到了75%。以上结果进一步证实p(GF/GEF)-I可通过渗透进入生物被膜杀灭细菌,协同光动力治疗清除EPS基质,有效根除生物被膜。
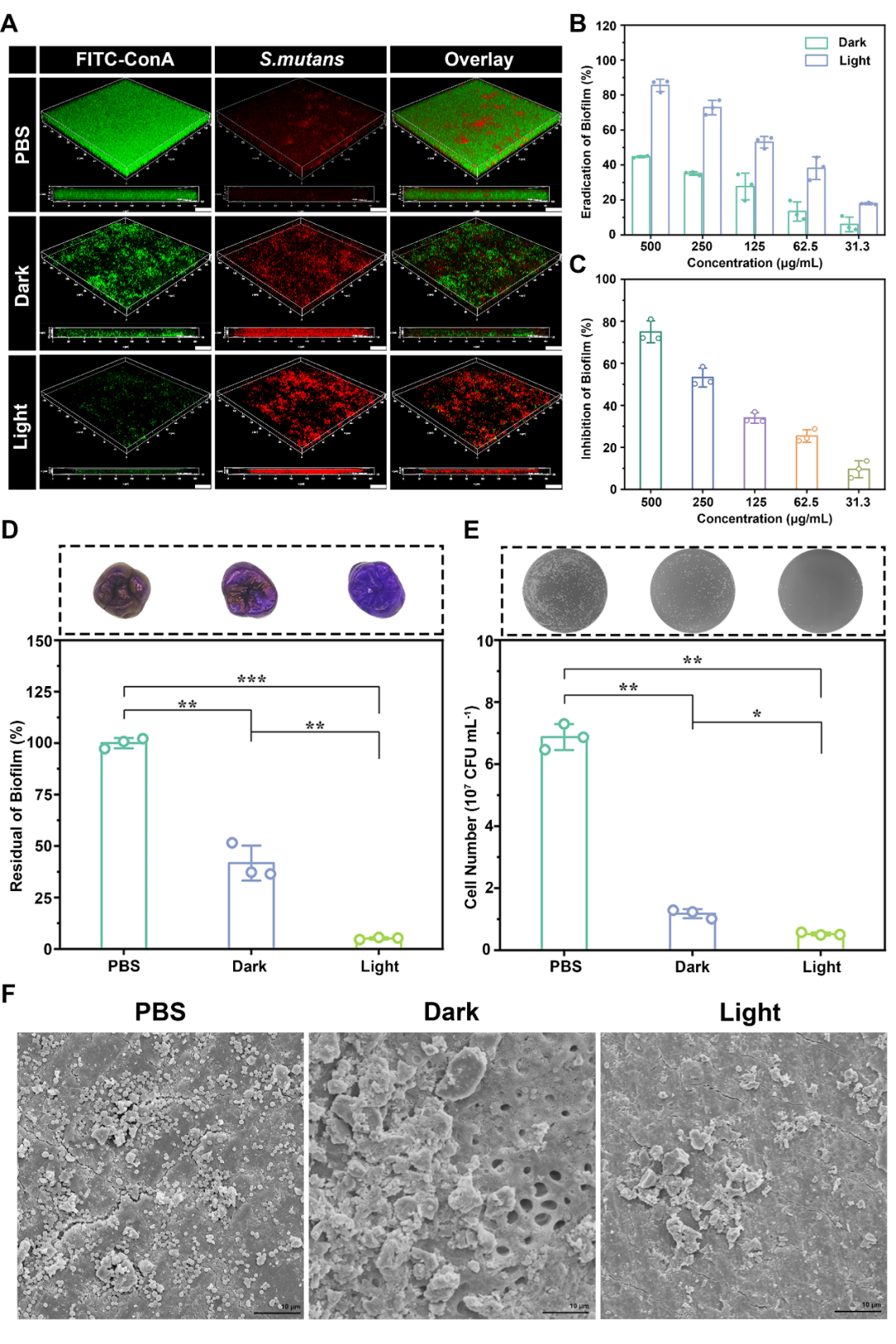
图3. p(GF/GEF)-I的体外抗生物被膜特性
为了验证p(GF/GEF)-I体内的抗生物被膜作用,我们根据所提出的方案在啮齿动物口腔生物被膜模型中建立生物被膜毒性。设立标准口服抗菌剂氯己定(CHX)为阳性对照组,PBS为阴性对照组。牙釉质随时间逐渐形成龋损,从牙釉质脱矿的初始区域到重度病变,最终发展为以牙釉质结构损伤和空洞为特征的广泛病变。定量龋齿评分分析表明,CHX与未光照的p(GF/GEF)-I具有相似的治疗效果,光照的p(GF/GEF)-I极大地减轻了龋齿病变的发生和严重程度,并完全阻断了广泛牙釉质损伤,防止在光滑和窝沟槽表面出现孔洞。上述结果表明,p(GF/GEF)-I与CHX具有相似的龋化抑制效果,而光照下的联合治疗显著防止了严重的牙釉质损伤。
为了评估p(GF/GEF)-I的安全性,对接受治疗的大鼠牙龈和腭组织进行苏木精和伊红(H&E)染色,照片显示没有炎症反应、增殖性变化或坏死,证明

图4. p(GF/GEF)-I的体内抗龋特性
p(GF/GEF)-I良好的生物相容性。总之,结果表明,p(GF/GEF)-I利用其高渗透性和抗菌性能及光动力协同治疗可以有效抑制普遍的龋齿疾病的发展,而不会对体内周围软组织产生有害影响。
【小结】
本研究开发了具有氧自给能力的胍和半乳糖装饰的纳米光敏剂p(GF/GEF)-I作为治疗龋齿疾病的有效抗生物被膜手段,详细评价了纳米光敏剂的理化性质,体外抗菌活性和体内外生物被膜清除特性。根据生物被膜特有的理化性质,设计了一种新型聚胍自供氧纳米治疗平台p(GF/GEF)-I用于治疗龋齿疾病。带有正电荷表面的纳米粒通过静电相互作用和糖-粘附素作用靶向致病菌,进入细菌细胞并结合细菌DNA,诱导细菌细胞产生过量ROS,最终导致细菌的凋亡。而充斥在EPS基质中的p(GF/GEF)-I在经过532 nm光源照射后,产生ROS氧化多糖基质,最终破坏并降解生物被膜。此外,该工作发展的一种阳离子和光动力相结合的抗菌策略,为生物被膜引发的相关骨感染疾病的有效治疗提供了新思路。
原文链接:
https://doi.org/10.1002/adfm.202300474


