JCI:陈熹/闫超/尹荣合作揭示KRAS突变激活CD47实现肿瘤免疫逃逸
时间:2022-12-03 17:59:28 热度:37.1℃ 作者:网络
RAS(KRAS,NRAS和HRAS)是癌症中最常见的突变基因家族,约17%的实体瘤存在KRAS突变。KRAS突变是已知的三种最致命癌症——肺癌、结肠直肠癌和胰腺癌的重要驱动因素。
然而,自1982年RAS基因发现迄今40年来, RAS一直被称为“不可成药靶点”。2021年,首个靶向KRAS-G12C突变的共价抑制剂AMG-510(安进公司开发)获FDA批准用于非小细胞肺癌治疗,给靶向RAS带来一线曙光,但是该药的耐药性问题已经出现。因此,多种和KRAS抑制剂联合用药的策略正在临床试验之中,其中KRAS抑制剂和免疫疗法的联合治疗策略是目前最具前景的探索方向之一。
KRAS突变和肿瘤免疫逃逸的关系研究进展缓慢。2017年,英国Francis Crick Institute的Julian Downward课题组发现KRAS信号可以通过稳定肿瘤细胞中PD-L1的mRNA水平上调其蛋白表达,从而抑制T细胞对肿瘤细胞的免疫监视。2019年,安进公司的研究人员也证明KRAS-G12C抑制剂AMG-510可以通过抑制肿瘤中的PD-L1信号来促进抗肿瘤免疫。但是KRAS突变是否也在肿瘤细胞逃脱先天免疫系统的监视中发挥作用,仍是未知数。
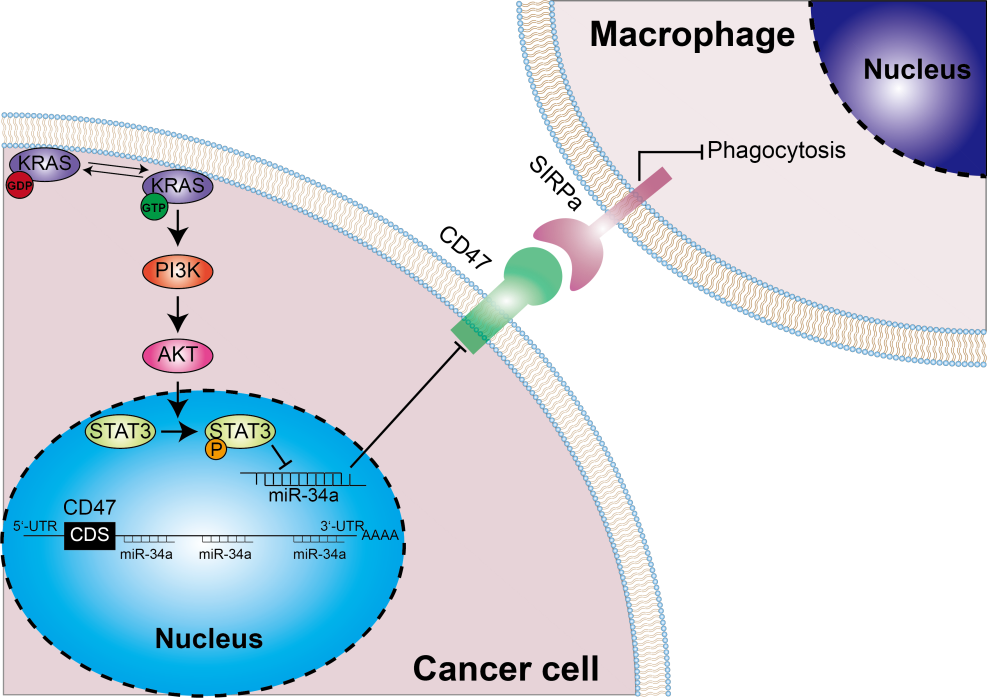
众所周知,肿瘤细胞常常高表达免疫检查点分子以实现免疫逃逸。肿瘤细胞表面的PD-L1可以和T细胞表面的PD-1结合,抑制T细胞对肿瘤细胞的攻击(don’t find me signal)。类似的,肿瘤细胞通过细胞表面的CD47与巨噬细胞表面的SIRPα结合,抑制巨噬细胞对肿瘤细胞的吞噬作用(don't eat me signal)。CD47在多种人类血液肿瘤和实体瘤中高表达,全球范围内已有多款CD47抗体药物进入临床试验。
近日,南京大学陈熹、闫超及南京医科大学尹荣联合课题组在 Journal of Clinical Investigation 期刊发表了题为:Oncogenic KRAS signaling drives evasion of innate immune surveillance in lung adenocarcinoma by activating CD47 的研究论文,该研究揭示了肺腺癌中KRAS突变通过激活CD47进而逃避先天免疫系统监视的新机制。
首先,研究团队收集了肺腺癌患者的临床样本,分离出肿瘤细胞后和体外诱导的巨噬细胞进行共培养,发现KRAS突变病人的肿瘤细胞对巨噬细胞的吞噬不敏感;KRAS-G12C突变的H358细胞系也有同样现象。然后,研究团队使用了3种小鼠肺癌模型(H358原位植瘤和2种KRAS突变驱动的转基因小鼠原发肺癌模型),在体内水平检测了KRAS突变的肺癌细胞和巨噬细胞的互作情况,发现在肿瘤进展的早期巨噬细胞具备吞噬肿瘤细胞的能力,但随着肿瘤的进展,巨噬细胞的吞噬作用逐渐弱化甚至消失。以上实验在体外和体内验证了KRAS突变驱动的肿瘤天然免疫逃逸现象。
同时,研究团队还检测了肺腺癌患者临床样本中CD47的表达水平,发现CD47在KRAS突变肿瘤中的表达量相对KRAS野生型肿瘤更高。在KRAS驱动的肺癌小鼠模型中,敲降CD47可显着提高巨噬细胞对肿瘤细胞的吞噬,表明CD47是KRAS驱动肺癌细胞抗巨噬细胞吞噬作用的必要条件。
在探究KRAS突变上调CD47表达的分子机制的过程中,研究团队首先发现CD47存在由miR-34a介导的转录后调控现象,接下来验证了KRAS突变对miR-34a的负调控作用,随后通过一系列的分子生物学和药理学实验,该课题组证明突变的KRAS通过激活PI3K-STAT3信号从而抑制miR-34a的表达,进而缓解miR-34a对CD47的转录后抑制作用,最终导致CD47在肺腺癌细胞中出现异常的高表达。
最后,研究团队通过检测三个独立的肺腺癌样本阵列(约300例肺腺癌样本),证实KRAS突变状态与CD47表达呈正相关。同时,该课题组利用KRAS-G12C抑制剂AMG-510在体外和体内实验中对新发现的KRAS-CD47信号通路进行抑制,发现AMG-510可显着降低CD47的表达,并且增强巨噬细胞对肿瘤细胞的吞噬作用,最终恢复机体的先天免疫监控能力。
总的来说,该研究发现在肺腺癌中,KRAS突变可驱动肿瘤细胞膜上CD47的高表达,抑制巨噬细胞对肿瘤细胞的吞噬作用,从而导致肿瘤的先天免疫逃逸。这一发现首次将KRAS突变和肿瘤的天然免疫逃逸联系起来,不仅揭示了KRAS突变驱动肿瘤发生发展的新机制,也为正在进行临床试验的CD47抗体药物提供了新的生物标志物,还为KRAS抑制剂和CD47抗体药物的联合用药提供了理论指导。
据悉,该研究团队目前已与某著名药企达成战略合作,将共同开发一种专门针对KRAS突变导致肿瘤天然免疫逃逸的新型治疗方法,目前临床前试验数据已展示了良好的抗肿瘤治疗效果,有望快速推进至临床研究阶段。
该研究的两位通讯作者长期招收博士后,欢迎有识之士加入。
陈熹,南京大学生命科学学院教授,生化与分子系主任,国家优青、江苏省杰青。主要研究非编码RNA的功能及其转化应用,在Cell Res、Mol Cell、J Clin Oncol、Sci Adv、Brain等期刊发表论文60余篇,总他引逾11000次。
闫超,南京大学生命科学学院教授,生理系主任,国家级海外青年人才。实验室已建立从分子到细胞、从结构到功能、从动物模型到人源化模型的完整的RAS研究体系,在Nature、Cell Res、JCI、Cancer Res、Autophagy等期刊发表论文多篇,并与产业界开展了广泛合作。
原始出处:
Huanhuan Hu, et al. Oncogenic KRAS signaling drives evasion of innate immune surveillance in lung adenocarcinoma by activating CD47. JCI, 2022. doi:10.1172/JCI153470


