Nat Nanotech:厦门大学周子健等团队合作开发通过调节T细胞活性治疗癌症的化学策略
时间:2022-12-23 17:59:38 热度:37.1℃ 作者:网络
T细胞在依赖免疫激活的癌症治疗的免疫调节和预后评估中起着决定性作用。虽然特定的生物标记物决定了T细胞在肿瘤中的数量和分布,但对T细胞的原位活性研究较少。
2022年12月19日,厦门大学公共卫生学院周子健课题组、新加坡国立大学陈小元课题组与广州医科大学郭伟圣课题组合作,在Nature Nanotechnology 在线发表题为“Targeting the activity of T cells by membrane surface redox regulation for cancer theranostics”的研究文章。该研究设计了T细胞靶向融合脂质体,通过利用T细胞的表面氧化还原状态作为化学靶点来调节和量化T细胞的活性。配备2,2,6,6-四甲基哌啶(2,2,6,6-tetramethylpiperidine, TEMP)基团的T细胞靶向融合脂质体可以中和活性氧,保护T细胞免受氧化诱导的活性丧失。
同时,顺磁性2,2,6,6-四甲基哌啶1-氧基(2,2,6,6-tetramethylpiperidine 1-oxyl, TEMPO)自由基的产生允许磁共振成像定量T细胞活性。在多个小鼠模型中,T细胞靶向融合脂质体导致有效的肿瘤抑制和早期预测放疗结果。总之,这项研究使用化学靶向策略来测量T细胞在癌症治疗中的原位活性,并可能为工程T细胞用于癌症治疗提供进一步的理解。

免疫激活相关癌症治疗的疗效在很大程度上依赖于肿瘤浸润T细胞的表现。在过去的几十年里,在工程T细胞用于癌症治疗方面取得了重大进展,如嵌合抗原受体T细胞免疫疗法和T细胞受体工程T细胞疗法。不幸的是,基于T细胞的癌症治疗在临床上的广泛有效性仍然是难以捉摸的。一个主要的警告是,免疫抑制肿瘤微环境可能会对T细胞的生存、增殖和细胞毒活性构成巨大挑战,当它们到达肿瘤区域。此外,肿瘤的异质性进一步使这种情况复杂化,临床中对免疫治疗有反应的患者的综合比率低至30%或更低。因此,评估肿瘤中T细胞的状态对于癌症免疫治疗的免疫调节和预后评估至关重要。
虽然传统的活检方法被认为是金标准,但其侵入性和准确性的缺乏需要寻求替代方法。为此,非侵入性和解剖性评估体内T细胞的分子成像方法已经获得了很大的动力。目前针对T细胞特定生物标志物的策略已被广泛利用,以揭示肿瘤中T细胞的种群和分布。然而,最近的研究表明,在卵巢癌和结直肠癌中,只有10%或更少的肿瘤浸润CD8+ T细胞具有识别和杀死肿瘤细胞的活性,而T细胞浸润在临床上已成为一种主要的预后标志物。因此,深入了解T细胞在肿瘤中的原位免疫活性对于更好的免疫调节和癌症治疗的预后具有吸引力。然而,分子成像方法描述肿瘤中T细胞的原位免疫活性仍然是一个艰巨的挑战。
肿瘤微环境不仅由肿瘤细胞、免疫细胞和细胞外基质组成,还包括pH值、生长因子和活性氧(reactive oxygen species,ROS)等生理环境。最近癌症治疗学的进展经历了从直接靶向肿瘤细胞到与肿瘤微环境的生理条件(例如pH值和ROS)合作的范式转变。鉴于ROS在直接杀死癌细胞方面的细胞毒性,促进肿瘤中ROS的生成已被广泛考虑用于癌症治疗。然而,肿瘤中的ROS水平过高也会威胁到免疫细胞的生存和功能,而免疫细胞对于通过全身免疫反应纵向抑制肿瘤生长至关重要。
T细胞膜表面的还原硫醇基团(-SH)数量的增加,受硫氧还蛋白(thioredoxin,Trx)和表面分子(例如,分化簇4或CD4)的还原形式的控制,与T细胞活性的增强有关,反之亦然。T细胞表面氧化还原状态主要由局部微环境决定,而不是由T细胞的细胞内氧化还原调节工具箱决定。
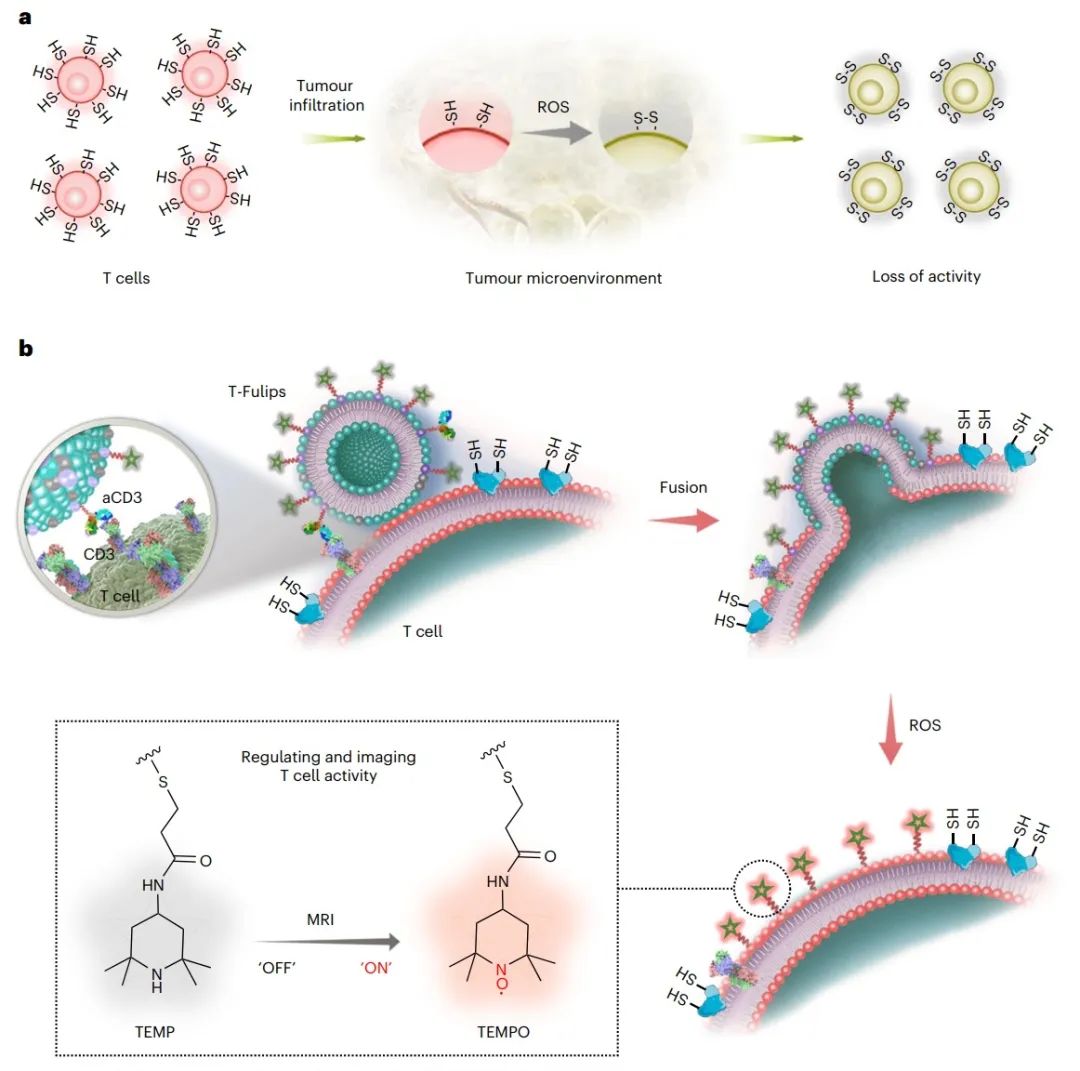
图1. 利用T细胞膜表面的-SH和S-S平衡来靶向T细胞的活性(图源自Nature Nanotechnology )
综上所述,该研究提出靶向T细胞的表面氧化还原状态可以通过与肿瘤微环境中的氧化应激合作来管理T细胞的活性。研究人员报道了一种化学靶向策略,通过利用肿瘤微环境中T细胞膜表面-SH和S-S基团之间的平衡来描述T细胞的活性。
研究人员设计了T细胞靶向的融合脂质体(T-cell-targeting fusogenic liposomes,T-Fulips),该脂质体由ROS清除基团、2,2,6,6-四甲基哌啶(TEMP)和T细胞靶向的抗cd3 F(ab’)2片段偶联在颗粒表面组成。T-Fulips能够靶向T细胞并与T细胞融合,导致TEMP基团装饰在T细胞的膜表面。因此,T细胞上的TEMP基团充当ROS“诱饵”,保护T细胞免受氧化诱导的表面-SH基团的损失,否则会降低T细胞的活性。同时,将抗磁性TEMP基转变为顺磁性2,2,6,6-四甲基哌啶1-氧基(TEMPO)自由基,为激活磁共振成像(magnetic resonance imaging,MRI)定量T细胞活性提供了显著的质子T1弛豫时间变化。

图2. 融合性脂质体的特征(图源自Nature Nanotechnology )
在证实T- Fulips在体外和体内调节和成像T细胞活性后,研究人员进一步研究了T- Fulips在多种小鼠肿瘤模型中治疗T细胞的免疫反应。此外,通过使用MRI作为一种非侵入性的解剖分子成像方法,对放射治疗(radiation therapy,RT)的肿瘤反应进行定量分层。这项研究以化学靶向方法为中心,利用T细胞的原位活性来改善癌症治疗。
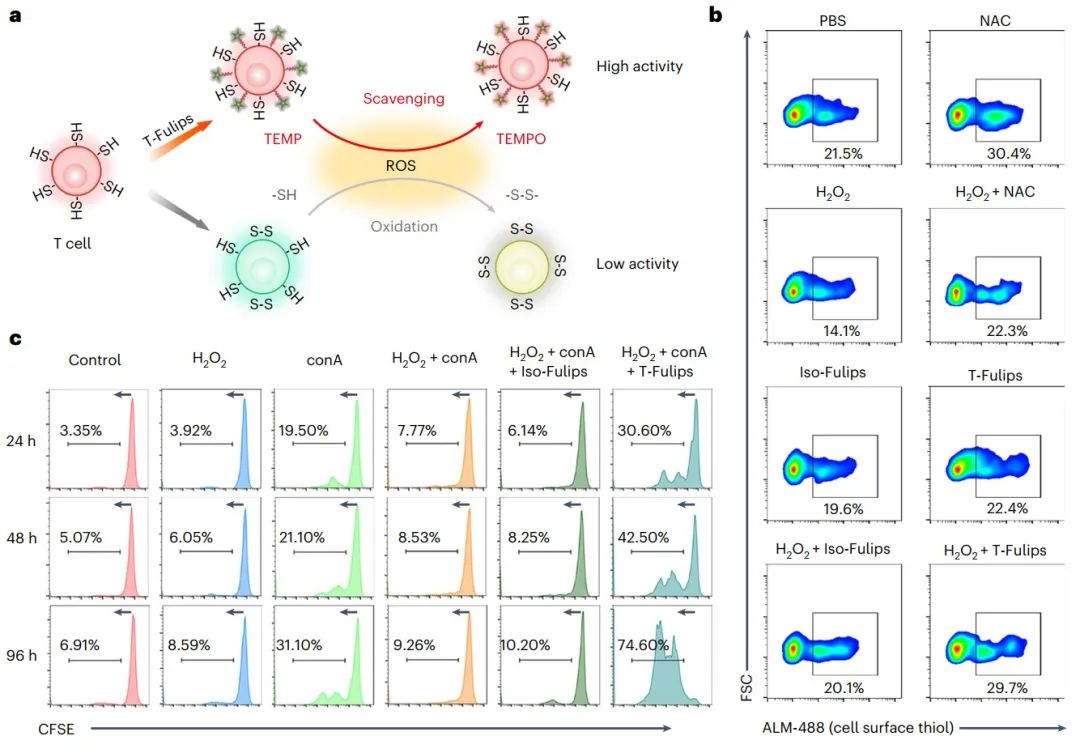
图3. T-Fulips通过调节T细胞表面的-SH基团来增强T细胞的活性(图源自Nature Nanotechnology )
总的来说,该研究提出了一种化学靶向策略,通过利用体外和体内的表面氧化还原状态来描述T细胞的活性。开发的T-Fulips配备了TEMP组来中和ROS并保护T细胞免受氧化诱导的活性损失。同时,顺磁性TEMPO自由基的产生允许MRI定量T细胞活性。该研究使用化学靶向策略以可视化的方式调节T细胞的原位活性,用于癌症治疗,并可能为工程T细胞用于癌症治疗提供进一步的理解。


