Nature Neuroscience:科学家揭示儿童创伤引起成年暴饮暴食的下丘脑-中脑神经环路
时间:2022-12-28 18:00:03 热度:37.1℃ 作者:网络
早年经历过儿童虐待等创伤性事件是引起成年后暴饮暴食等不良饮食习惯的主要风险因素。情绪化暴饮暴食特征为情绪引发的在短时间内大量进食。下丘脑是调控能量代谢的关键脑区。瘦素在发育早期起着营养因子的作用,血液瘦素水平调节基因表达和突触连接性,促进下丘脑神经环路的发育。
瘦素通过作用于下丘脑中的瘦素受体(Lepr)激活刺激多种信号转导途径,并调节神经元活动以抑制食物摄入和体重增加。下丘脑弓状核(Arc)和外侧下丘脑(LH)富集表达Lepr,其中LH可通过下丘脑-垂体-肾上腺轴协调对应激事件的行为和生理反应。

2022年12月12日加州大学Byung Kook Lim研究团队揭示了早期经历创伤引起成年后暴食行为的神经环路:LH–vlPAG,激活该环路可促进小鼠的暴食行为,抑制该环路则减少小鼠摄入高脂食物。
1. LH区域神经元响应暴食行为
研究人员通过将出生后的小鼠幼崽进行母婴分离,模拟早期创伤事件,这些幼鼠在成年后表现出暴饮暴食的症状,体重也增加。免疫荧光实验发现下丘脑弓状核(Arc)和外侧下丘脑(LH)在上述暴食过程中神经元活性增加。
经历母婴分离的小鼠LH区域Lepr 水平降低,但在其他脑区并未观察到这种降低。通过病毒策略特异性敲低LH区域Lepr引起正常小鼠出现暴食的行为,此外,也会加速早期母婴分离小鼠在成年后体重增加。LH脑区给与Lepr拮抗剂后也能促进小鼠体重的增加。
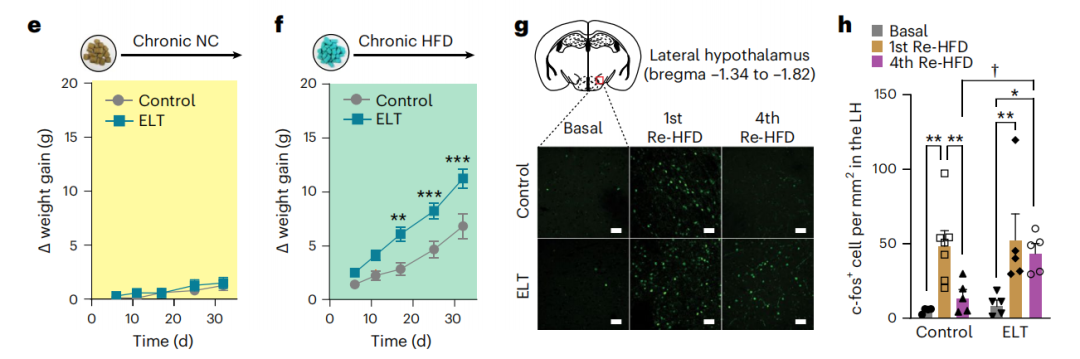
图1:LH区域神经元响应暴食行为
2.LH-Lepr→vlPAG缓解负性事件引起的暴食行为
光纤钙成像技术发现经历母婴分离的小鼠在暴食过程中LH区域Lepr 神经元活性明显增加。病毒示踪实验发现LH区域Lepr 神经元投射到腹外侧导水管周围灰质(vlPAG)、内侧视前区(MPA)、腹侧被盖区(VTA),并形成功能性连接。
通过化学遗传学技术慢性激活LH-Lepr→vlPAG神经环路后可促进小鼠高脂饮食行为,而在抑制该神经环路后则抑制小鼠高脂饮食行为。但在操纵LH-Lepr→MPA环路时并不会影响小鼠的高脂饮食行为。
慢性抑制LH-Lepr→vlPAG神经环路后能够明显抑制早期经历母婴分离小鼠的过度摄入高脂食物的行为,并能够减少体重。尽管LH-Lepr→vlPAG和LH-Lepr→VTA存在部分重合,但光抑制LH-Lepr→VTA 并不影响小鼠的摄食行为。这就表明LH-Lepr→vlPAG在早期经历创伤引起成年暴食的行为中发挥关键作用。
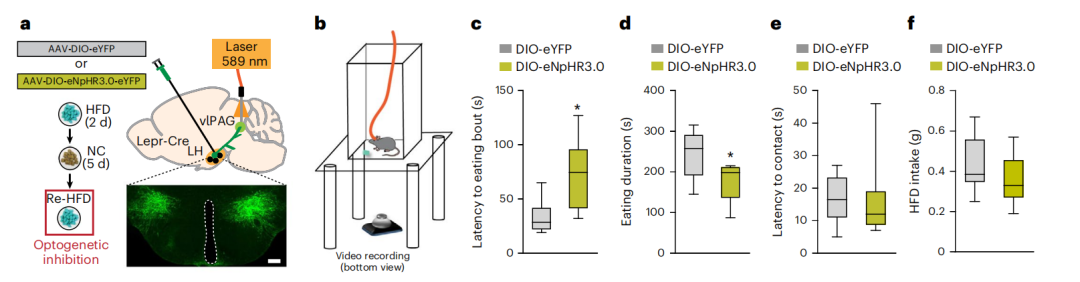
图2:光抑制LH-Lep→vlPAG缓解负性事件引起的暴食行为
3. vlPAG-Penk神经元是LH-Lepr神经元调控
暴食行为的关键下游神经元
vlPAG神经元表达内源性阿片肽Penk,该肽在调节疼痛感、食物摄入和奖励处理方面发挥着多种作用。病毒示踪实验发现vlPAG-Penk神经元接受来自于LH-Lepr神经元的输入。慢性抑制vlPAG-Penk神经元可促进正常小鼠摄入过量的高脂食物,引起体重增加,而在激活该类型神经元后能够明显抑制正常小鼠摄入高脂食物。
与此同时,慢性激活vlPAG-Penk神经元也能够明显抑制早期经历创伤的小鼠的暴食行为。这些结果表明vlPAG-Penk神经元是LH-Lepr?神经元调控暴食行为的关键下游神经元。
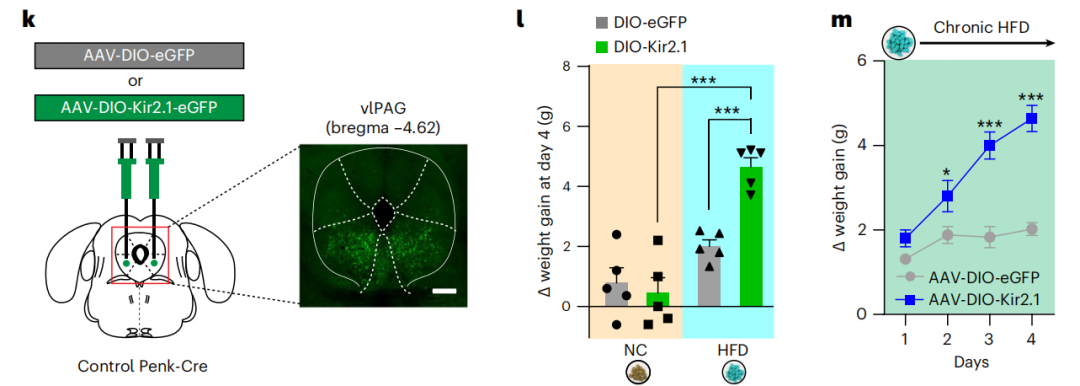
图3:抑制LH-Lepr神经元活性促进摄食行为
总结
本文发现在发育期经历创伤的小鼠在成年后容易出现暴食症状,引起肥胖。早期负性应激事件破坏了外侧下丘脑瘦素受体信号,并进一步揭示了外侧下丘脑瘦素受体投射到vlPAG-Penk神经元的环路介导其中。
原始出处:
Shin, S., You, IJ., Jeong, M. et al. Early adversity promotes binge-like eating habits by remodeling a leptin-responsive lateral hypothalamus–brainstem pathway. Nat Neurosci (2022). https://doi.org/10.1038/s41593-022-01208-0.


